负载STING激活剂c-di-GMP的介孔二氧化硅纳米颗粒对乳腺癌的免疫治疗增强
研究背景:
逆转免疫抑制肿瘤微环境(TME)是提高肿瘤免疫治疗敏感性的一项战略举措。最新研究表明,环二鸟苷酸(c-di-GMP或cdG)可诱导干扰素基因刺激因子(STING)途径激活抗原呈递细胞(APCs),增强肿瘤免疫原性。但是,研究显示cdG在血浆中清除快,膜通透性差,细胞内生物利用度不足。因此,Yi-Ping Chen在ACS Appl Mater Interfaces(IF=8.758)这一杂志发表文章,探索一种基于纳米药物的全面的原位接种方法,以触发抗肿瘤免疫。
技术路线图:
研究结果:
1. RMSN-PEG-TA的制备与表征
采用经典的软模板法合成带有荧光RITC的单分散二氧化硅纳米微球(MSNs) ,并进一步用PEG和TA进行了修饰,所获得的纳米颗粒命名为RMSN-PEG-TA, TEM图像显示其平均直径为26.7±4.8 nm(Figures 1a).。MSN直径非常小,能够很容易的通过肿瘤基质。MSN聚乙二醇化,用DLS确定平均大小,显示在完全培养基中较好的分散性。平均直径为46.6 ±0.3 nm(Figure 1b)。RMSN-PEG-TA的等电点(IEP)为8.87,在pH 7.4条件下表面电位约为+28 mV,适合细胞摄取和载药实验(Figure1c)。如Figure 1d所示,RMSN-PEG-TA的氮气吸附脱附等温线为IV型,总Brunauer Emmett Teller (BET)表面积为36m2/g。用BJH法计算得到的平均孔径为2.3 nm。
Figure 1

2. 在体外,cdG@RMSN-PEG-TA纳米颗粒处理激活免疫细胞因子的产生。
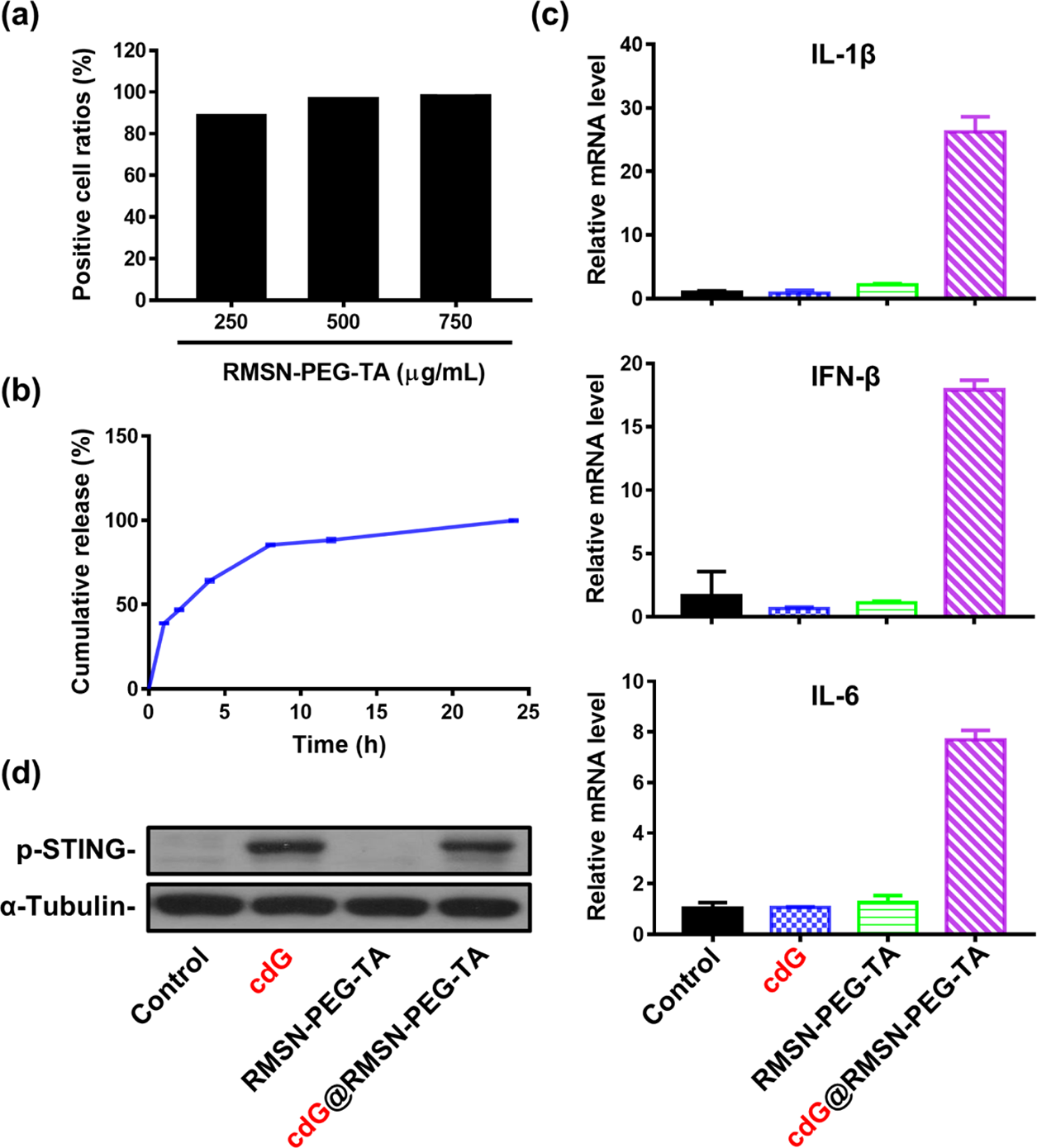
用不同剂量的RMSN-PEG-TA培养RAW 264.7细胞6小时,观察荧光密度(Figure 2a)。在37℃条件下,4.42% PEG- cdG体外释放谱指定时间为300/PBS。我们观察到85%的cdG在8小时内释放(Figure 2b)。为了证实cdG通过STING依赖的信号通路触发免疫反应。cdG@RMSN-PEG-TA处理后,参与STING激活的IL-1β, IFN-β和IL-6水平显著升高。RMSN-PEG-TA和free cdG不触发细胞因子的表达。cdG通过调节STING-TBK1-IRF3通路影响一型干扰素的产生,刺激固有免疫应答。WB结果显示cdG和cdG@
RMSN-PEG-TA处理组中STING磷酸化水平显著增加。结果显示RMSN-PEG-TA能够引起STING的激活,导致免疫因子的产生。
Figure 2
3.体内,cdG@RMSN-PEGTA的抗肿瘤作用增强
研究显示,CDNs(循环二核苷酸)可通过STING依赖信号通路刺激固有免疫和适应性免疫,导致肿瘤退化。接下来文章评估cdG@RMSNPEG-TA在接种4T1乳腺癌BALB/c小鼠中的抗肿瘤作用。cdG能够部分抑制肿瘤生长,cdG@RMSN-PEG-TA显示显著的抗肿瘤作用,这种作用可能是由于细胞吸收更好和cdG的原位持续释放(Figure 3b)。体重没有减轻说明在实验中没有表现出毒性作用(Figure 3c)。cdG@RMSN-PEG-TA处理组肿瘤最小(Figure 3d),cdG@RMSNPEG-TA组平均肿瘤重量比对照组低近4倍,比游离cdG组低2.18倍。
为了直接评估肿瘤的增殖情况,我们进一步通过免疫组化方法分析了肿瘤切片中核蛋白Ki-67的表达情况。Ki-67在cdG@RMSNPEG-TA治疗后表达最低(图4a),这与肿瘤抑制研究结果一致。染色发现cdG@RMSN-PEG-TA可以诱导更高水平的STING 磷酸化(p-Ser365),这表明通过STING依赖的信号通路可以抑制肿瘤生长(图4b)。
Figure 3
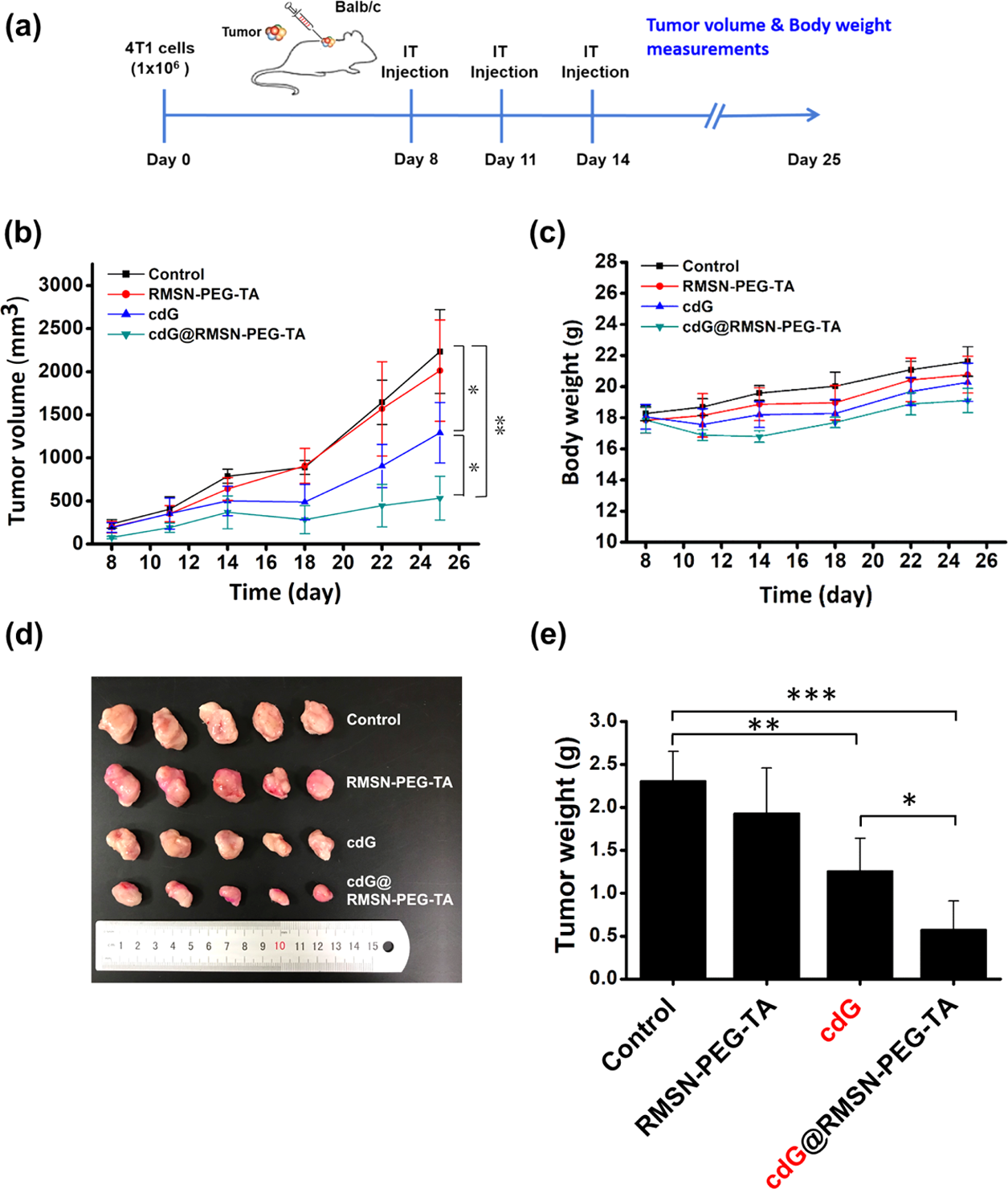
Figure 4

4. cdG@RMSN-PEG-TA纳米颗粒注射触发TME内免疫反应。
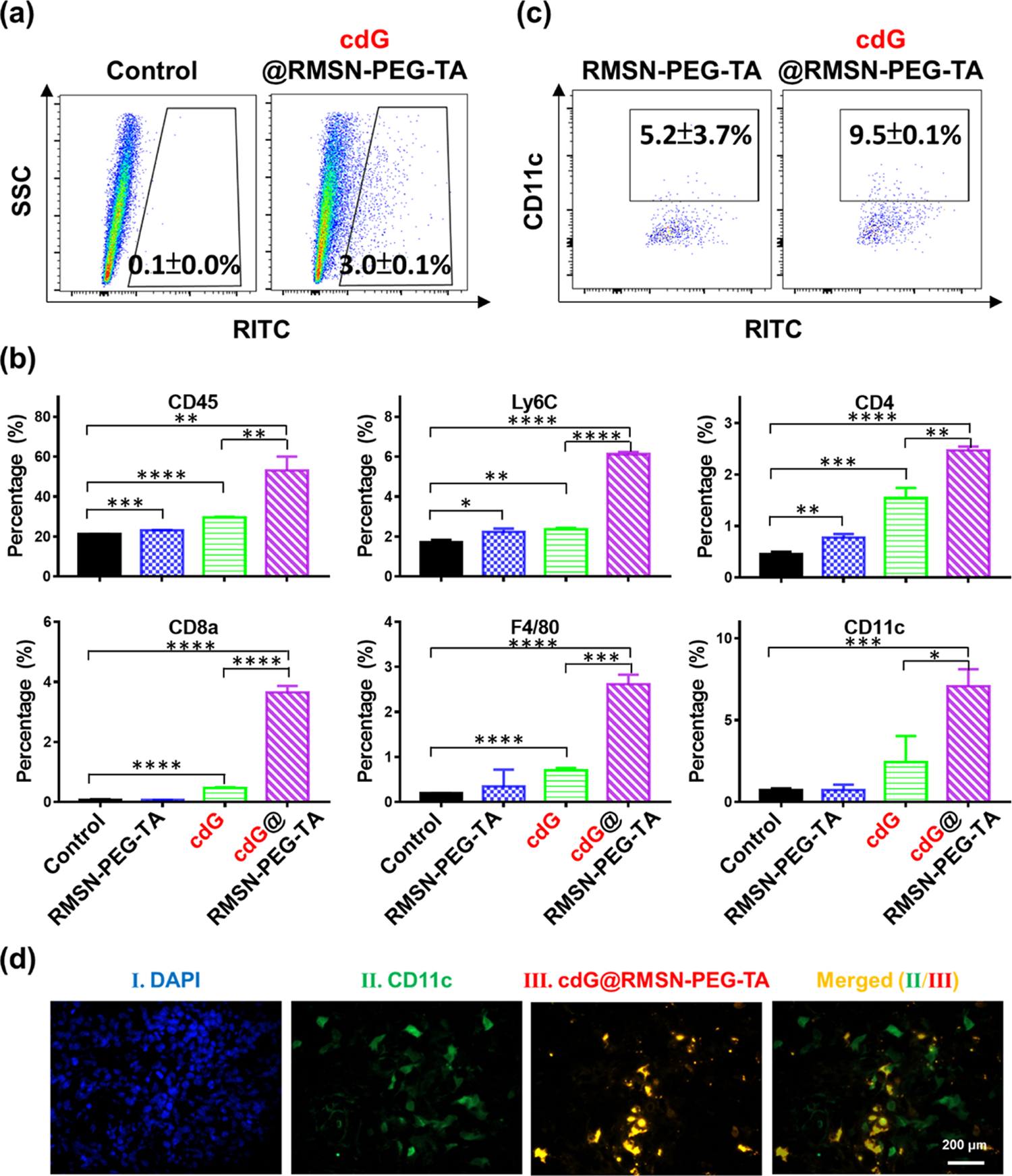
据报道,TME中STING通路的激活可促进淋巴细胞浸润,从而介导癌症免疫治疗。接下来,我们研究了携带4t1的Balb/c小鼠TME内抗肿瘤免疫的激活。如图3a所示,在第15天收集肿瘤,进行免疫荧光和流式细胞术分析。cdG@RMSN-PEG-TA处理24小时后,仍有3%的分离细胞检测出RITC阳性,表明cdG@RMSN-PEG-TA确实被在体内吞噬(图5a)。如图5b所示,我们发现空的阳离子RMSN-PEG-TA仅略微增强肿瘤中CD 45+白细胞、Ly6C+单核细胞和CD 4+ T细胞总数,而对CD11c+树突状细胞、F4/80+巨噬细胞和CD 8+ T细胞无影响。考虑到RMSN-PEG-TA单独不能抑制肿瘤生长,且体重没有变化(图3b,c),我们假设RMSN-PEG-TA免疫原性较弱。游离cdG处理组,肿瘤中F4/80+巨噬细胞、cd4 + T细胞、cd8 + T细胞明显增多。肿瘤浸润淋巴细胞的增强提示STING激动剂可以激活TME内的APCs,进而进一步激活下游的适应性免疫反应,导致细胞毒性T细胞的招募。与可溶性cdG相比,cdG@RMSN-PEG-TA制剂能显著促进STING激动剂刺激的肿瘤浸润白血病细胞,包括CD11c+树突状细胞、F4/ 80+巨噬细胞、CD 4+ T细胞和CD 8+ T细胞。cdg@rmsn - peg - tatated组肿瘤中cd8 + T细胞的百分比是cdG处理组的7.9倍。结果表明cdG@RMSN-PEG-TA治疗刺激了肿瘤中的淋巴细胞浸润,导致了较低的免疫抑制TME,这与我们的肿瘤回归研究一致。
由于树突状细胞通常被认为是STING依赖免疫反应的关键角色,随后分析了cdG@RMSN-PEGTA在肿瘤微环境中的定位,重点分析了CD11c+树突状细胞的群体。流式细胞仪结果显示,CD11c+树突状细胞非常有效地吸收了给予的纳米颗粒,特别是在cdG@RMSN-PEG-TA纳米颗粒治疗后(图5c)。免疫组化染色分别在肿瘤组织切片上证实细胞核定位,DAPI染色(蓝色)和抗cd11c抗体染色(绿色)的树突状细胞定位(图5d)。在merge并后的图像中观察到CD11c+细胞与cdG@RMSN-PEG-TA (红色)的共定位,这与图5c的流式细胞术结果一致。
Figure 5