通过单细胞RNA测序分析原发性胃腺癌的转录异质性
肿瘤异质性包括形态异质性和遗传异质性一直是肿瘤研究的热点,因为它对准确诊断和个体化治疗都提出了一系列挑战。胃腺癌(GA)是一种异质性恶性疾病的典型代表,具有不同的亚型和临床表现。
单细胞RNA测序(scRNA-seq)和微流控技术的进展为科研工作者提供了同时描述数千个细胞转录状态的方法。该方法允许对生物组织内的细胞特征进行分析,并已广泛应用于包括癌症免疫异质性在内的肿瘤生态系统分析。另一方面,放大内镜下的靶向活检仍然是最准确的GA诊断方法,因为它允许临床医生观察病变并捕获富含肿瘤细胞的组织。结合内镜活检的单细胞转录组实验将有助于更准确的遗传病病理诊断。
今天我们来讲一篇关于单细胞RNA测序分析原发性胃腺癌的转录异质性的文献,文章题名为:Dissecting transcriptional heterogeneity in primary gastric adenocarcinoma by single cell RNA sequencing,发表于GUT杂志,影响因子19.819。该文章主要对9个GA肿瘤样本和3个非肿瘤样本的27677个细胞进行了无偏转录组的scRNA-seq分析。
不同GA类型的单细胞转录组图谱
为了研究各种病变胃粘膜内的细胞群和相关分子特征,样本选取5个肠道组织学GA样本,3个混合组织学GA样本,1个弥漫组织学GA样本和3个对照样本。去除低质量细胞后,保留27677个细胞用于生物学分析,每个细胞检测到1227个基因和3809个转录物。在基因表达标准化和主成分分析(PCA)之后,使用基于图的聚类将细胞划分为14个聚类。这些簇可通过标记基因分配给9个已知的细胞谱系:上皮细胞(10411细胞,37.6%,用EPCAM、KRT18和KRT8标记)、壁细胞(215细胞,0.8%,用ATP4A标记)、内分泌细胞(486细胞,1.8%,用CHGA标记);B细胞(6131细胞,22.1%,用MS4A1和CD79A标记);T细胞(6819细胞,24.6%,用CD2、CD3D和CD3E标记);巨噬细胞(1053细胞,3.8%,用CD14标记);肥大细胞(527细胞,1.9%,用CPA3标记);成纤维细胞(1116细胞,4.0%,用ACTA2和COL1A2标记);内皮细胞(919细胞,3.3%,用ENG和VWF标记)。每个细胞谱系的比例在不同的样本中差异很大(图1F)。
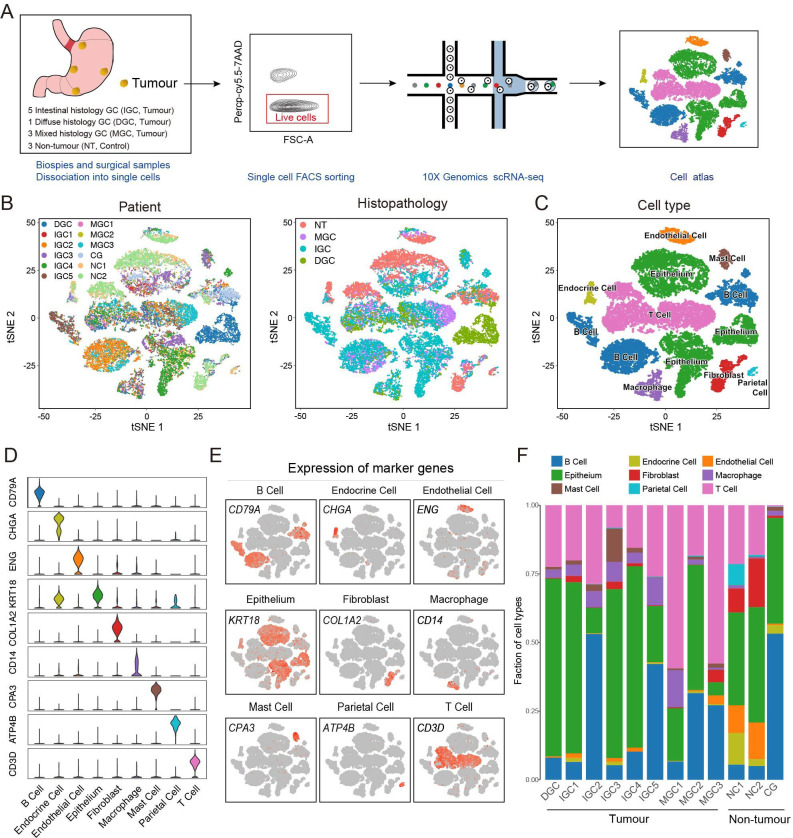
恶性与非恶性上皮的分类
为了区分恶性和非恶性上皮,利用k-means聚类算法,根据初始评分定义恶性上皮细胞和非恶性上皮细胞。由于TCGA大块组织的初始识别由于包含非上皮细胞而存在偏差,接下来在假定的恶性和非恶性上皮细胞之间产生差异表达基因,重新计算恶性/非恶性评分并分类上皮细胞。重复这个过程,直到分类结果稳定为止。最后,鉴定了5635个恶性上皮细胞和4776个非恶性上皮细胞。一组肿瘤特异性基因(CLDN4、CLDN7、TFF3和REG4),在恶性上皮上调。非恶性上皮表现出与胃粘液和消化酶分泌相关的标记基因的高表达,如MUC5AC、GKN1、PGC和LIPF。为了研究恶性和非恶性上皮的分子特征差异,又进行了基因集富集分析(GSEA)。与非恶性上皮相比,恶性上皮富含TNF-α/NF-κB、KRAS和IL-6/JAK/信号转导子和转录激活子。还有其他对癌症发展和进展至关重要的富集基因集,如MYC靶点、上皮-间充质转化和血管生成。
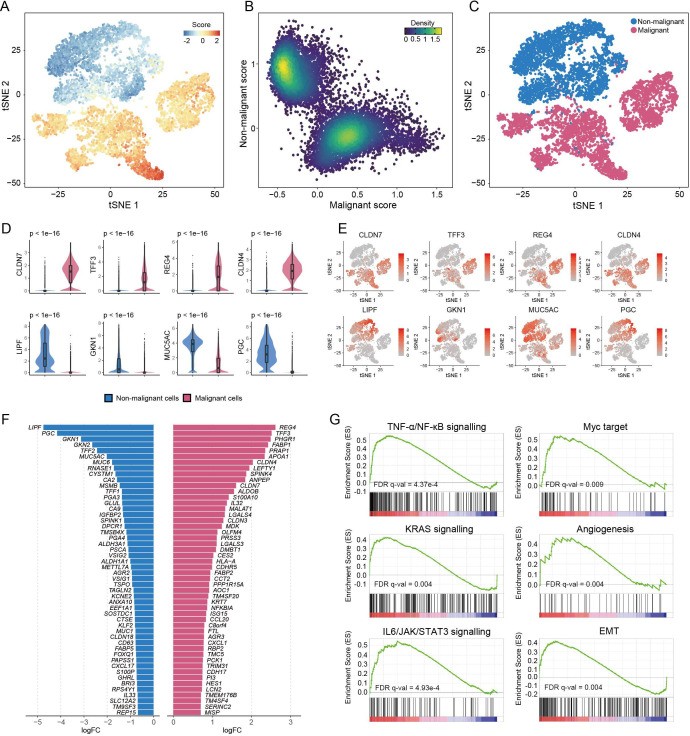
转录组分析揭示了主细胞、颈细胞和SPEM之间的关系
慢性炎症引起的癌前胃化生一直是胃癌发生研究的热点。一些研究已经报道,主要细胞可能异常分化为颈部细胞,然后由于壁细胞的丢失而导致粘液细胞化生,称为SPEM。根据数据,在癌组织和CG粘膜组织样本中很少检测到表达ATP4A和ATP4B的壁细胞。还对非恶性细胞进行亚聚类,发现了四个不同的组。G1组细胞占细胞总数的78.0%,通过TFF2、GKN1和MUC5AC基因的表达可区分为表面细胞。G2组的细胞表现出高水平的标记基因,如PGA3、PGA4和LIPF,并被定义为主要细胞。还发现G3细胞表达标志物PGA3和MUC6,可定义为增生性/肥大性粘液颈部细胞,免疫染色也验证了表达。
G4簇主要由癌变粘膜细胞组成。这些细胞的特征是颈部细胞标记物MUC6、化生转录物TFF2、CD44和SOX9以及主要组织相容性复合体II类(MHC-II)基因的高表达水平。免疫染色还显示,主细胞、颈细胞和SPEM共存于同一组织中,并且从胃腺基部到腺颈逐渐按主细胞、颈细胞和SPEM的顺序排列,支持主细胞到颈细胞到SPEM的过渡推断。接下来进一步研究细胞类型之间的潜在转换。从Monocle得到的时间轨迹轴表明,主细胞可以转分化为粘膜颈细胞,然后再分化为SPEM。特定代表性基因的时间表达动力学也标志着主要细胞向粘膜颈部细胞的进展,然后进入SPEM。本文的结果首次在单细胞水平上描绘了主细胞的潜在分化途径,并表明它们可能产生化生细胞。

GA恶性细胞的转录异质性
对5635个恶性细胞进行聚类分析,发现了5个显著的细胞亚群(C1-C5)。恶性细胞主要根据Lauren的组织病理学类型和背景因素(EBV感染)进行分组。观察到,9名患者的C1-C5比例不同。C1几乎全部(96.9%)来自弥漫型样本(DGC),而C2主要来自肠型样本(IGC)(97.1%)。C3含有混合型(MGC)和肠型样本细胞的混合物。C4主要来源于一个肠型GC样本(IGC3),C5包括来自EBV+患者(IGC5)的细胞。通过比较基因表达谱,我们发现C1/C2/C3与Lauren分类的三个典型亚型一致,C4/C5是两个新的细胞亚型,与C1/C2/3相比具有明显的分子特征。
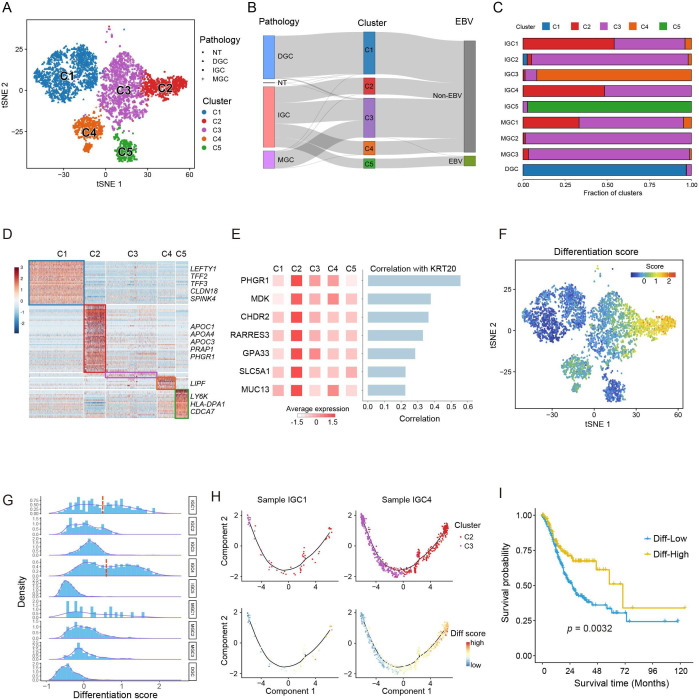
经典Lauren组织病理类型GA的分子特征
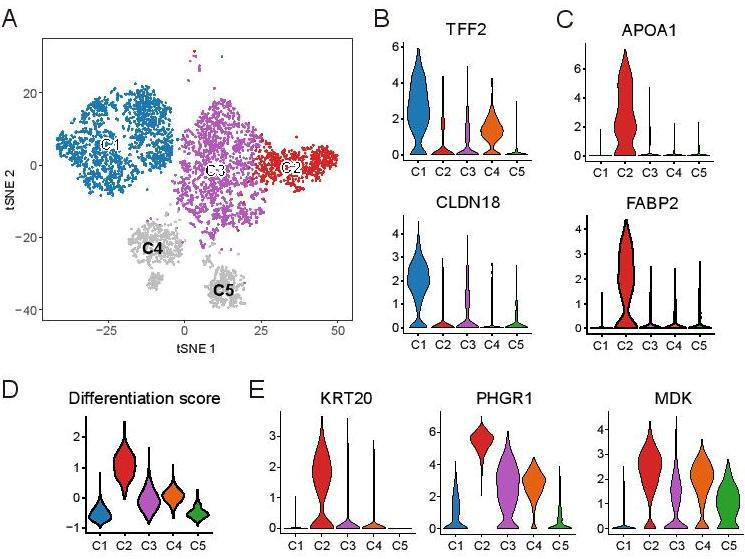
接下来我们研究了C1、C2和C3的分子特征(图5A)。C1高表达一些在胃上皮细胞中广泛表达的基因(如CLDN18和TFF2)(图5B),但在C2中很少检测到这些基因。相反,C2表现出与小肠相似的重要分子特征,这是由肠细胞标记物(如APOA1和FABP2)的广泛表达所支持的(图5C)。这些结果也通过KRT20和CLDN18免疫染色进行了验证(在线补充图S7)。C3没有显示出明显的分子特征,但部分表达了C1和C2的两个标记,表明它是C1和C2的中间亚群,而不是C1和C2的混合物。此外,我们观察到三个亚组之间的分化分数不同(图5D)。PHGR1、KRT20和MDK的表达水平在C2中最高,在C3中中等,但在C1中最低(图5E)。这些结果表明,C1代表一个未分化状态的亚群,C2代表一个不同的具有成熟肠细胞特征的分化良好的恶性细胞亚群,C3代表C1和C2之间的中间状态。我们的结果描绘了单细胞分辨率下不同劳伦组织类型的独特分子特征。
GA-FG-CCP的转录组分析
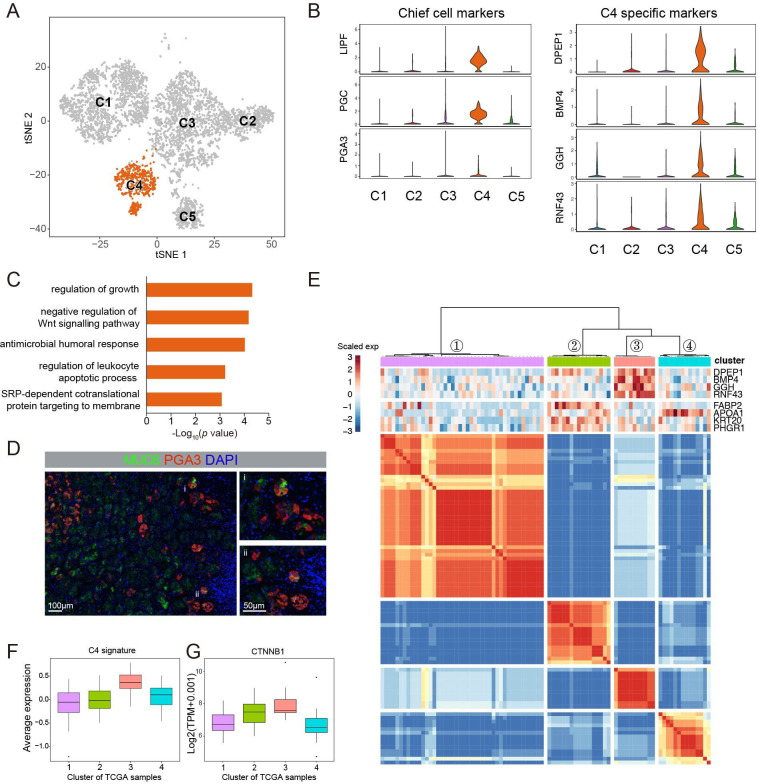
C4的恶性细胞主要来自肠型GA样品IGC3。H&E染色结果显示肿瘤位于胃底腺,主要由分化的颗粒细胞组成。scRNA-seq数据显示C4广泛表达主要细胞标记物(如LIPF、PGC和PGA3),并且表现出中等水平的分化评分。我们鉴定了一些在C4中特异表达的基因,其中一些被报道调控Wnt/β-catenin通路,即RNF43 35。GO富集分析证实C4中的特征基因富集用于调节生长和Wnt/β-catenin通路。免疫荧光染色显示,这些细胞主要分布在胃腺体基底部,MUC6和胃蛋白酶原-I(PGA3)强烈共表达。C4亚组细胞的组织病理学表现和表型表达模式与GA-FG-CCP的细胞特征高度一致。
总的来说,该研究为破译胃肿瘤异质性提供了宝贵的资源,这将为精确诊断和预后提供帮助。






