单细胞转录和染色质可及性分析重新定义了成人肾脏中的细胞异质性

近日,美国圣路易斯华盛顿大学医学院Yoshiharu Muto教授等在Nature communications发布了Single cell transcriptional and chromatin accessibility profiling redefine cellular heterogeneity in the adult human kidney的研究论文。文中,作者采用单细胞核转录组snRNA-seq和单细胞核染色质可及性snATAC-seq技术,对5个健康成人(50岁到62岁,男性(n = 3)和女性(n = 2))肾脏样本进行检测。此文揭示肾脏内独特的细胞状态,并重新定义近端小管和粗升肢的细胞异质性。
转座酶染色质可及性单核测序(snATAC-seq)也是一种单细胞表观遗传组测序技术。单细胞核测序,能够获得组织的细胞图谱,解决细胞异质性的问题。单细胞或细胞核RNA测序(scRNA-seq或snRNAseq)促进了对定义肾脏细胞特性的基因和途径的更深入的理解。成熟的人类和小鼠肾脏的多个scRNAseq图谱已经确定了转录如何有助于细胞类型的特异性。最近的方法已经将这种方法扩展到单细胞染色质可及性分析。单核染色质转置可及性测序试验(snATACseq)是ATAC-seq的扩展,该试剂盒利用Tn5转置酶在数千个单个细胞中测量染色质可及性。染色质可及性是驱动肾元发育的动态过程,而肾元祖细胞具有不同的染色质可及性谱,且随其分化而变化。染色质可及性在促进或抑制肾脏修复和再生中的作用对于设计急性和慢性肾脏疾病的治疗方案具有重要意义,并可能有助于改善肾脏类器官的定向分化。scRNA-seq和snATAC-seq在成年小鼠肾脏中的联合分析为理解染色质可及性如何调节转录提供了一个框架。然而,人类肾脏的单细胞表观基因组还没有被描述。
生物信息学工具可以从snATAC-seq数据集中提取出scRNA-seq无法获取的唯一信息。预测细胞类型特异性顺式调控DNA相互作用和转录因子活性是补充scRNA-seq获得的转录信息的两种方法。长程染色质-染色质相互作用在转录调控中起着重要作用,并受到转录因子结合的影响。染色质可及性分析将有助于识别通过远程相互作用影响转录的远程调控区域。
我们已经进行了snATAC-seq和snRNA-seq来研究染色质可及性如何改善我们对成熟人类肾脏中细胞状态和功能的理解。我们生成了一个包含转录组和表观基因组数据的交互式多模态图谱(http://humphreyslab.com/ SingleCell/)。结合snRNA-seq和snATAC-seq分析提高了检测近端小管和厚升肢内独特细胞状态的能力,并重新定义了可能有助于肾脏再生和细胞特异性离子通透性的细胞异质性。
技术路线:

一、人类成年肾脏的单细胞转录和染色质可及性分析
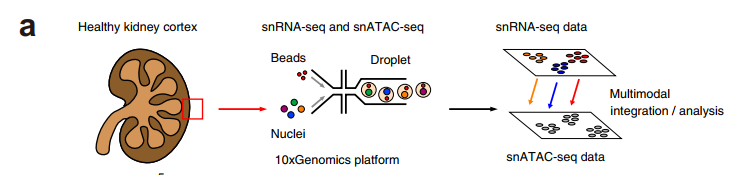
工作流程图
1)成人肾脏中的单细胞转录和染色质可及性分析
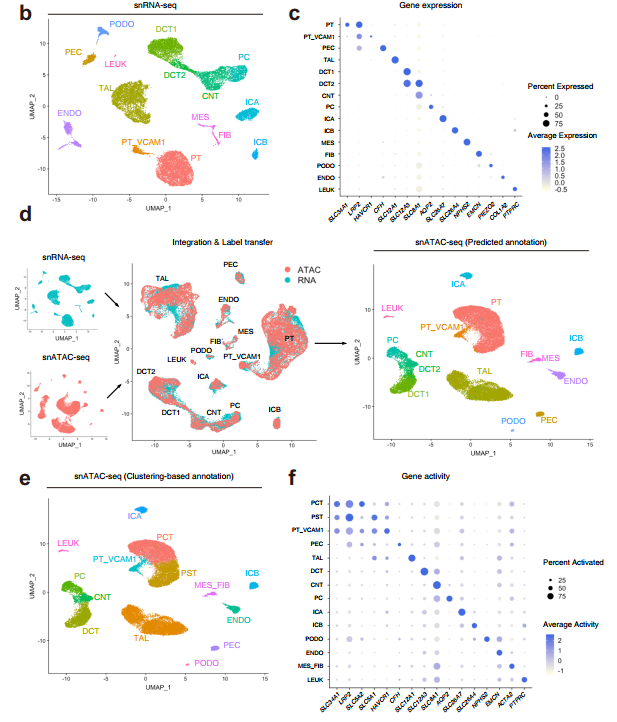
snRNA-seq基于谱系特异性标记的表达(图1c,补充图1b),鉴定了肾皮质内所有主要细胞类型(图1b,补充图1a)。检测了近端小管(PT)、壁上皮细胞(PEC)、粗升肢(TAL)、远端小管(DCT1、DCT2)、连接小管(CNT)、集合管(PC、ICA、ICB)、内皮细胞(ENDO)、肾小球细胞类型(MES、PODO)、成纤维细胞(FIB)和少量白细胞(LEUK)(补充表2、补充数据1)。
值得注意的是,近端小管亚群中VCAM1表达增加(PT_VCAM1)。该亚群还表达了HAVCR1,这是一种急性损伤后近端小管上调的基因,是长期肾脏预后的预测因子。
2)整合单核RNA和ATAC数据集,用于预测和验证ATAC细胞类型分配
snATAC-seq捕获单个细胞的染色质可及性特征。相对而言,我们对细胞类型特异性染色质可及性图谱的了解较少;因此,我们利用注释snRNA-seq数据集使用标签转移来预测使用Seurat的snATAC-seq细胞类型。标签转移是通过从snATAC-seq数据创建一个基因活性矩阵来进行的,这是一种衡量蛋白编码基因的基因体和启动子内染色质可及性的方法。
在参考snRNA-seq数据集和查询基因活性矩阵之间识别转移锚点,然后分配预测的细胞类型。snATAC-seq预测分数的分布表明,绝大多数细胞具有较高的预测分数,并被自信地划分为单细胞类型(补充图2)。
对snATAC-seq数据集使用97%置信阈值对细胞类型分配进行过滤,以去除异型双重体。通过标签转移获得的snATAC-seq细胞类型预测(图1d)与无监督簇的编辑注释(图1e, f)的比较表明,所有主要的细胞类型都存在于这两个数据集中,并且在检测和分配细胞身份方面,snATAC-seq与snRNA-seq具有可比性(补充图3)。使用基于基因活性的细胞类型分配进行下游分析,这是通过对snatc -seq数据集的无监督聚类获得的。有趣的是,snATAC-seq能够检测到近端小管簇内的两个亚群,这可能代表近端曲小管(图1e, PCT)和近端直小管(图1e, PST)。PCT显示编码SGLT2的SLC5A2具有更强的染色质可及性;而PST在编码SGLT1的SLC5A1(图1f,补充图4)中表现出更强的可达性。SGLT2在近端小管S1和S2段重新吸收葡萄糖,SGLT1位于S3。
二、染色质的可及性明确了细胞的类型
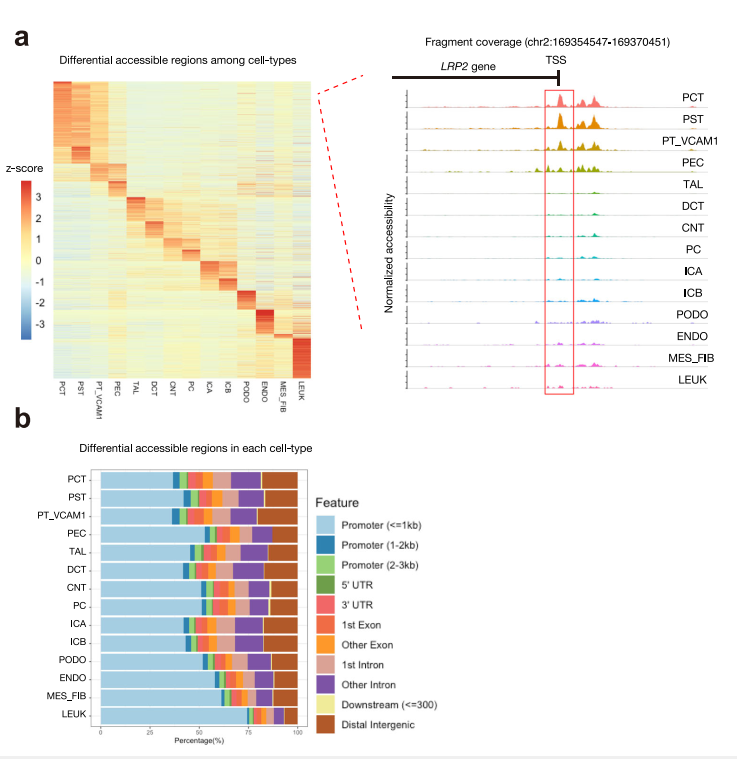
我们使用R包Signac来研究不同细胞类型间染色质可及性的差异。细胞类型可以根据差异开放区域(DARs)是开放的还是封闭的来区分(Fig. 2a)。
约20%(平均比例= 0.203 0.04)的DAR与各自细胞类型中的差异表达基因密切相关(补充表4)。例如,LRP2是一个表达在近端小管的谱系特异性基因,该区域的覆盖图显示其启动子和基因体内ATAC峰的数量和幅度增加(图2a)。事实上,大部分DAR都位于距离最近的转录起始位点3 kb内的启动子区域(图2b,补充图7)。第二个最常见的位置是内含子,DAR在不同细胞类型中的分布相对保守(图2c)。
三、染色质可及性与细胞类型特异性转录因子活性和染色质相互作用网络有关
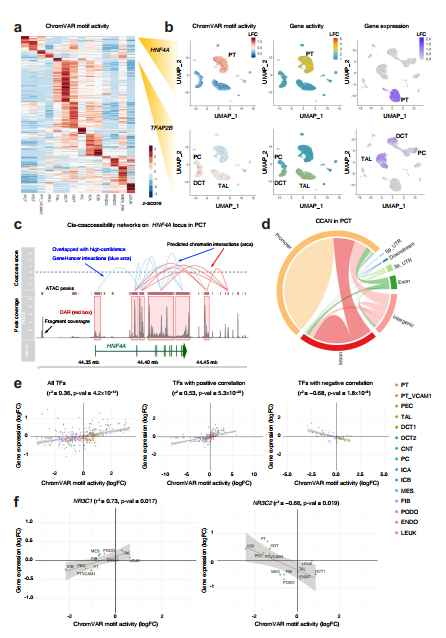
HNF4A编码驱动近端小管分化的关键转录因子。chromVAR检测到近端小管DAR中HNF4A结合基序的富集(图3b,基序活性),这是HNF4A中染色质可及性增强(图3b,基因活性)和snRNA-seq数据集中HNF4A转录增强(图3b,基因表达)所支持的。我们通过染色质免疫沉淀,然后定量PCR (ChIP-qPCR)验证了HNF4A与肾近端小管上皮细胞(RPTEC,补充图8a)中选定的靶基因位点(SLC34A1, SLC5A2, HNF4A) DAR中预测的HNF4A结合位点的结合。 然而,在RPTEC中可检测到HNF4A的表达水平低于肾皮质,这表明HNF4A与该细胞类型中的这些位点具有强大的相互作用(补充图8b)。
TFAP2B也有类似的模式,它调节远端肾单位的发育30。TFAP2B转录因子活性在粗升肢和远端曲小管中增加(图3b, motif活性),TFAP2B染色质可及性增加(图3b,基因活性),TFAP2B转录增加(图3b,基因表达)。
我们对远曲小管(DCT)、连接小管(CNT)和主细胞(PC)进行了伪时间排序,这些细胞在snRNA和snATAC数据集中都形成了一组不同的转录相关细胞类型。
在HNF4A中,观察到近曲小管中有一个CCAN,在启动子、基因体和远端区域的差异开放区域(图3c,红框)之间有多个连接(红色或蓝色弧线)(图3c)。
与coaccessibility score较高的Cicero连接相比,coaccessibility score较低的Cicero连接在GeneHancer double elite数据库中的可能性较小(p <2.2 10 16,卡的平方)。在近端曲小管内,大部分Cicero连接要么在启动子区域内,要么在启动子和另一个位置之间(图3d),这种分布在其他细胞类型中也类似(补充图11)。
转录因子活性与转录因子表达有适度的相关性(Pearson r2 = 0.36, p值= 4.2 10 12,图3e)。
推测motif活性与转录因子表达呈正相关的转录因子可能在DAR中扮演转录激活因子的角色,而负相关的转录因子则扮演转录抑制因子的角色。令人惊讶的是,糖皮质激素受体(NR3C1)的motif活性与表达呈正相关,而矿皮质激素受体(NR3C2)则呈负相关(图3f)。

四、Multimodal 分析突出了肥大的上行肢体的细胞异质性
为了确定我们是否能够检测出具有可变claudin表达模式的细胞亚群,在snRNA-seq数据集的umap图上划分三个亚种群(TAL1, TAL2和ATL)。ATL,上升细肢。显示了TAL各亚群体中富集基因的基因表达模式。一组细胞(SLC12A1+UMOD+)表达粗升肢标记(CLDN16、KCNJ10和PTH1R): TAL1,另一组细胞表达另一组TAL特异性标记,如CLDN10: TAL2(图4b)。第三组细胞根据之前发表的标记的表达被确定为髓袢升支粗段(ATL) 。我们使用免疫组化方法验证PTH1R和KCNJ10在UMOD+ SLC12A1+细胞亚群中表达(图4c)。在snATAC-seq数据集的umap图上进行TAL的亚聚类,划分三个亚种群(TAL1、TAL2和ATL)(图4d)。点图显示每个TAL亚种群中富集的基因的活性模式(图4e)。斑点的直径对应于检测到的基因活性的细胞比例,斑点的密度对应于相对于所有细胞类型的平均基因活性。Umap显示CLDN10、CLDN16、S100A2或UMOD(左)的基因活性。TAL1和TAL2之间的chromVAR差异激活转录因子基序(图4f)。使用Seurat FindMarkers功能来识别区分厚升肢细胞群的DAR,并使用Seurat FindMotifs功能对这些DAR进行转录因子motif富集(图4g)。
五、NF-κB调节表达VCAM1的近端小管亚群的分子特征
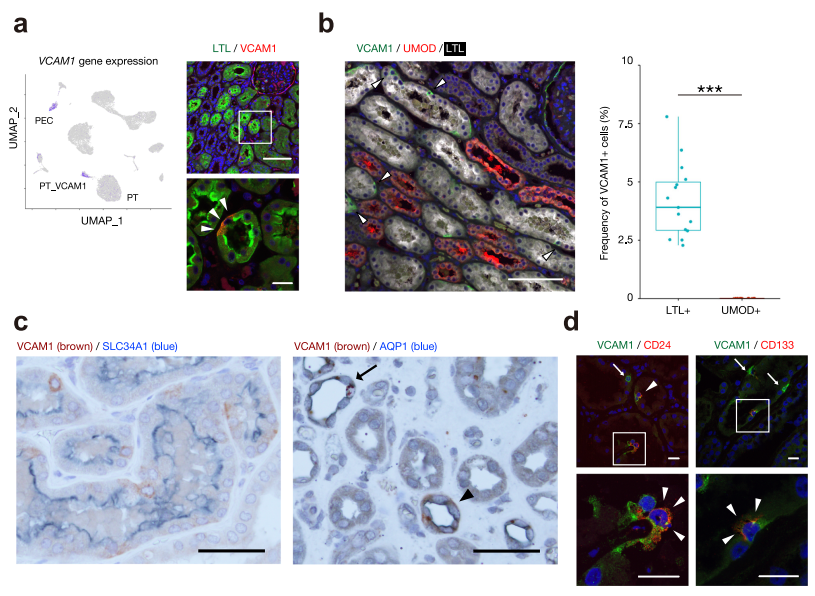
检测了一组近端小管细胞,VCAM1的表达和染色质可及性增加,我们将其命名为PT_VCAM1(图1)。免疫荧光研究表明,VCAM1在近端小管上皮中呈散在分布的表达(图5a)。我们的单细胞研究估计PT_VCAM1占总细胞数的2%,近端小管上皮细胞数的6%。我们还证实,在LTL+ PT细胞中,VCAM1+小管细胞占4.19 1.58%,而在肾皮质的UMOD+ TAL细胞中,VCAM1+细胞未被检测到(图5b)。虽然之前的研究表明VCAM1在亨利氏襻(dTL)的降肢表达,但我们仅通过AQP1对肾脏切片进行链纹检测,观察到VCAM1在dTL的一个亚组表达(图5c)。这些数据表明,VCAM1+小管细胞大部分位于皮质内近端小管内。与VCAM1+ PT细胞相比,有少数dTL小管表达VCAM1。免疫荧光分析确定了一个VCAM1+近端小管细胞亚群表达CD24或CD133(图5d)。
六、多组学方法分析表征近端小管细胞子集

Cicero研究了从PT到PT_VCAM1转变过程中染色质可及性的变化。VCAM1和TPM1转录增加(图6a)与VCAM1基因体和启动子区域染色质可及性增加相关(图6b, c)。同样,SLC5A12和SLC4A4转录降低(图6c)与染色质可及性降低相关(图6c,补充图15)。通过评估chromVAR转录因子的活性,我们发现了可能调节近端小管和PT_VCAM1之间过渡的转录因子。有趣的是,近端小管显示出强大的HNF4A活性,该活性在PT_VCAM1簇中降低,并与增加的REL和RELA活性相一致(图6d)。我们在PT_VCAM1细胞核中验证了减少的HNF4A蛋白表达(图6e)。
我们从VCAM1基因体中鉴定出一个约60kb的开放染色质区域,该区域包含一个与VCAM1启动子相互作用的RELA基序(通过ciscoaccessibility network)。实际上,ChIP-qPCR扩增了该位点,使其能够与RELA结合(图6f,补充图17b),为该细胞类型中RELA调控VCAM1表达提供了实验证据。
七、急性肾损伤和慢性肾脏疾病患者PT_VCAM1的比例升高

对小鼠缺血再灌注损伤(IRI)实验中获得的大量RNA-seq进行反卷积,以确定PT_VCAM1的比例是否与急性肾损伤有关。BisqueRNA使用基于scRNA-seq参考的反褶积方法从整体RNA-seq中估算细胞类型的丰度。PT_VCAM1估计比例在iri后24 h显著增加,并持续至少7天;与正常近端小管细胞比例下降相对应(图7a)。有趣的是,未手术控制小鼠肾脏中PT_VCAM1的估计比例在老龄小鼠中增加(图7b)。用BisqueRNA对非肿瘤肾样本进行反卷积,估计PT_VCAM1细胞的比例为2.6%(图7d),这与我们的snRNA-seq和snatc -seq估计一致。接下来,我们分析了来自2型糖尿病患者肾脏活检的大量RNA-seq。与对照组和早期糖尿病肾病患者相比,晚期糖尿病肾病患者PT_VCAM1的比例明显更高(图7e),提示PT_VCAM1和小管损伤可能与糖尿病肾病的疾病进展有关。
从小鼠IRI到人类的细胞类型标记转移表明,大部分PT_VCAM1与我们最近在小鼠中发现的修复失败的近端小管细胞(FR-PTC)群体有关(图7c)。






