脂质积累与急性肾损伤
急性肾损伤(Acute kidney injury, AKI)是一种起病急、进展快、预后差的严重临床急症。最近的证据表明,AKI伴随着显著的代谢异常,包括脂质代谢的改变。然而,脂质在AKI中的具体变化及其作用和调控机制目前尚不清楚。今天小编给大家带来于2021年3月发表在影响因子8.579的“Theranostics”的文章“Relieving lipid accumulation through UCP1 suppresses the progression of acute kidney injury by promoting the AMPK/ULK1/autophagy pathway”。本研究首次系统分析AKI中脂质组成的变化,发现脂质积累程度与UCP1高度相关。重要的是,通过上调UCP1缓解AKI中的脂质堆积,可以通过促进AMPK/ULK1/自噬通路,显著抑制AKI的进展。

技术路线
结果
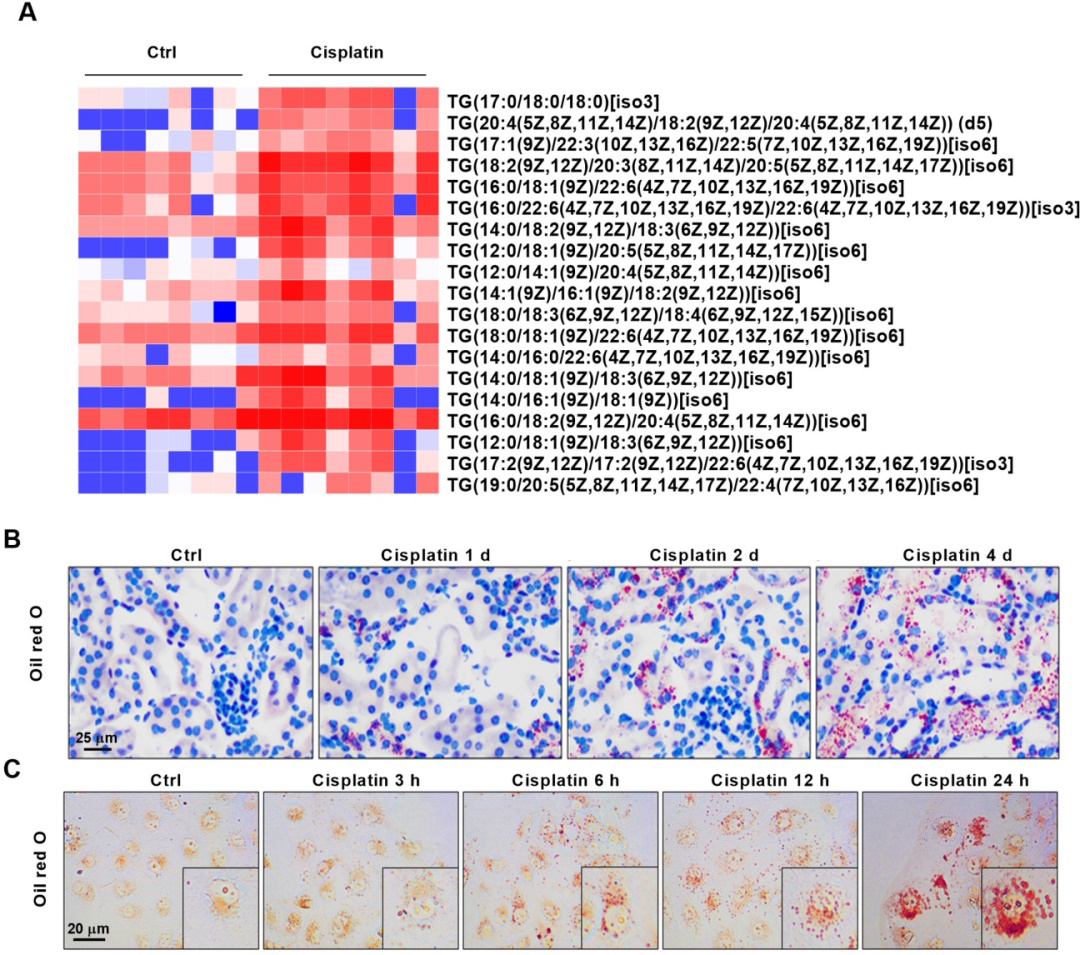
1)AKI伴有明显的脂质积累,并与肾损伤的严重程度高度正相关
根据脂质代谢组学分析结果,我们发现AKI组织中各类甘油三酯(TGs)含量显著增加(图1A)。考虑到AKI中的脂质积累,我们进行实验来确定其临床意义。我们对不同严重程度的AKI动物标本进行油红O染色。结果显示,随着疾病进展的延长,小鼠肾组织脂质沉积逐渐增加(图1B)。在体外也发现了类似的结果,即随着细胞损伤的严重程度,脂质积累的程度增加(图1C)。这些结果说明AKI中的脂质积累与疾病的严重程度呈正相关。
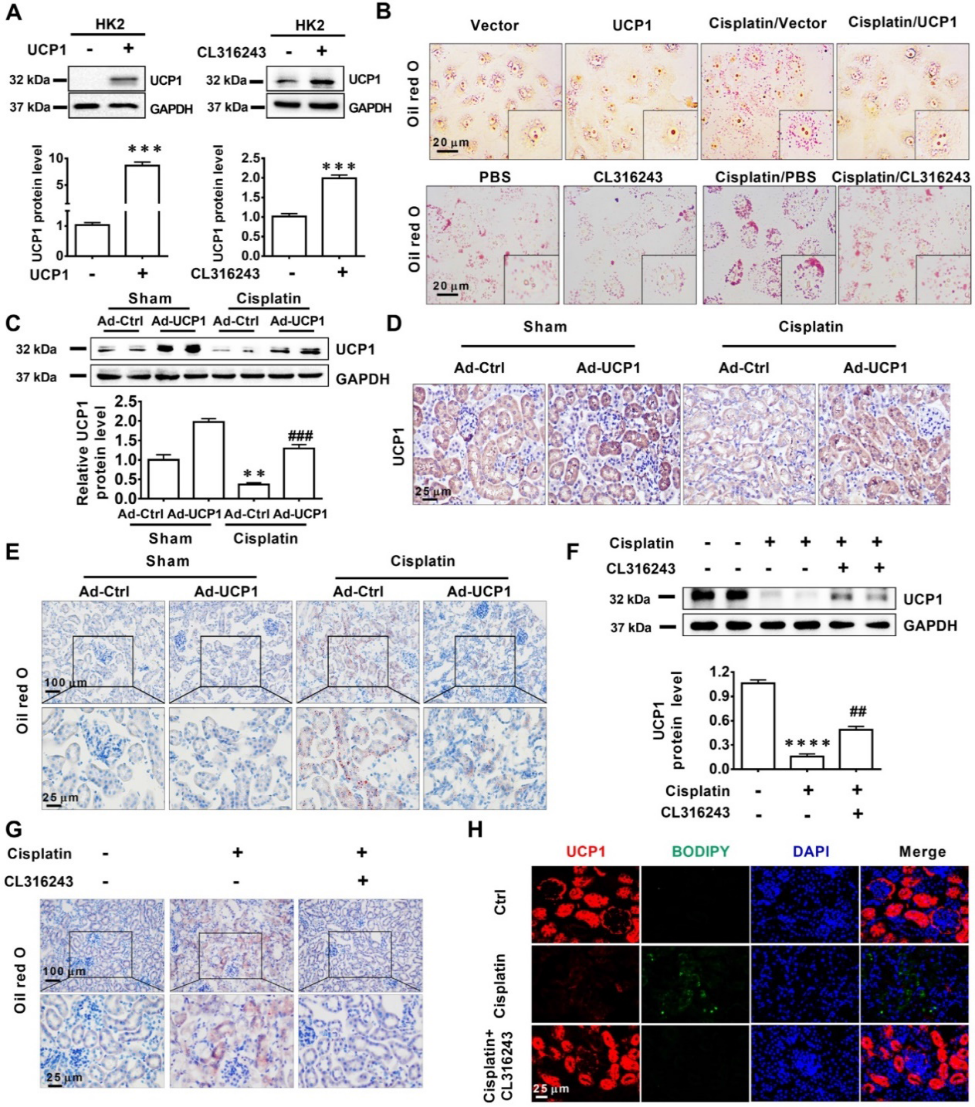
2)UCP1在AKI中显著下调,且与肾损伤严重程度呈高度负相关
UCPs超家族与能量代谢密切相关,并在多种疾病中介导脂质消耗。基于UCPs的功能,我们通过western blot和免疫组化方法对正常C57小鼠肾组织中UCP1、UCP2和UCP3的表达进行了表征。结果显示,UCP1和UCP2表达较好,而UCP3几乎未检测到(图2A-B)。在UCPs中,UCP1被认为是脂质降解最关键的基因,而UCP2与之没有直接关系。因此,我们选择UCP1进行进一步分析,证实其在皮质小管中高表达,在髓质中部分表达,C57小鼠、Sprague-Dawley大鼠、Wistar大鼠肾小球、乳头几乎无表达(图2C-D)。为了进一步确认UCP1在肾脏中的表达位点,我们用凝集素染色显示肾脏的形态,然后对UCP1进行染色。结果显示,UCP1主要表达于肾小管以上结果提示,UCP1可能在肾小管的结构和功能中发挥着潜在的重要作用。
为了探讨UCP1与AKI之间的相关性,我们在体内、体外检测了UCP1在AKI模型中的表达。结果显示,UCP1在AKI小鼠中显著下调,更重要的是,随着肾损伤的加重,其表达量逐渐降低(图2E-F)。在体外,随着顺铂刺激时间的延长,HK2细胞中UCP1的表达降低(图2G)。这些结果表明UCP1与AKI的严重程度呈负相关。此外,随着AKI肾细胞损伤程度的增加,脂质的积累,UCP1的表达逐渐降低(图2H)。这一结果表明,UCP1在AKI中的表达可能影响脂质积累。

3)AKI中的脂质积累与UCP1高度负相关
在确定了UCP1与AKI中的脂质积累负相关后,我们试图阐明其潜在的关系。首先,我们使用UCP1特异性过表达慢病毒载体和UCP1激动剂CL316243构建UCP1上调的细胞模型(图3A)。如图3B所示,UCP1过表达显著降低了顺铂暴露HK2的脂质积累。UCP1激动剂CL316243也得到了类似的结果。这些结果表明,UCP1参与了AKI中脂质积累的调节。为了进一步验证这一调控关系,提高证据的可靠性,我们采用肾多点注射UCP1特异性过表达腺病毒的方法建立AKI过表达UCP1的动物模型(图3C-D)。油红O染色显示,过表达UCP1可显著缓解AKI动物模型中的脂质积累(图3E)。最后,使用UCP1激动剂CL316243在AKI动物模型中诱导UCP1过表达,也观察到了相同的结果(图3F-H)。因此,所有证据表明,随着UCP1表达的增加,AKI模型中的脂质含量降低。
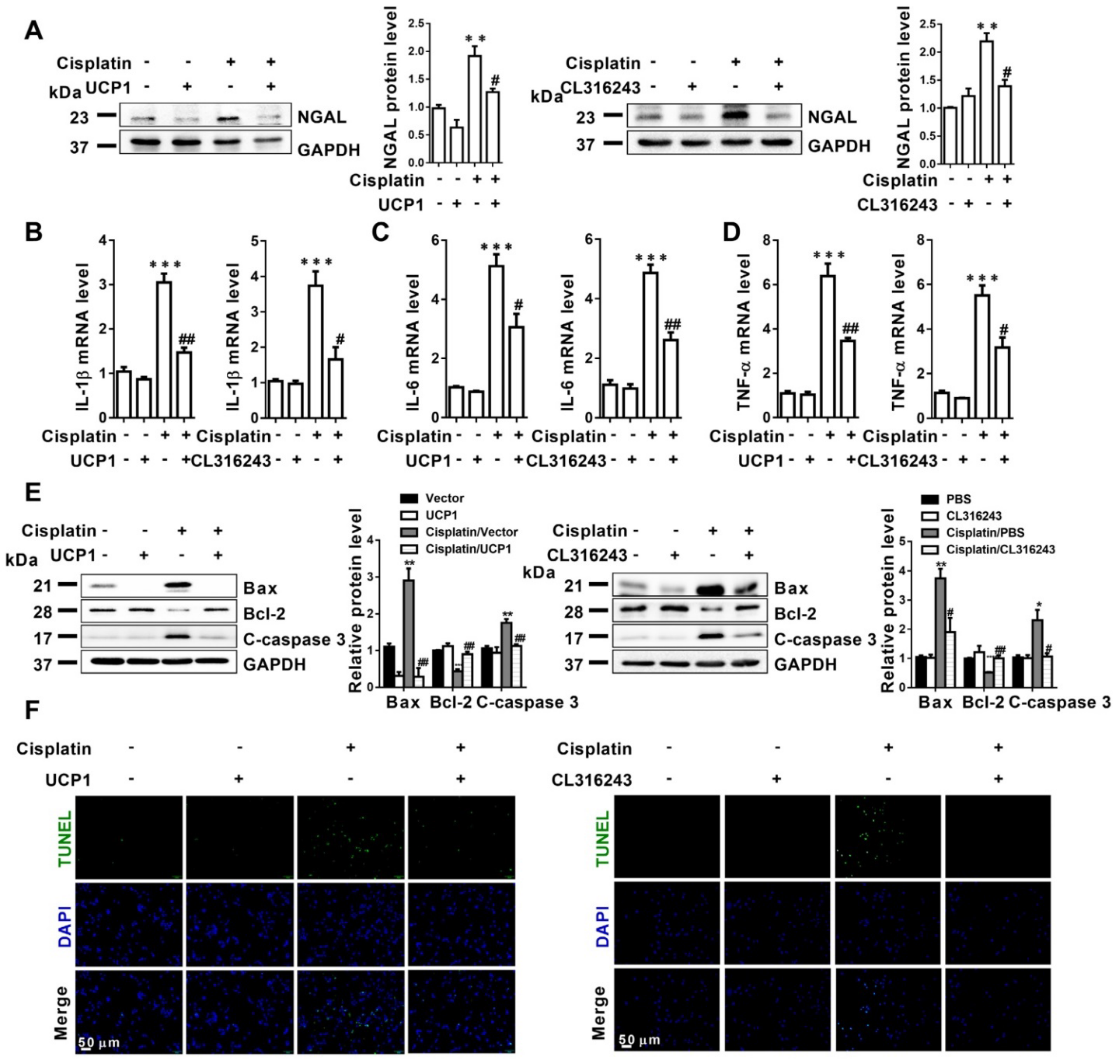
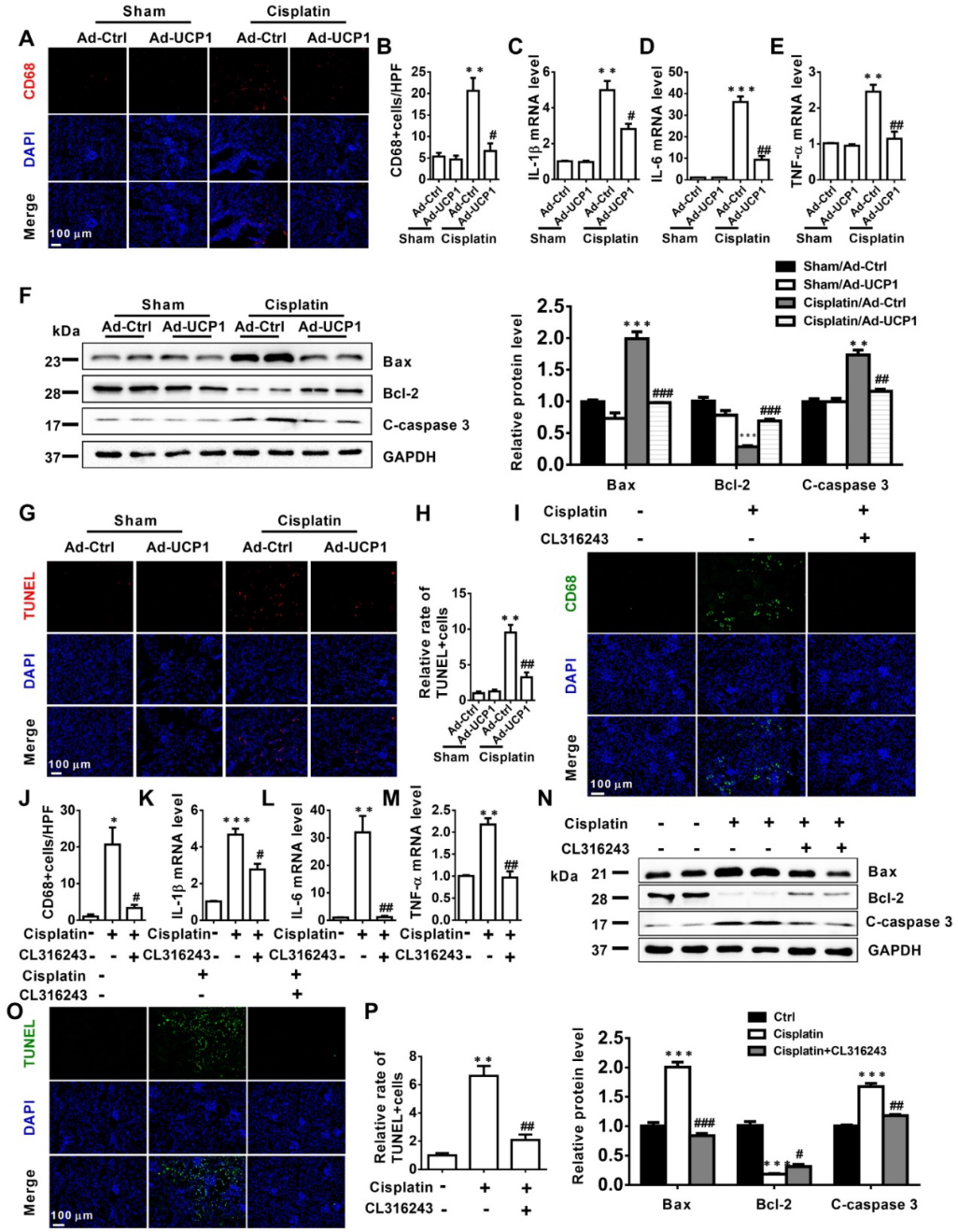
4)体外实验表明,上调UCP1以减轻AKI期间的脂质积累,可通过影响炎症和凋亡,显著抑制疾病进展
越来越多的证据表明,在AKI中有明显的脂质积累和UCP1的异常表达,并与肾损伤的严重程度有很强的相关性。为了确定脂质积累是否影响AKI期间的细胞功能,我们首先使用UCP1过表达慢病毒和UCP1激动剂CL316243构建AKI细胞脂质积累清除模型。如图4A所示,在AKI中上调UCP1清除脂质积聚,导致肾小管损伤指数、NGAL显著下调,说明UCP1清除脂质积聚可显著减轻模型细胞的损伤。鉴于炎症和凋亡是AKI细胞损伤最重要和直接的原因,我们对上述细胞模型中的炎症和凋亡标记物进行了量化。IL-1β、IL-6和TNF-α随着UCP1的上调而显著降低(图4B-D)。在凋亡指标Bax和C-caspase 3中也观察到类似的趋势,而Bcl-2升高(图4E)。最后,通过TUNEL荧光染色直接定量评估细胞凋亡,证实上调UCP1缓解AKI模型细胞的凋亡(图4F)。
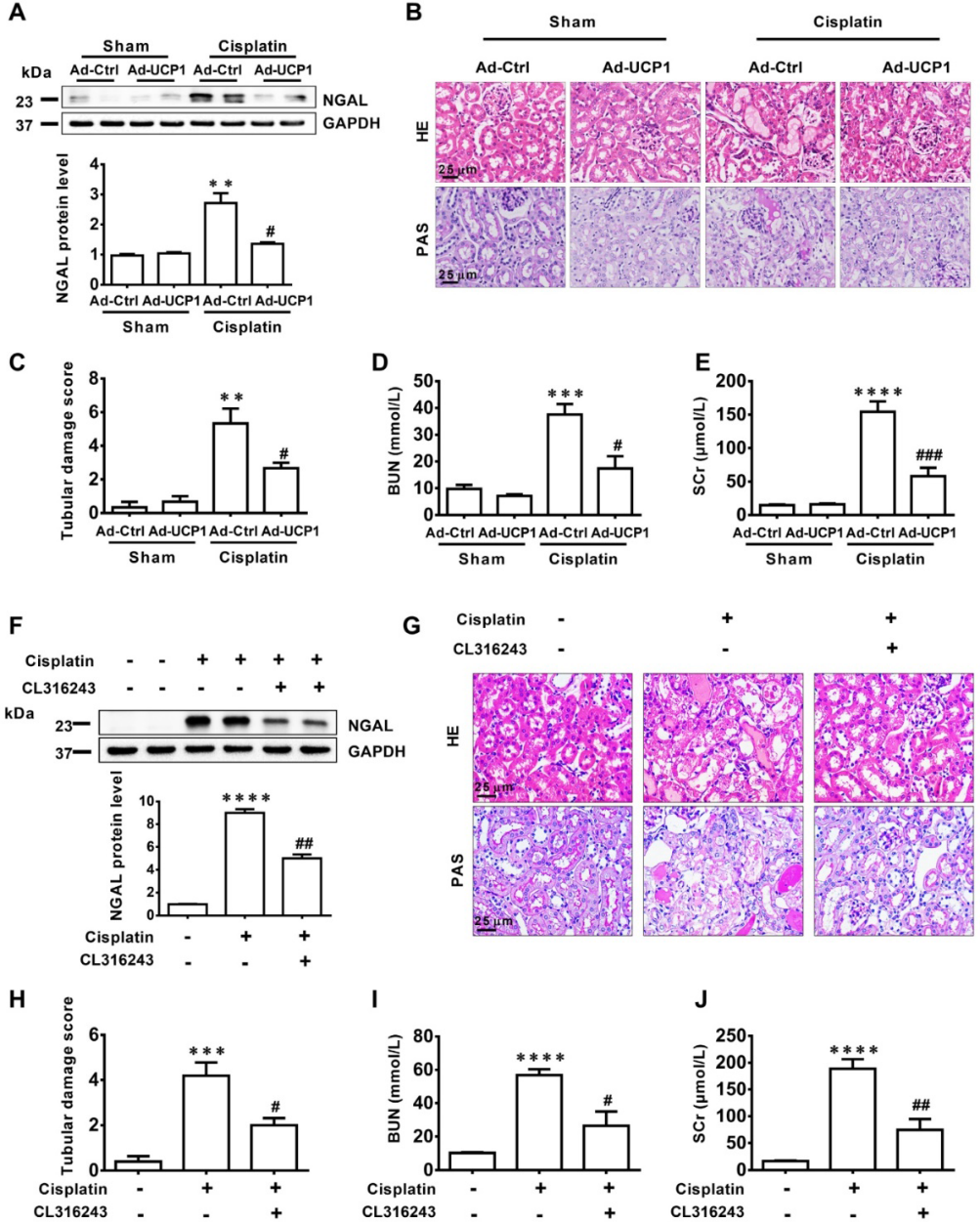
5)上调UCP1缓解AKI期间的脂质积累,显著抑制疾病进展
为了在体内验证脂质对AKI功能的影响,我们通过在肾脏多点注射过表达UCP1腺病毒,构建过表达UCP1动物模型,以消除脂质在AKI中的堆积。在UCP1过表达动物模型中,肾损伤指标NGAL明显降低(图5A)。HE和PAS染色显示肾脏形态有很大改善,肾小管损伤评分显示,在UCP1介导的脂质消耗增加后,肾小管损伤程度明显降低(图5B-C)。顺铂刺激后肾小管呈空泡变性,细胞扁平,管腔扩张,而UCP1过表达明显改善了病理改变。血清肌酐(SCr)和尿素氮(BUN)这两项肾脏损伤指标也出现了类似的显著下降(图5D-E)。利用UCP1激动剂CL316243在AKI动物模型中缓解脂堆积,进一步验证了上述结果。治疗后NGAL显著降低(图5F),肾脏形态、肾小管损伤评分、SCr、BUN均显著改善(图5G-J)。因此,在体内,上调UCP1以缓解AKI脂质积累可以抑制AKI进展。
6)上调UCP1减轻AKI中的脂质积累,可显著缓解体内炎症和凋亡
以上研究证实,在体外,上调UCP1可以通过抑制炎症和凋亡来抑制AKI的进展。为了探究其在体内的作用,我们在肾多点注射模型中检测了相应的指标。如图6A-E所示,炎症指标CD68、IL-1β、IL-6、TNF-α均显著降低,UCP1上调。在凋亡方面,凋亡指标Bax和C-caspase 3也随着UCP1的上调而降低,而Bcl-2随着UCP1的上调而升高(图6F)。TUNEL荧光染色也直接证明了UCP1上调导致的凋亡减少(图6G-H)。同样,我们也使用UCP1激动剂CL316243在动物模型中证实了同样的炎症和凋亡趋势(图6I-P)。
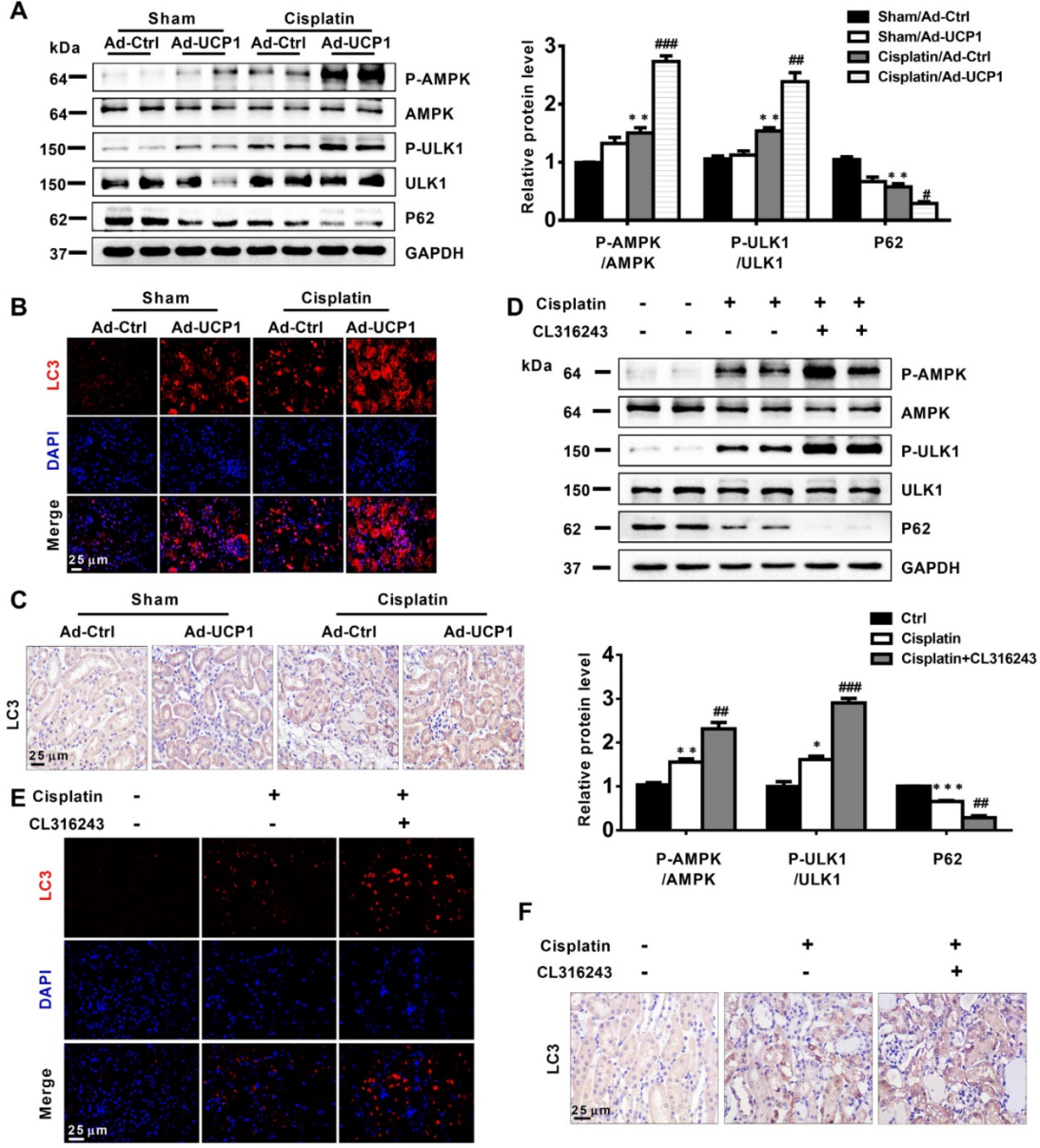
7)在体外,上调UCP1减少AKI期间的脂质积累可通过AMPK/ULK1途径促进自噬
自噬已被证实在AKI中发挥重要作用。因此,自噬已经成为我们关注的重要途径之一。在通过慢病毒转染过表达UCP1或UCP1激动剂CL316243的AKI细胞模型中,自噬相关指标显示AMPK/ULK1/自噬通路显著激活(图7A-B)。电子显微镜图像也显示,上调UCP1消除AKI中的脂质积累后,细胞自噬得到促进(图7C)。基于这些发现,为了验证自噬在UCP1功能中的重要性,我们进行了功能恢复实验。如图7D-F所示,氯喹抑制自噬显著逆转了顺铂组UCP1引起的炎症指标下降。同样,TUNEL染色显示,使用氯喹抑制自噬,可以明显逆转UCP1促进的凋亡抑制作用(图7G)。这些结果表明,脂质积累通过作用于AKI细胞自噬,在调节细胞功能方面发挥着重要作用。

8)在AKI期间上调UCP1减少脂质积累,可通过AMPK/ULK1途径促进体内自噬
我们发现UCP1在体外通过激活自噬来影响AKI中的细胞功能,我们探讨了这种情况在体内是否也会发生。结果表明,在动物模型中上调UCP1也能显著激活AMPK/ULK1/自噬通路(图8A),免疫荧光和免疫组化分析进一步证实了这一点(图8B-C)。最后,CL316243上调UCP1后,AMPK/ULK1/自噬通路也被显著激活(图8D-F)。综上所述,我们的研究构建了AKI中脂质积累显著的模型,且这种积累的脂质与UCP1呈负相关。通过上调UCP1来清除AKI中积累的脂质,可以激活AMPK/ULK1/自噬通路来抑制疾病进展(图9)。
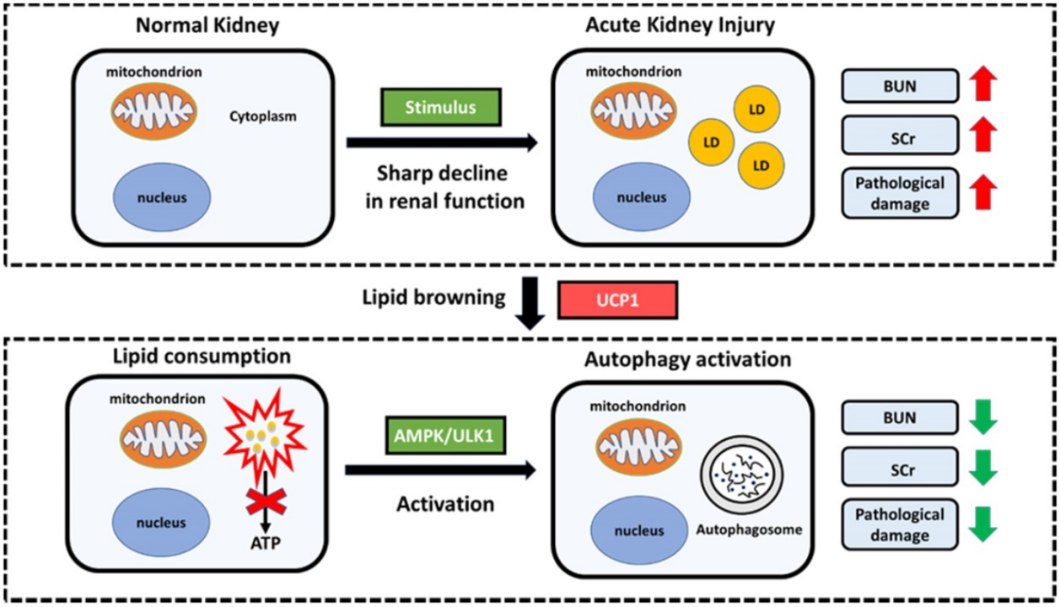
结论:UCP1直接调控AKI中的脂质积累,激活细胞自噬,从而显著抑制疾病进展。这为AKI的治疗提供了新的思路和靶点。






