NPM1突变急性髓系白血病的一种独特亚型的生物学和治疗意义

2021年,来自加拿大多伦多大学和加拿大温哥华英属哥伦比亚大学等团队合作在Nature communication杂志上发表了文章“Biological and therapeutic implications of a unique subtype of NPM1 mutated AML.”。此报道描述了npm1突变AML患者的分子异质性。基于rna-seq的基因表达谱分析,确定了两种新亚型,称为原始型和committed型。基于基因表达、表观基因组(ATAC-seq)和免疫表型(CyToF)的差异,在独立的AML队列中将亚型与特定的分子特征、疾病分化状态和患者生存联系起来。此外,表明了在缺乏FLT3-ITD的原始特征病例的治疗中添加激酶抑制剂对AML可能有治疗益处。
急性髓系白血病(AML)是一种基因和生物学上的异质性疾病,其特征是克隆扩增和突变的造血干细胞和祖细胞分化受损。在AML最常见的驱动突变中,NPM1基因第12外显子的4碱基对插入是稳定的,在20% - 30%的病例中发生。由于其生物学意义和预后影响,NPM1突变在世界卫生组织(WHO)的髓性白血病分类中代表了一个独特的白血病实体,并在预后和治疗决策中发挥重要作用。
NPM1突变通常与诱导和巩固化疗后患者生存的良好影响相关。在NPM1突变的AML中,FLT3- ITD突变经常与DNMT3A突变同时发生,这本身与接受标准诱导治疗的患者预后更差有关。大多数关于NPM1突变的AML的研究都集中在其他突变的同时发生,而突变型NPM1患者基因表达水平的异质性及其生物学意义尚未得到全面研究。
技术路线:

一、NPM1突变的AML聚集成两个不同的组

为了在391个npm1突变的AML样本中定义一致的分子亚型,我们使用CoINcIDE12框架应用元聚类方法。我们的元聚类分析显示在我们的数据概要中有两个稳健的亚型(图1A和补充图1和2)。接下来,我们使用PERT算法13来阐明每个聚类中AML样本的细胞组成。我们发现有一簇干细胞显著富集,因此被标记为原始。与此相反,另一簇与髓系和造血分化相关的基因表达丰富,因此我们将其标记为committed亚型(图1B)。两个组在年龄、核型和白细胞计数等临床病理参数方面没有差异(卡方检验假发现率[FDR] >5%;补充表2 5)。确定关键驱动突变在原始和committed亚型中的分布(图1C,补充讨论中的亚型和突变部分和补充表6 17)。尽管亚型中富含某些突变(原始组的FLT3-ITD和承诺组的DNMT3A),驱动突变的遗传改变对原始和committed亚型的预测较差(补充图3 16和补充讨论),基因突变和亚型之间的Matthews相关系数(MCC)较低(FLT3-ITD的MCC = 0.32, DNMT3A的MCC = 0.16;在precision-recall曲线(AUPRC = 0.62)值下,突变与亚型之间的多变量分析得到一个薄弱区域(Supplementary Fig. 7)。
二、npm1突变AML患者聚集的分子基础
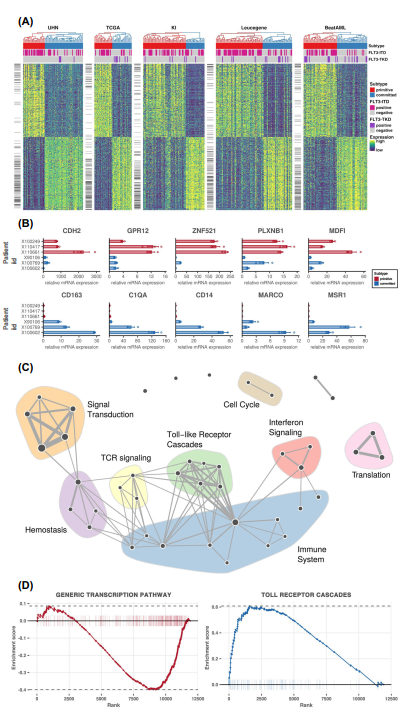
CDH2是钙粘蛋白家族的一员,被认为是决定干细胞命运的调节因子15。类似地,G蛋白偶联受体12 (GPR12)在原始亚型中上调,已知在干细胞维持和癌症干细胞的体细胞重编程中发挥作用。MyoD家族抑制剂(MDFI)在原始亚型中表达增加,据报道它是WNT信号通路的调节因子,只在造血干细胞祖细胞中表达。锌指蛋白521 (ZNF521)是一种转录因子,其在人类白血病细胞系中被敲低可以减少增殖但在原始亚型中却有显著的高表达。
CD163是一种免疫调节剂,是巨噬细胞清清体受体家族的成员,已知在单核细胞系的AML细胞中表达。在 committed cluster 中其他基因的高表达包括免疫相关基因,如C1QA, CD14和MARCO。msl1基因,一种已知的白血病干细胞增殖抑制因子,也在committed cluster中高表达。我们通过qPCR验证了关键基因的差异表达(图2B)。使用基因集合富集分析(GSEA),在committed 亚型中,免疫反应通路如干扰素- γ介导的信号通路、GPCR信号通路和toll样受体(TLR)信号通路上调(图2C, D, Supplementary Figs. 16, 18,与FLT3-ITD和DNMT3A突变的弱相关性一致。
三、原始表型和染色质可及性
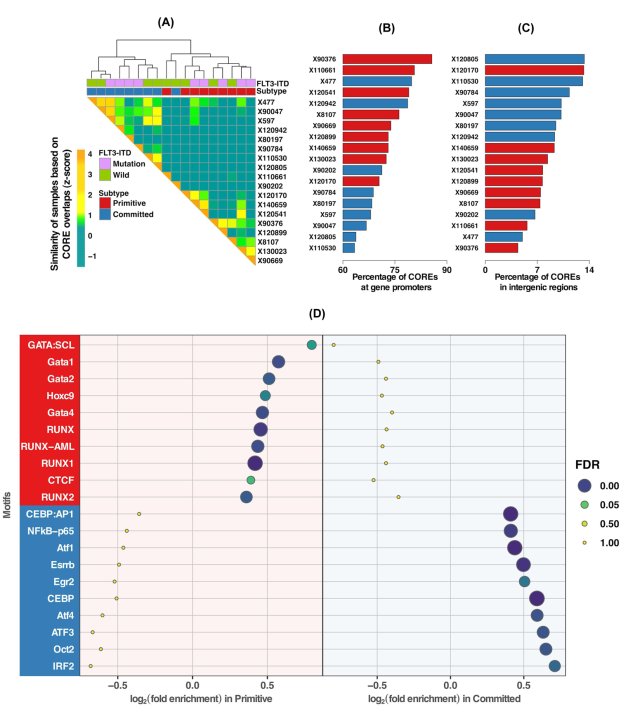
虽然基因表达反映了细胞身份的活跃状态,但顺式调节元件(cre),包括启动子和增强子,是决定细胞命运的潜在因素。因此,我们研究了npm1突变的AML样本是否也会根据其顺式调控景观分层为原始和committed的集群。使用转座酶可达染色质测序(ATAC-seq)可达染色质区域,以CREAM方法鉴定的核心为重点,根据表达谱对AML样本进行聚类,但有一个例外(图3A)。我们的研究结果表明,启动子区形成了核心(启动子:FDR = 11%,基因间:FDR = 2%;图3B、C及补充图19)。RUNX和GATA家族成员HOXC9和CTCF的dna结合位点基模只富集在原始亚型的COREs中,提示可能存在调控原始亚型基因的因素(图3D,补充数据3).对承诺亚型中唯一可获得的核心进行基序富集分析,确定了CEBP、ATF家族成员、OCT2、IRF2、NFkB-p65、ESRRB和EGR2识别的共识序列,提示它们在committed亚型中可能发挥的作用(图3D)补充数据。
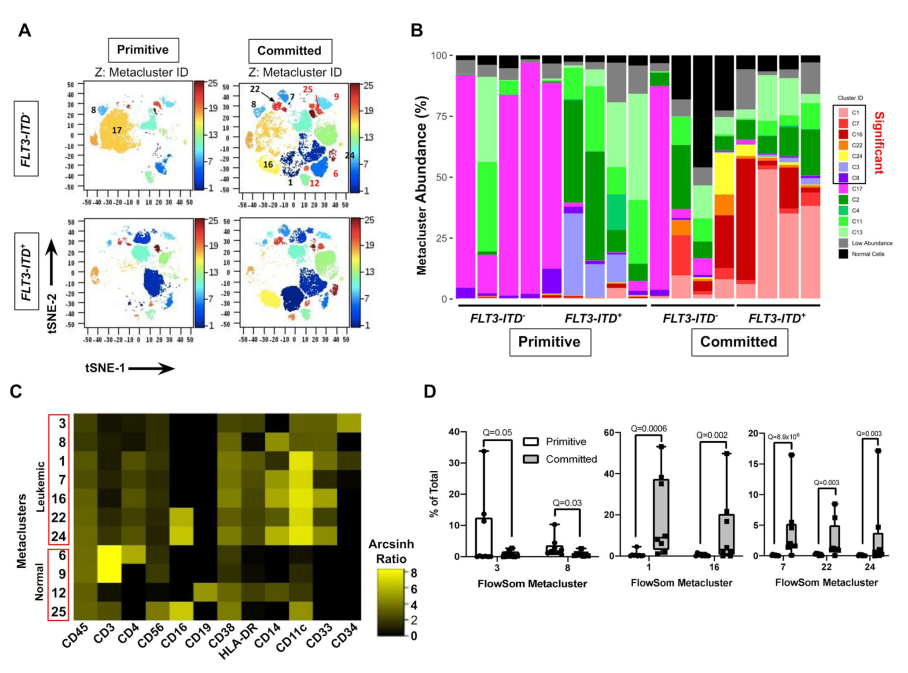
我们采用质谱耦合流式细胞仪(CyTOF)分析,在单细胞水平上探讨9例原始AML npm1突变和8例committed npm1突变的患者的免疫表型差异。我们使用细胞术(diffcyt)27管道来计算定义具有相似高维表型的细胞群(免疫表型簇)。每个免疫表型聚类映射到二维t-随机近邻嵌入(t-SNE)图上的离散区域(图4A;补充图20、21),证实它们表达不同的免疫表型。分析显示,七种不同水平的CD45和造血祖细胞标记物(CD34, CD38)或骨髓单核细胞分化标记物(CD33, CD14, CD11c, CD16, HLA-DR)的恶性免疫表型集群在这两种亚型之间差异丰富(图4B,C)。确诊病例中也包含较高丰度的非白血病免疫表型集群,包括CD45hi T (CD3+)、B (CD19+)和NK (CD3 CD56+ CD16+)细胞(补充图20)。
npm1突变的AML原始病例中,免疫表型集群3和8的丰度明显较高,这些集群3和8表型原始,由表达低水平的骨髓单核细胞分化标志物的CD34+ CD38lo(3)或CD34 CD38lo(8)细胞组成(图4C, D,补充图21)。非显著白血病集群为CD34,但表达少量的骨髓单核细胞标记物。相比之下,npm1突变的急性髓细胞白血病committed 病例显示出5个免疫表型集群(1,7,16,22和24)的丰度高于原始病例(图4B, D)。这些免疫表型集群包括CD34−/lo CD38+ CD11c+细胞也表达CD33、CD14、CD16和HLA-DR的各种组合,显示出异常的骨髓单核细胞分化(图4C,补充图21A)。在原始病例中,显著原始免疫表型聚集的总丰度较低(平均值(9.4±11.4%),显著分化免疫表型聚集(平均53±37%)。
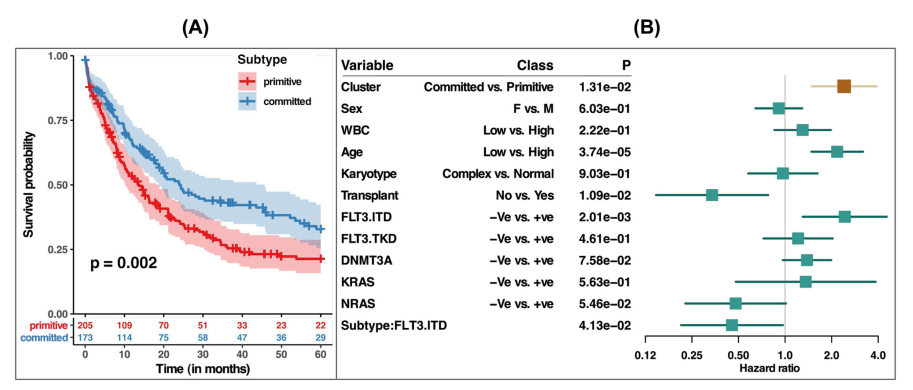
评估了原始亚型和committed亚型是否与患者总生存期相关(图5A;补充图22)。与committed亚型相比,原始亚型与明显更差的生存率相关(Log-rank检验p = 0.002)。为了确定我们的聚类是否超出了已建立的预测因素,我们还拟合了一个多变量Cox比例风险模型,调整了临床病理参数,如性别、白细胞计数、年龄、核型和突变,包括FLT3- itd、FLT3- TKD、DNMT3A、NRAS和KRAS。多变量分析显示,原始亚型和committed亚型具有显著的互补预后价值(p-值= 0.01,图5B)。
六、原始亚型预示着对激酶抑制剂的敏感性增加
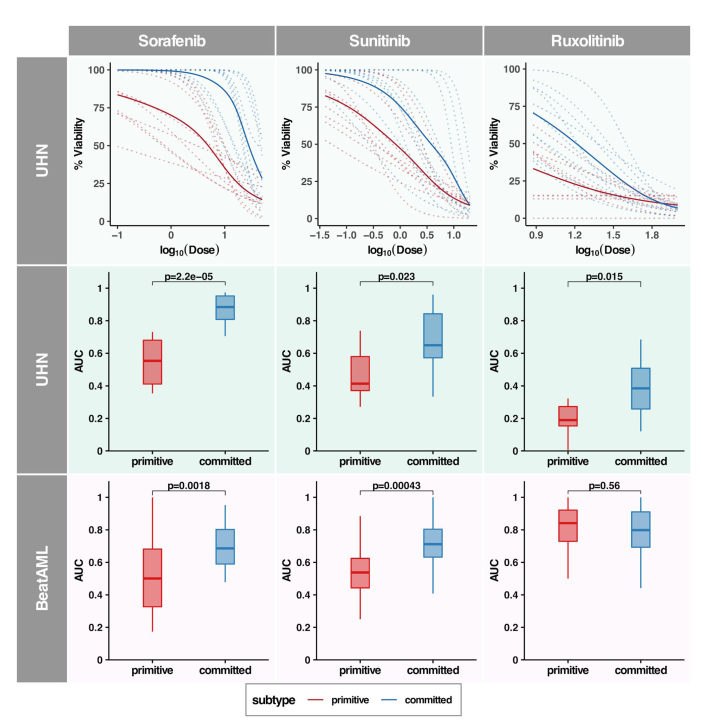
生成各化合物的药物剂量响应曲线,并比较各亚型间曲线下面积(area under the curve, AUCd)(单个药物剂量响应曲线见图6、)。体外药物筛选显示,原始聚类患者样本对索拉非尼、舒尼替尼和鲁索利替尼的敏感性高于合并亚型(Wilcoxon秩和检验p-value分别= 2E 5、0.02和0.01;在UHN患者样本中,Quizartinib的亚型间差异反应较弱,而伊马替尼和达沙替尼的亚型间无差异(补充图27)。
使用BeatAML33数据集,验证原始和committed亚型对激酶抑制剂的反应之间的联系,该数据集包含npm1突变AML患者样本的体外药物筛选。我们观察到UHN和BeatAML数据集之间的良好一致性,原始聚类中的样本对Sorafenib和Sunitinib表现出更高的敏感性(图6)。有趣的是,Quizartinib在UHN队列中有微弱的差异反应,但在BeatAML队列中却有统计学意义的差异。






