IFN暴露诱导的CD8 + T细胞线粒体异常加速系统性红斑狼疮病发
系统性红斑狼疮(SLE)患者大多数存在I型IFN刺激基因(ISGs)的高表达。线粒体异常也有报道,但I型IFN暴露对这些变化的贡献尚不清楚。此外,I型IFN通过上调脂肪酸氧化(FAO)和氧化磷酸化(OXPHOS)促进浆细胞样树突状细胞(pDCs)的线粒体功能。本文数据表明,I型IFN暴露通过代谢重编程促进CD8 + T细胞死亡,有助于SLE发病。本文于2021年3月发表在《Nature Communications》IF:12.121。
技术路线如下:

主要实验结果如下:
1、ISGs高表达患者OXPHOS基因下调
为了确定是否T细胞的转录组特征可以帮助鉴定SLE患者的疾病活动,作者对来源于激活和未激活女性的CD8+ T和CD4+ T细胞的mRNA进行测序。对DEGs进行聚类热图分析,发现SLE患者根据ISG表达水平被分为显著的两类:SLE-1和SLE-2(Fig. 1a, b)。在两种T细胞中,SLE-2类群的患者具有更强烈的I型IFN特征。在CD4+ T细胞中,这种特征伴随着参与JAK-STAT信号和T细胞共刺激的基因,而在CD8+ T细胞中,ISG基因的高表达与基因参与细胞周期,响应DNA损伤和凋亡有关(Fig. 1a, b)。比较SLE-1和SLE-2组的转录表达谱,结果显示,除ISGs外,mtDNA编码的OXPHOS基因的表达差异最大(Fig. 1c, d)。总之,SLE患者纯化T细胞的转录组学分析根据ISG表达水平将其分为两组,表达高I型IFN标记的患者显示线粒体编码基因和线粒体相关代谢途径的表达减少,在CD8 + T细胞中更明显。这表明SLE中与I型IFN相关的线粒体功能失调。
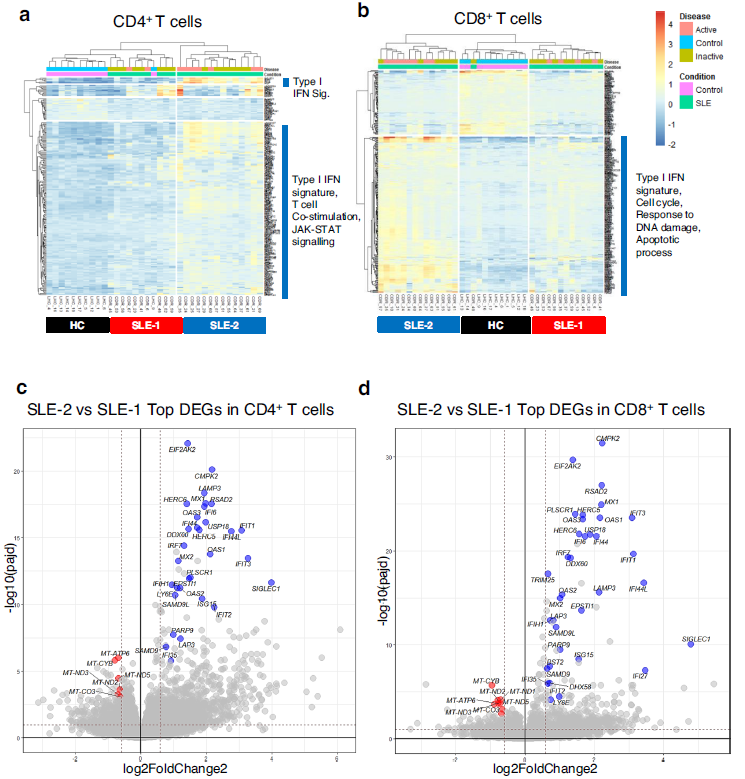
图1健康志愿者和SLE患者CD8+ T和CD4+ T细胞的转录组学分析
2、ISGs高表达患者CD8+ T细胞线粒体异常
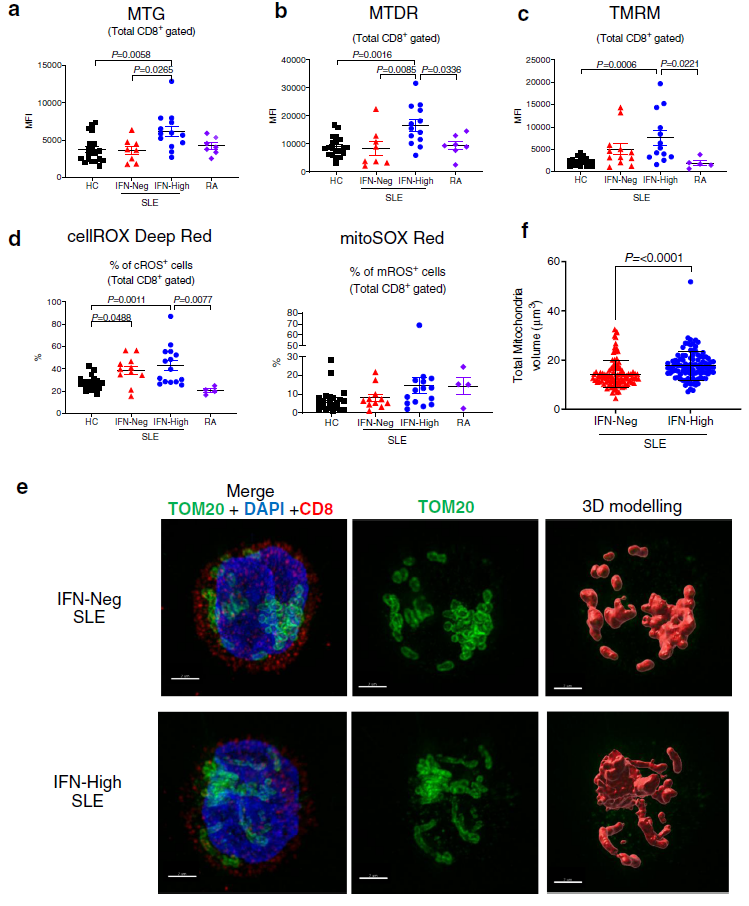
在研究I型IFN信号与线粒体异常之间的潜在联系之前,应用计算机模拟和体外相结合的方法,根据I型IFN信号的强弱程度对SLE患者进行分层:高水平的ISGs(IFN-high)、低水平的ISGs(IFN-low)和无ISGs(IFN-Neg)。随后,探究IFN-high和IFN-Neg的SLE患者中T细胞的线粒体基因型,以类风湿性关节炎(RA)患者为疾病对照。结果发现,与健康组,IFN-Neg组和RA组相比,来源于IFN-high的SLE患者的CD8+ T细胞表现出线粒体大小增加(图2a,b)和线粒体膜超极化(图2c)。在IFN-High的SLE患者中,也观察到细胞ROS (cROS)阳性CD8+ T细胞比例增加,但只是线粒体ROS (mROS)染色细胞比例有上升趋势(图2d)。在IFN -Neg的SLE患者中也检测到更高比例cROS阳性细胞,这表明了一种疾病特异性效应(图2d)。
显微图像补充了流式细胞术数据,显示在来IFN-High的SLE的CD8+ T细胞中,线粒体在形态上与IFN -Neg的SLE患者不同,在IFN-High CD8+ T细胞中,每个细胞的平均线粒体总体积更大(图2e)。综上所述,这些数据表明,在SLE患者中,长期暴露IFNα可能会触发CD8+细胞的线粒体变化,但不会触发CD4+和T细胞的线粒体变化,这可能导致代谢紊乱的细胞,对其功能具有潜在的影响。
3、来自IFN-High的SLE患者的CD8+ T细胞的SRC减少
接下来比较了从SLE患者和HC外周血分选的离体CD4 + 和CD8 + T细胞的线粒体呼吸和有氧糖酵解。使用Seahorse细胞外通量分析仪,发现IFN-Neg患者的CD8 + T细胞具有与HC相似的基础和最大耗氧量率(OCR),而IFN-High患者的CD8 + T细胞表现出较少的基础和最大OCR(图3a)。重要的是,在IFN-High CD8 + T细胞中,备用呼吸能力(SRC),反映细胞适应能量需求增加的能力,显著降低(图3a)。SRC的降低伴随着细胞内ATP水平的一些降低(附图9a)。另一方面,从相同患者中同时分离的CD4 + T细胞中未检测到OCR或SRC的显著异常(图3a)。接下来探索在IFN-High患者的CD8 + T细胞离体观察到的代谢异常是否会导致T细胞缺陷。与健康对照和IFN-Neg SLE患者相比,IFN-High SLE患者的CD8 + T细胞自发死亡增加(图3b)。总的来说,数据表明,I型IFN通路的持续激活可能会降低CD8 + T细胞的代谢适合性,从而降低其存活能力。
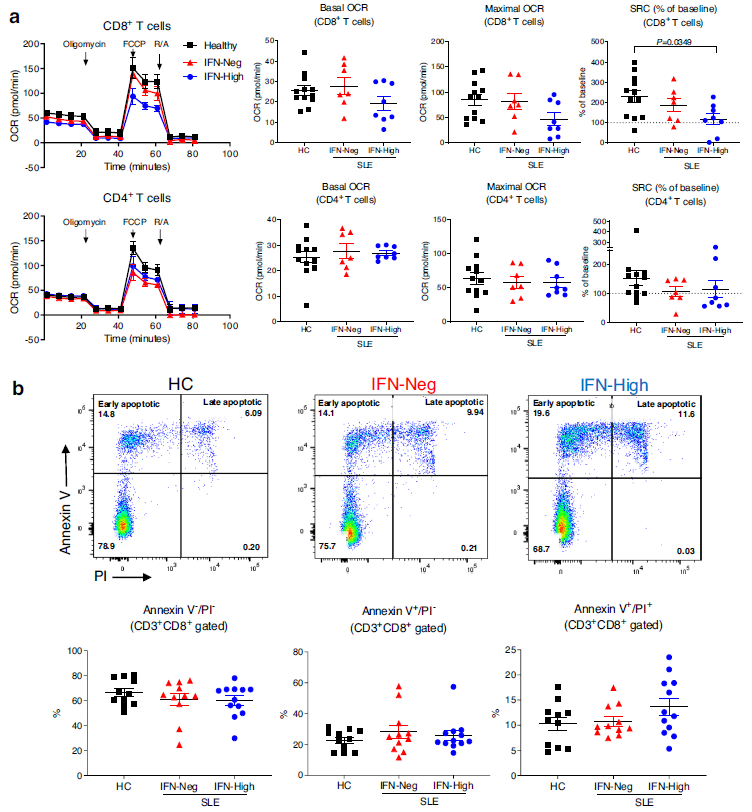
图3 SLE患者CD8+T细胞的代谢分析和凋亡率
4、TCR和IFN信号共同诱导CD8+ T细胞代谢重组
为了研究导致IFN-High CD8 + T细胞线粒体和代谢变化的连续事件,接下来使用来源于健康对照和结合了延长IFN处理和TCR活化(这是SLE患者中存在的两种基本细胞信号)的细胞。尽管CD8 + T细胞暴露于IFNα 里2天不会引发任何显著的线粒体或代谢变化但7天IFNα暴露,尤其是结合T细胞活化,可诱导mtDNA编码基因表达下调(图4a)和线粒体变化(图4b)。然后,分析了CD8 + T细胞的氧化能力,发现在有或没有CD3/CD28活化的情况下,7天IFNα刺激显著增强了基础OCR,但没有最大OCR,当数值标准化到每个样本的基础水平时,导致SRC降低,尤其是当IFNα暴露与T细胞活化结合时(图4c)。
IFNα和抗CD3/CD28磁珠长期刺激后CD8 + T细胞中SRC能力的降低表明生物能量适应性受损。研究发现,IFNα刺激的CD8 + T细胞在初始爆发后,与仅用CD3/CD28刺激的CD8 + T细胞相比,其氧化和糖酵解能力下降更快(图4d)。总之,使用健康对照CD8 + T细胞的体外研究表明,虽然单独延长IFNα处理能够触发可检测的代谢改变,但只有IFNα暴露和T细胞活化的联合才能表型复制IFN-High SLE患者CD8 + T细胞中观察到的线粒体和代谢异常。
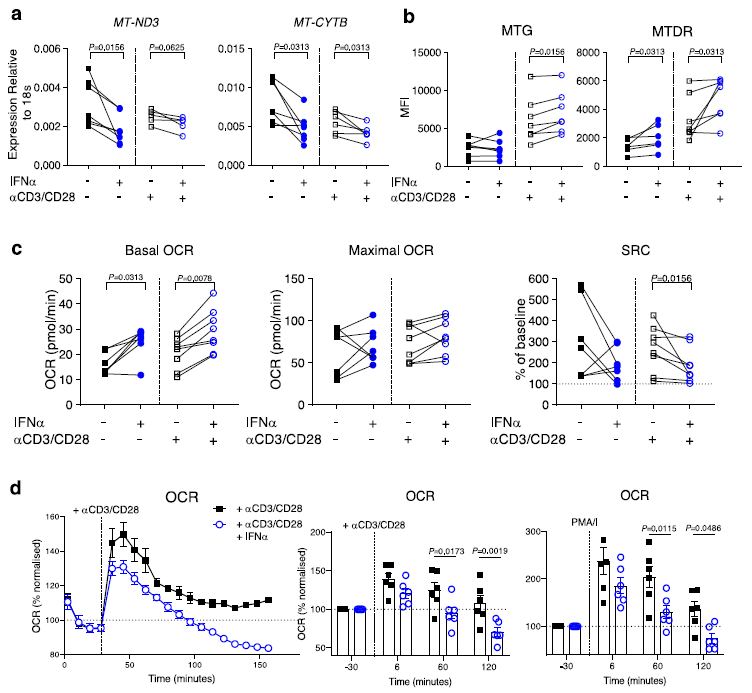
图4. 7天内IFNα暴露和T细胞活化引发的代谢变化
5、IFNα暴露诱导慢性激活CD8+ T细胞死亡
在建立重现SLE CD8 + T细胞代谢变化的实验条件后,接下来研究了下游效应。与SLE患者的离体数据一致,发现IFNα暴露延长联合T细胞活化可促进CD8 + T细胞的自发死亡(图5a)。与自发性细胞死亡数据一致,作者发现再激发后,暴露于IFNα的细胞中表达Annexin V的增殖性CD8 + T细胞百分比显著增加(图5b)。此外,在IFN刺激的细胞中检测到较少的脱颗粒(CD107a阳性)和活化的(CD69和CD25阳性)CD8 + T细胞(图5c)。总之,数据表明,I型IFN改变了SLE患者CD8+ T细胞的代谢,导致TCR再激发后细胞存活率降低。

图5. IFNα暴露7天诱导T细胞活化的变化
6、IFNα暴露增加CD8+ T细胞的NAD+的消耗
为了了解慢性I型IFN与CD8 + T细胞下游线粒体和代谢变化之间的机制联系,首先在SLE患者CD8 + T细胞的转录组学数据中探索了哪些通路与I型IFN信号相关。结果显示烟酸/烟酰胺代谢途径显示出最高的相关性(图6a),并且在IFN-high SLE患者的CD8 + T细胞中,NAD消耗酶,如ADP-核糖聚合酶(PARP9、PARP10和PARP12)和CD3828显著上调(图6b)。观察到延长IFNα和TCR刺激后CD8+T细胞中NAD +/NADH比值显著降低(图6d),该实验条件模拟了在IFN-high的SLE患者CD8 + T细胞中观察到的线粒体和代谢异常,表明在活化的CD8 + T细胞中,I型IFN信号引起的NAD消耗酶表达上调可导致NAD + 耗竭和随后的线粒体功能障碍。
为了检测补充NAD + 是否可以纠正IFNα刺激的下游效应,用1 mM β-烟酰胺单核苷酸(NMN)培养CD8 + T细胞以恢复NAD +/NADH比值(图6e)。然后,评估了用抗CD3/CD28再刺激后的氧化反应和细胞活力。补充NMN的NAD + 增加了OCR(图6f),但未增加ECAR,表明线粒体能力增加。重要的是,通过NMN处理恢复NAD + 的可用性改善了IFNα延长和TCR刺激后的细胞活力(图6 g),表明NAD途径调节这些活化的人CD8 + T细胞中的线粒体适应性和细胞存活率。总之,这些数据表明,在人TCR刺激的CD8 + T细胞中,延长IFNα暴露增加了NAD + 的消耗,并降低了NAD +/NADH比值。这导致再刺激后线粒体呼吸缺陷和细胞活力降低。NAD + 前体NMN纠正了这些代谢变化,提高了CD8 + T细胞活力。
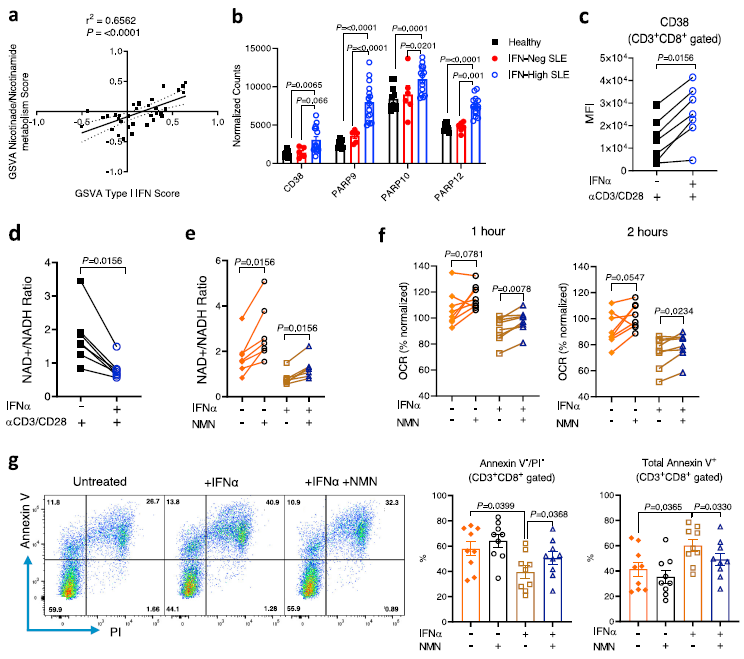
图6. IFNα增加NAD+消耗导致SCR降低和细胞活力
本文在一组临床定义明确的SLE伴活检证实的肾炎患者中进行的T细胞转录组学和代谢研究表明,高IFN信号可驱动CD8 + T细胞线粒体代谢途径的变化,使其生物能量不适应且更容易死亡。本文证明在SLE患者的CD8 + T细胞中观察到的代谢重编程是延长IFNα暴露和TCR刺激的结果。在这两种刺激的持续组合下,这可能是SLE患者特有的一种情况,CD8 + T细胞表现出与NAD + 消耗增强、线粒体氧化能力降低和存活率下降相关的PARP基因表达增加(图7)。总的来说,本文的发现证明高ISG特征与SLE CD8 + T细胞的代谢适合性之间的联系,以及它们在压力下或对抗原再激发的反应中存活的能力。
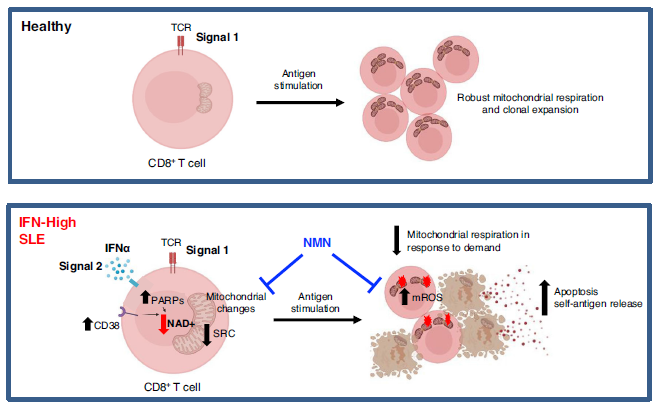
图7. I型干扰素调节SLE患者CD8+T细胞的代谢适合度
参考文献:
Buang Norzawani., Tapeng Lunnathaya., Gray Victor., Sardini Alessandro., Whilding Chad., Lightstone Liz., Cairns Thomas D., Pickering Matthew C., Behmoaras Jacques., Ling Guang Sheng., Botto Marina.(2021). Type I interferons affect the metabolic fitness of CD8 T cells from patients with systemic lupus erythematosus. Nat Commun, 12(1), 1980. doi:10.1038/s41467-021-22312-y






