M1极化巨噬细胞的外泌体miR-155与脊髓损伤
病理上,脊髓损伤(SCI)后血脊髓屏障(BSCB)破裂导致大量周围巨噬细胞浸润到损伤区域,并在新生血管周围聚集。M1极化的巨噬细胞在SCI过程中起着至关重要的作用。今天小编给大家介绍于2020年3月发表在影响因子为9.986的“Redox Biology”上的文章“Exosomal miR-155 from M1-polarized macrophages promotes EndoMT and impairs mitochondrial function via activating NF-κB signaling pathway in vascular endothelial cells after traumatic spinal cord injury”。本研究旨在探讨M1极化的骨髓源性巨噬细胞(M1-BMDMs)对血管内皮细胞的影响及其机制。在本研究中,我们发现SCI后巨噬细胞浸润可通过传递外泌体miR-155促进血管内皮细胞内内膜结构和损害线粒体功能,从而加重BSCB完整性破坏,miR-155随后通过抑制SOCS6诱导的p65降解,激活NF-κB通路。

技术路线

结果
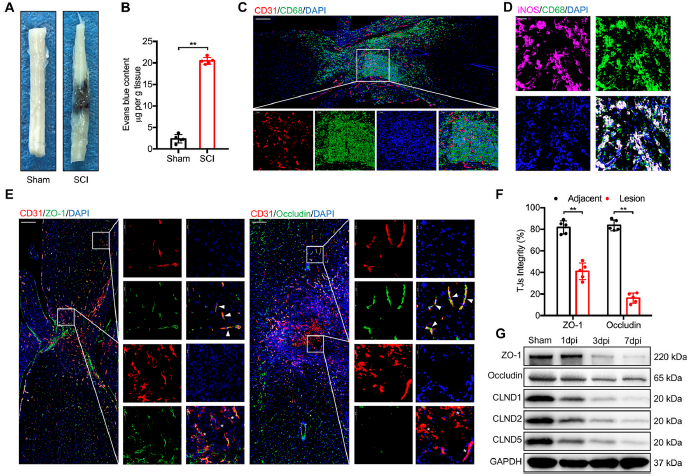
1)脊髓损伤后,BSCB随着巨噬细胞浸润和TJs破坏而破坏
脊髓损伤后,BSCB的完整性被破坏,如图1A和B所示,在脊髓损伤中可见EB染色明显,而假手术组未见EB染色,脊髓中EB染色含量也明显增加。此外,在BSCB破坏的同时,我们发现大量巨噬细胞浸润损伤区血管周围(图1C),以M1极化为主,表现为CD68+和iNOS+(图1C,1D)。此外,脊髓损伤后的病变区域可见明显的血管新生,这可能是缺氧微环境所致;然而,TJs和血管的荧光染色显示,与非损伤区相比,损伤区ZO-1和Occludin与CD31的共位较少(图1E和F)。脊髓损伤后TJs蛋白水平随时间显著降低(图1G)。考虑到脊髓损伤后浸润的M1极化巨噬细胞与病变区域的血管存在相互干扰,我们推测M1极化巨噬细胞可能对脊髓损伤后的血管内皮细胞发挥重要作用,损害BSCB的完整性。
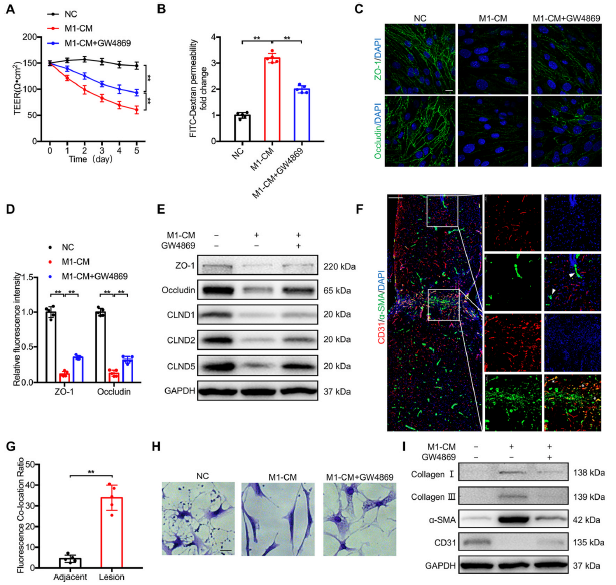
2)M1-BMDMs来源的外泌体加重了bEnd.3 细胞的EndoMT
我们评估了M1-BMDMs对bEnd.3细胞的影响。结果表明,M1-BMDMs条件培养基(M1-CM)显著降低了bEnd.3 细胞TEER值(图2A),并增加通透性(图2B)。此外,TJs蛋白荧光染色显示,M1-CM处理显著降低了bEnd.3 细胞膜ZO-1和Occludin的表达(图2C和D)。为了进一步研究M1- BMDMs是否通过外泌体破坏血管内皮细胞的TJs,我们使用外泌体分泌抑制剂GW4869预处理M1- BMDMs。我们发现,加入GW4869部分逆转了M1-CM诱导的TEER值的下降(图2A),渗透率增加(图2B);GW4869也逆转了TJs蛋白荧光强度下降的趋势(图2C和D)。相应的,TJs蛋白表达水平也出现了类似的结果(图2E)。有趣的是,通过对脊髓切片中的α-SMA和CD31进行共染色,我们发现损伤部位的共定位比未损伤部位更多(图2F和G)。M1-CM显著改变bEnd.3 细胞形态,分枝减少,胞体拉长(图2H)。此外,M1-CM暴露显著降低了CD31的表达,并强烈增强了EndoMT标记物胶原I、III和α-SMA在bEnd.3 细胞中的表达(图2I)。然而,GW4869可以部分扭转这些影响。综上所述,外泌体可能介导巨噬细胞和血管内皮细胞之间的相互作用,并可能是巨噬细胞诱导血管内皮细胞 EndoMT的原因。
3)M1-BMDMs来源的外泌体上调ROS水平,损害bEnd.3 细胞的线粒体功能
已有研究表明,ROS与BSCB中断有关,调节ROS水平在促进中枢神经系统损伤后功能恢复中起着至关重要的作用。基于之前的结果,我们研究了M1-BMDMs和ROS在bEnd.3 细胞中的关系。流式细胞术分析表明,M1-CM处理可显著提高bEnd.3 细胞中ROS水平。GW4869可以部分逆转这种增加(图3 A和B)。此外,与M1-CM孵育后,线粒体超氧化物水平显著升高,GW4869部分消除线粒体超氧化物水平(图3C和D)。如图JC-1染色所示,加入M1-CM后线粒体电位显著降低,GW4869部分恢复线粒体电位(图3E和F)。M1-CM处理使线粒体长度缩短、肿胀,线粒体破碎的细胞比例明显增加。然而,GW4869可以部分逆转线粒体形态变化(图3G和H)。此外,M1-CM暴露显著降低了氧化磷酸化的生物标志物OCR(图3I)。基础呼吸,ATP产生,呼吸能力,呼吸逆转在添加M1-CM后显著减少,而GW4869部分缓解了这一影响(图3J)。

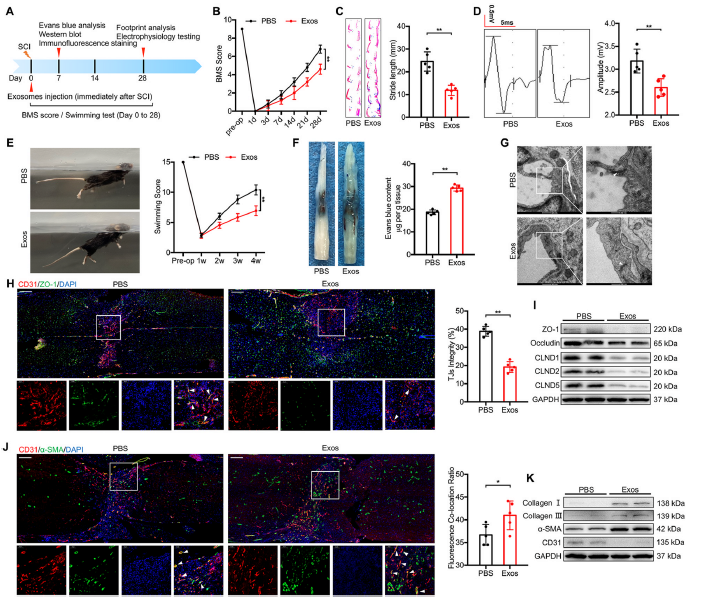
4)M1-BMDMs来源的外泌体在体内阻碍脊髓损伤后的运动功能恢复和破坏BSCB
为了进一步研究巨噬细胞在SCI微环境中的作用及其对血管内皮细胞的潜在影响,我们提取并鉴定了来自M1-BMDMs (M1-Exos)的外泌体。脊髓损伤后立即注射外泌体,在指定时间进行一系列行为评估(图4A)。BMS行为分析表明,M1-Exos注射可导致脊髓损伤后后肢运动功能评分降低(图4B)。足迹分析、电生理测试和游泳测试显示了类似的结果,M1-Exos处理导致更短的步幅(图4C),更低的MEPs振幅(图4D),更倾斜的身体角度,更下垂的尾巴(图4E)。EB外渗实验显示,M1-Exos处理组有更多EB染料渗漏到间隙中(图4F), TEM下血管TJs的电子密度远低于PBS组,两内皮细胞之间的间隙也更明显(图4G)。此外,注射M1-Exos后,脊髓病变中血管ZO-1的荧光强度显著减弱(图4H);TJs蛋白表达水平也明显下调(图4I)。我们还发现,M1-Exos给药后,病变区域更多的α-SMA与CD31共存(图4J);I型胶原、III型胶原和α-SMA蛋白水平上调,CD31表达降低(图4K)。以上结果表明,M1- Exos可能诱发EndoMT加重脊髓损伤后BSCB的损伤,阻碍运动功能恢复。
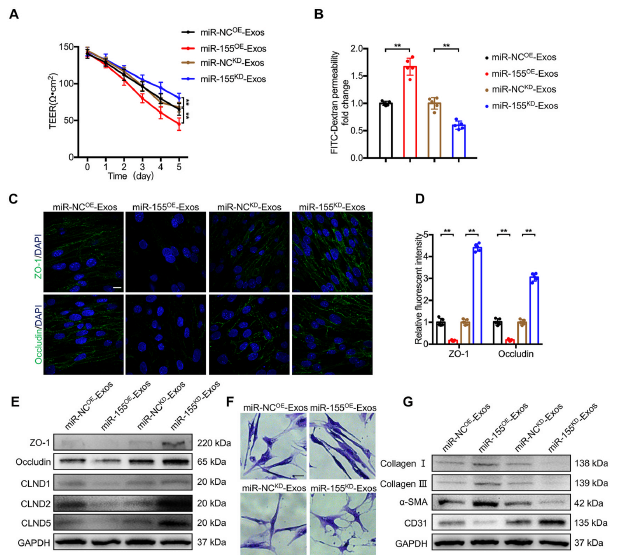
5)M1-Exos通过传递miR-155加重了EndoMT
为了研究外泌体miR-155在SCI后M1-Exos介导的BSCB破坏恶化中的作用,构建miR-155过表达(miR-155OE)和敲低(miR-155KD) BMDMs,然后分离外泌体并处理bEnd.3细胞。如图5A和B所示,miR-155OE-Exos组TEER值显著降低,通透性显著增加,而miR-155KD-Exos组则相反。加入miR-155OE-Exos后,ZO-1和Occludin的荧光强度明显降低,而miR-155KD-Exos处理后,ZO-1和Occludin的表达显著增强(图5C和D)。此外,western blot检测TJs蛋白的表达,结果与上述讨论的结果相似(图5E)。miR-155OE-Exos可促进细胞形态转化,其分支更少,体细胞更长。miR-155KD-Exos处理后的结果则相反(图5F)。miR-155OE-Exos暴露后,I型胶原蛋白、III型胶原蛋白和α-SMA蛋白水平上调,CD31蛋白水平下调,而miR-155KD-Exos作用相反(图5G)。以上结果表明,外泌体miR-155在促进bEnd.3细胞的EndoMT中起着至关重要的作用。
6)M1-Exos通过传递miR-155上调ROS水平,损害bEnd.3细胞线粒体功能
我们研究了外泌体miR-155与bEnd.3细胞中线粒体功能的关系。我们发现,与miR-NCOE-Exos相比,miR-155OE-Exos处理上调了ROS水平(图6A和B),线粒体超氧化物水平(图6C和D)和线粒体电位(图6E);然而,miR-155KD-Exos处理则显示了相反的结果(图6A-E)。此外,miR-155OE-Exos可使线粒体肿胀更大,形态更短,线粒体碎片细胞比例更高,而miR-155KD-Exos可减轻线粒体肿胀(图6F和G)。miR-155OE-Exos处理后的OCR、基础呼吸、ATP产生、呼吸能力和呼吸逆转均明显下降,而miR-155KD-Exos处理减轻了氧化呼吸功能障碍(图6H和I)。这些结果表明,上调外泌体miR-155可导致过度ROS的产生和线粒体功能障碍。

7)miR-155负调控SOCS6表达,激活NF-κB通路
为了进一步探讨外泌体miR-155诱导EndoMT和线粒体功能障碍的潜在机制,我们重点研究了miR-155的下游基因。首先,利用在线miRNA靶标数据库预测了84个潜在靶基因。SOCS6是具有3’UTR的下游mRNA之一,可能与miR-155结合(图7A)。结合GSE49329和GSE49330数据库,我们发现miR-155的表达与SOCS6的表达呈负相关(图7B)。为了进一步证实SOCS6 3’UTR是miR-155的直接靶标,我们根据预测的结合位点(图7C)构建了SOCS6 3’UTR野生型(WT)和突变型(MUT)序列。荧光素酶报告实验显示,与对照组相比,共转染SOCS6的WT-3’UTR时,miR-155过表达明显降低了荧光素酶活性(图7D)。qRT-PCR和western blot进一步显示,miR-155过表达导致SOCS6表达降低,而miR-155敲低上调SOCS6 mRNA和蛋白水平(图7E和F)。GO分析显示miR-155可以负向调控细胞-细胞粘附,参与调控成纤维细胞增殖(图7G)。从GO分析可知,miR-155可能介导NF-κB信号通路(图7G)。过表达miR-155可显著提高细胞质和细胞核中p65蛋白的水平,而敲低miR-155可起到相反的作用(图7H)。
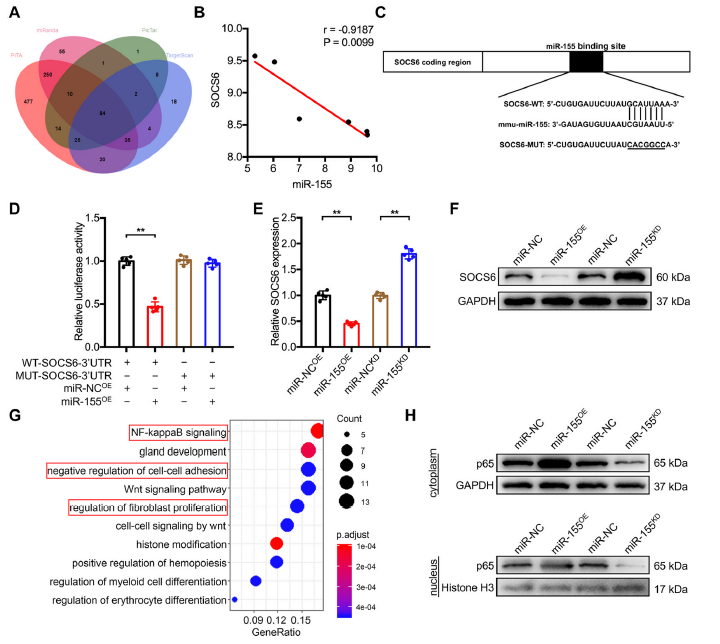
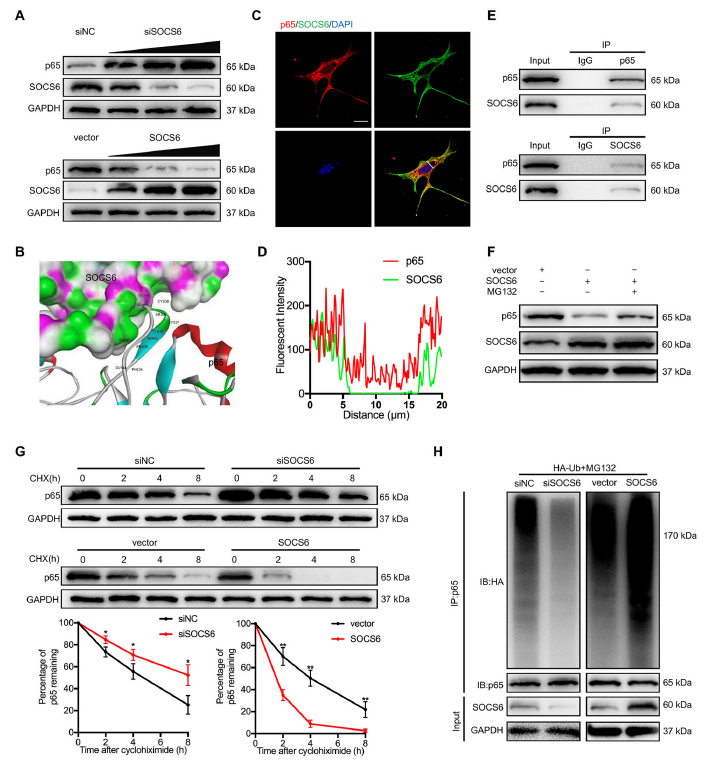
8)SOCS6通过泛素化和降解p65抑制NF-κB信号通路
鉴于miR-155通过增强细胞质和细胞核中p65的表达负调控SOCS6的表达,并激活NF-κB信号通路,我们下一步研究SOCS6与p65之间潜在的相互作用。首先,我们在bEnd.3细胞中过表达或下调SOCS6。发现p65表达与SOCS6水平呈负相关(图8A)。Discovery Studio™分析的3D对接也表明SOCS6可能与p65相互作用(图8B)。此外,荧光共定位实验表明,SOCS6与p65在细胞质中共定位(图8C和D), Co-IP实验进一步揭示了SOCS6与p65的相互作用(图8E)。值得注意的是蛋白酶体MG132可以部分逆转SOCS6过表达对p65蛋白水平的抑制作用(图8F)。同时,在环己酰亚胺的情况下,SOCS6的沉默显著延缓了内源性p65的降解速率,而过表达SOCS6则显著加速了p65的降解(图8G)。最后,通过泛素化实验验证SOCS6是否通过蛋白酶体降解诱导p65失稳。我们发现过表达SOCS6增加了bEnd.3细胞中p65多聚泛素化。沉默SOCS6则相反(图8H)。综上所述,这些结果表明SOCS6可以与p65结合并诱导其多聚泛素化和蛋白酶体降解。
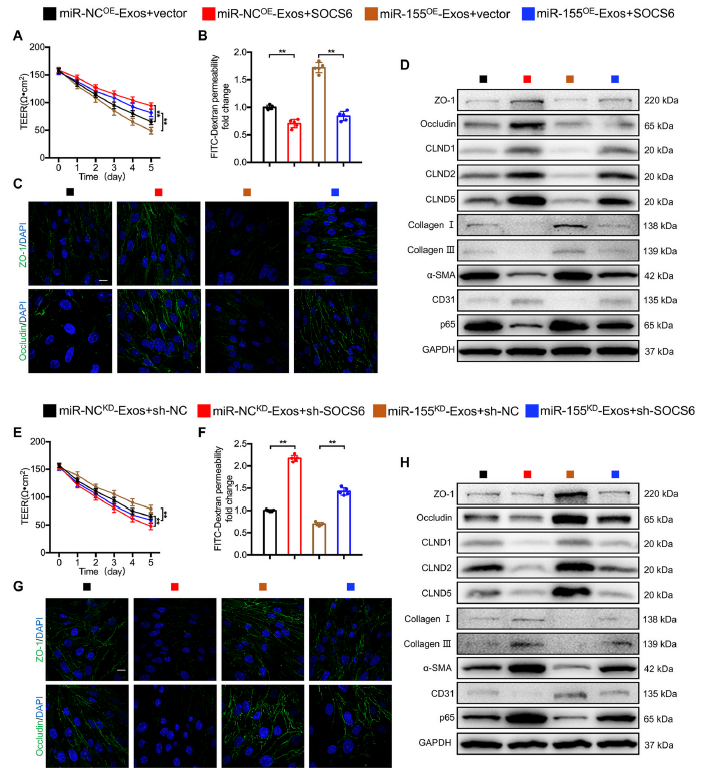
9)M1-Exos通过miR-155/ SOCS6/p65轴加重了bEnd.3细胞的EndoMT
为了探讨外泌体miR-155/SOCS6/p65轴在M1-Exos诱导的EndoMT中的作用,我们在体外进行了一系列功能丧失和功能获得实验。我们发现,SOCS6过表达部分逆转了miR-NCOE-Exos或miR-155OE-Exos诱导的TEER值降低和通透性增加(图9A和B)。ZO-1和Occludin的荧光强度进一步显示SOCS6过表达显著逆转了miR-NCOE-Exos或miR-155OE-Exos在bEnd.3细胞中引起的TJs破坏(图9C)。此外,EndoMT标记物的蛋白水平与这些结果一致,SOCS6上调可消除miR-NCOE-Exos或miR-155OE-Exos介导的p65上调(图9D)。值得注意的是,当miR-NCKD-Exos或miR-155KD-Exos下调SOCS6时,则出现相反的结果(图9E-H)。
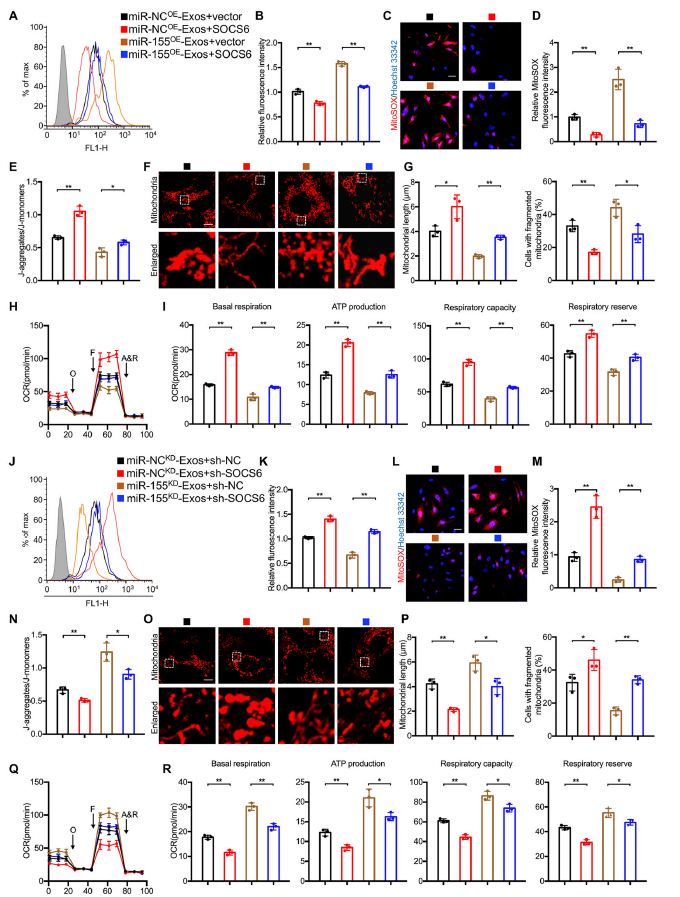
10)M1-Exos在bEnd.3细胞中通过miR-155/SOCS6/p65轴上调ROS水平,损害线粒体功能
我们进行了一系列功能丧失和功能获得实验来研究miR-155/SOCS6/p65轴在调节线粒体功能中的作用。如图10A -E所示,SOCS6过表达消除了miR-NCOE-Exos或miR-155OE-Exos诱导的ROS水平(图10A和B)、线粒体超氧化物含量(图10C和D)和线粒体电位(图10E)的升高。此外,SOCS6过表达显著缓解了miR-NCOE-Exos或miR-155OE-Exos处理后的线粒体肿胀,并降低了线粒体碎片细胞的比例(图10F和G)。进一步的结果表明,SOCS6过表达可挽救miR-NCOE-Exos或miR-155OE-Exos处理导致的OCR、基础呼吸、ATP产生、呼吸能力和呼吸逆转的下降(图10H和I)。miR- NCKD-Exos或miR-155KD-Exos处理后沉默SOCS6则出现相反的结果(图10J-R)。
结论:在本研究中,我们发现SCI后浸润的巨噬细胞可通过传递外泌体miR-155促进EndoMT,损害线粒体功能,从而加重BSCB完整性,随后通过抑制SOCS6诱导的p65降解,激活NF-κB通路。我们的工作可能会加强对巨噬细胞和血管内皮细胞之间相互干扰的理解,并揭示脊髓损伤后BSCB完整性的潜在调节机制。






