NOX4与阿尔茨海默氏症

氧化应激与阿尔茨海默病(AD)的发病机制有关。线粒体功能障碍与AD期间神经毒性中的氧化应激和活性氧(ROS)有关。线粒体代谢受损与AD脑损伤中的线粒体功能障碍有关。虽然已确定NOX4在脑损伤中的作用,但NOX4调控AD中星形胶质细胞铁死亡的机制尚不清楚。因此,小编给大家介绍于2021年3月发表于影响因子为9.986的“Redox Biology”上的文章“NOX4 promotes ferroptosis of astrocytes by oxidative stress-induced lipid peroxidation via the impairment of mitochondrial metabolism in Alzheimer’s diseases”。我们的结果表明,NOX4通过脂质过氧化损伤AD中线粒体代谢,促进星形胶质细胞的铁死亡。
技术路线
结果
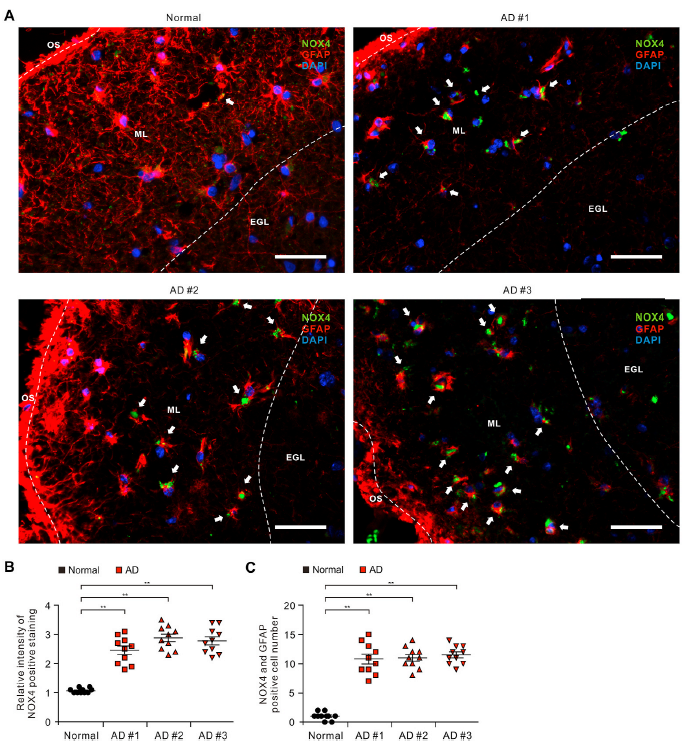
1)NOX4水平在阿尔茨海默病患者皮质区受损星形胶质细胞中升高
为了探讨NOX4在AD患者星形胶质细胞损伤中的作用,我们分析了AD患者大脑皮质星形胶质细胞中NOX4蛋白水平是否升高。我们采用免疫荧光染色法检测AD患者或非AD供者(正常)颞叶皮质组织GFAP阳性星形胶质细胞中的NOX4蛋白水平(图1 A和B)。免疫荧光染色显示AD患者皮质区分子层GFAP阳性星形胶质细胞中NOX4阳性染色强度相对于非AD供者增加(图1A)。此外,AD患者皮质区ML中受损的GFAP阳性星形胶质细胞中的NOX4阳性染色强度高于非AD供者(图1 A和B)。值得注意的是,AD患者中NOX4与GFAP亚细胞共定位阳性的受损星形胶质细胞数量显著增加(图1C)。与非AD供者相比,每一位AD患者的NOX4水平普遍较高。这些结果提示,AD患者星形胶质细胞受损时NOX4蛋白水平升高。
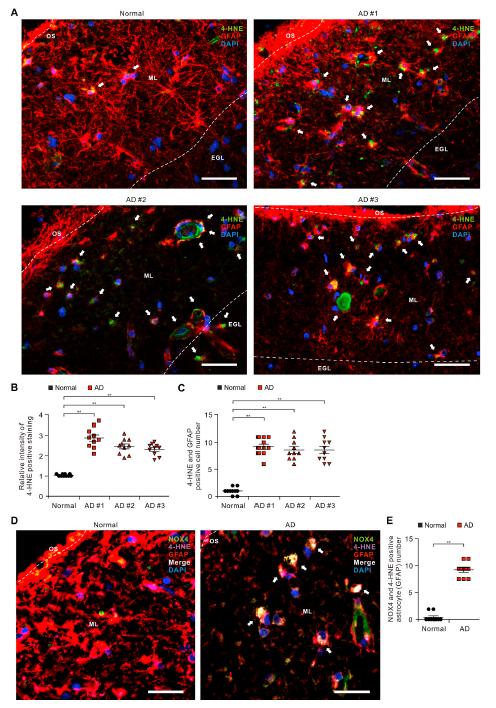
2)阿尔茨海默病患者皮质区受损星形胶质细胞中氧化应激诱导的脂质过氧化水平升高
由于NOX4蛋白水平在AD患者受损星形胶质细胞中升高,我们研究NOX4在AD患者受损星形胶质细胞氧化应激中的作用。我们用免疫荧光染色法检测了AD患者或非AD供者大脑颞叶皮质组织中GFAP阳性星形胶质细胞中4-HNE的蛋白水平(图2A)。免疫荧光染色显示,AD患者(AD)皮质区分子层GFAP阳性星形胶质细胞中4- HNE阳性染色强度相对于非AD供者增加(图2A、B)。此外,AD患者皮质区ML中受损的GFAP阳性星形胶质细胞4-HNE阳性染色强度高于非AD供者(图2A和B)。AD患者中4-HNE与GFAP亚细胞共定位阳性的受损星形胶质细胞数量显著增加(图2C)。此外,相对于非AD供体,4-HNE在AD患者的NOX4阳性星形胶质细胞中共定位(图2D)。AD患者的NOX4和4-HNE阳性星形胶质细胞数量相对于非AD供者显著增加(图2E)。这些结果提示AD患者受损星形胶质细胞中氧化应激诱导的脂质过氧化水平升高。
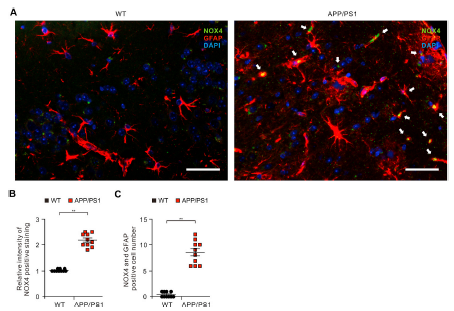
3)APP/PS1小鼠大脑皮质区受损星形胶质细胞中NOX4水平升高
我们研究了NOX4在APP/PS1双转基因AD小鼠星形胶质细胞损伤中的作用。我们使用免疫荧光染色检测APP/PS1小鼠和野生型小鼠皮质GFAP阳性星形胶质细胞中NOX4的蛋白水平。免疫荧光染色显示,APP/PS1小鼠皮质区GFAP阳性星形胶质细胞中NOX4阳性染色强度高于WT小鼠(图3A和B)。与WT小鼠相比,APP/PS1小鼠中NOX4与GFAP亚细胞共定位阳性的受损星形胶质细胞数量显著增加(图3C)。这些结果提示APP/PS1小鼠星形胶质细胞受损时NOX4蛋白水平升高。
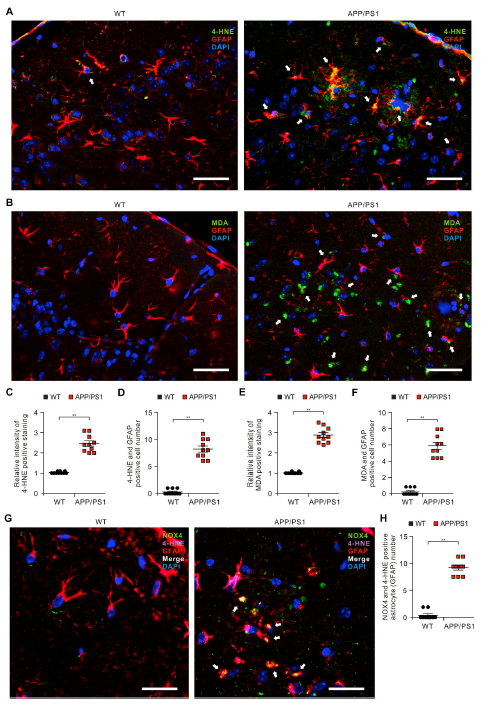
4)APP/PS1小鼠大脑皮质区受损星形胶质细胞中氧化应激诱导的脂质过氧化水平升高
我们研究了NOX4来源的氧化应激在APP/PS1小鼠受损星形胶质细胞中的作用。我们用免疫荧光染色法测定了APP/PS1小鼠和野生型(WT)小鼠大脑皮层GFAP阳性星形胶质细胞中4-HNE的蛋白水平(图4A)。免疫荧光染色显示,与WT小鼠相比,APP/PS1小鼠皮质区GFAP阳性星形胶质细胞中4- HNE阳性染色强度增加(图4A、C)。APP/PS1小鼠皮质区受损的GFAP阳性星形胶质细胞中4- HNE阳性染色强度升高。此外,与WT小鼠相比,APP/PS1小鼠中4- HNE和GFAP亚细胞共定位呈阳性的受损星形胶质细胞数量显著增加(图4D)。与WT小鼠相比,APP/PS1小鼠皮质区GFAP阳性星形胶质细胞(图4B和E)和MDA与GFAP亚细胞共定位阳性的受损星形胶质细胞(图4F)数量增加。4-HNE在APP/PS1小鼠NOX4阳性星形胶质细胞中共定位(图4G)。此外,APP/PS1小鼠NOX4和4-HNE阳性星形胶质细胞数量显著增加(图4H)。这些结果提示APP/PS1受损小鼠星形胶质细胞中氧化应激诱导的脂质过氧化水平升高。
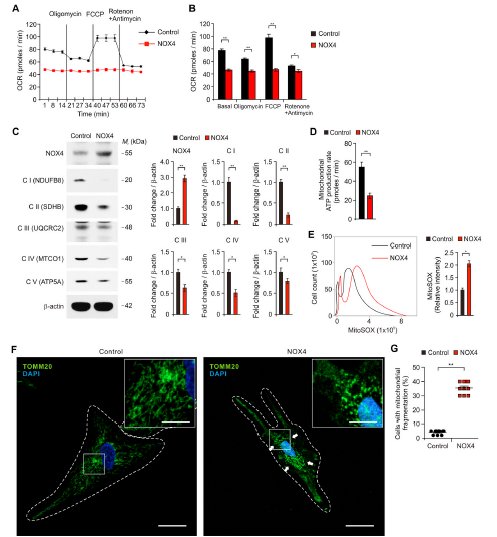
5)NOX4的升高通过抑制人类星形胶质细胞线粒体呼吸和ATP的产生来促进线粒体代谢的损伤,从而促进氧化应激
我们研究了AD期间NOX4升高诱导受损星形胶质细胞氧化应激的潜在分子机制。与对照组相比,NOX4过表达显著抑制了OCR的基础水平,且显著降低了寡霉素和FCCP作用下的OCR水平(图5A和B)。接下来,我们研究了NOX4上调对人类星形胶质细胞线粒体呼吸途径调控的分子靶点。我们分析了包括NADH在内的5种线粒体ETC蛋白复合物的水平(图5C)。与OCR水平一致,与对照组相比,NOX4过表达显著抑制了5种线粒体氧化磷酸化酶复合物的蛋白水平并显著减少ATP的产生(图5D)。免疫荧光染色显示,与对照组相比,NOX4的升高导致线粒体碎裂,并显著增加了线粒体碎裂的细胞数量(图5G)。这些结果表明,NOX4的升高通过抑制人类星形胶质细胞线粒体呼吸和ATP的产生,从而损害线粒体代谢,从而促进氧化应激。
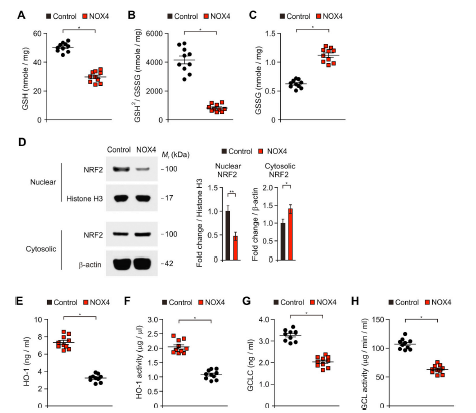
6)NOX4诱导的线粒体代谢损伤通过抑制人类星形胶质细胞的细胞抗氧化过程而诱导氧化应激
我们研究了NOX4诱导的线粒体代谢损伤是否可以通过抑制人体星形胶质细胞的细胞抗氧化过程来诱导氧化应激。与对照组相比,NOX4的升高显著降低了谷胱甘肽(GSH)水平和谷胱甘肽/氧化谷胱甘肽(GSSG)的比值(图6A和B)。NOX4的升高也增加了GSSG的水平(图6C)。由于NOX4导致GSH减少以及GSH/ GSSG比值降低,我们接下来研究NOX4是否可以影响人类星形胶质细胞中NRF2信号通路,这是细胞抗氧化反应的关键调控因子。与对照组相比,NOX4的升高抑制了NRF2在细胞质中的核易位(图6D)。此外,NRF2靶基因HO-1和GCL的水平和活性在人星形胶质细胞中被NOX4过表达显著抑制(图6E和F)。这些结果表明,NOX4诱导的线粒体代谢损伤通过抑制人星形胶质细胞的细胞抗氧化过程而诱导氧化应激。
7)NOX4通过氧化应激诱导的人体星形胶质细胞的脂质过氧化促进铁死亡
为了探讨NOX4调控AD星形胶质细胞氧化应激诱导的细胞死亡的分子机制,我们检测NOX4的升高是否能通过氧化应激诱导的人星形胶质细胞脂质过氧化促进铁死亡。我们用免疫荧光染色法测定了4- HNE在人星形胶质细胞中的蛋白水平。免疫荧光染色显示,与对照组相比,NOX4的升高增加了4-HNE蛋白的水平,增加了质膜中脂质过氧化源性液滴的含量,细胞的形状出现收缩(图7A)。NOX4过表达使4- HNE阳性细胞数量显著增加(图7B)。NOX4过表达增加了4-HNE水平和MDA水平(图7C)。值得注意的是,与对照组相比,NOX4的升高增加了铁的积累,这是铁死亡的特异性标志(图7D)。接下来,我们使用3D分析仪分析NOX4上调后人星形胶质细胞细胞毒性的形态学变化(图7E)。相对于对照,NOX4的升高诱导了细胞毒性的形态学特征,包括细胞质面积缩小和起泡(图7E)。此外,与对照组相比,NOX4升高后,形态死亡细胞数量显著增加(图7F)。与形态学分析结果一致,相对于对照,NOX4的升高显著增加了细胞毒性水平(图7G)。这些结果表明,NOX4通过氧化应激诱导的人星形胶质细胞脂质过氧化促进了铁死亡。

结论:NOX4通过线粒体代谢损伤,氧化应激诱导的脂质过氧化作用促进星形胶质细胞的铁死亡,这是AD期间星形胶质细胞损伤的一种重要分子机制。






