Saikosaponin D通过靶向FTO/m6A信号治疗白血病
急性髓系白血病(AML)的靶向治疗的实施一直具有挑战性。FTO是一种m6A去甲基酶,作为一种致癌基因,促进白血病癌基因介导的细胞转化和白血病发生。因此为大家介绍于2021年3月发表于影响因子为8.579的Theranostics上文章“Saikosaponin D exhibits anti-leukemic activity by targeting FTO/m6A signaling”。在这里,我们研究了Saikosaponin-d (SsD)在AML中广泛的抗增殖作用中的作用,并通过靶向SsD的FTO来评估m6A去甲基化活性。SsD在体外和体内均能广泛抑制AML细胞增殖,促进细胞凋亡和细胞周期阻滞。机制上,SsD直接靶向FTO,从而增加了m6A RNA的甲基化,降低了下游基因转录本的稳定性,导致相关通路的抑制。重要的是,SsD还克服了FTO/m6A介导的白血病对酪氨酸激酶抑制剂的耐药性。总之,FTO依赖的m6A RNA甲基化介导了SsD的抗白血病作用,使SsD成为一种治疗白血病的药物。

技术路线

结果
1)SsD在AML中表现出抗增殖活性
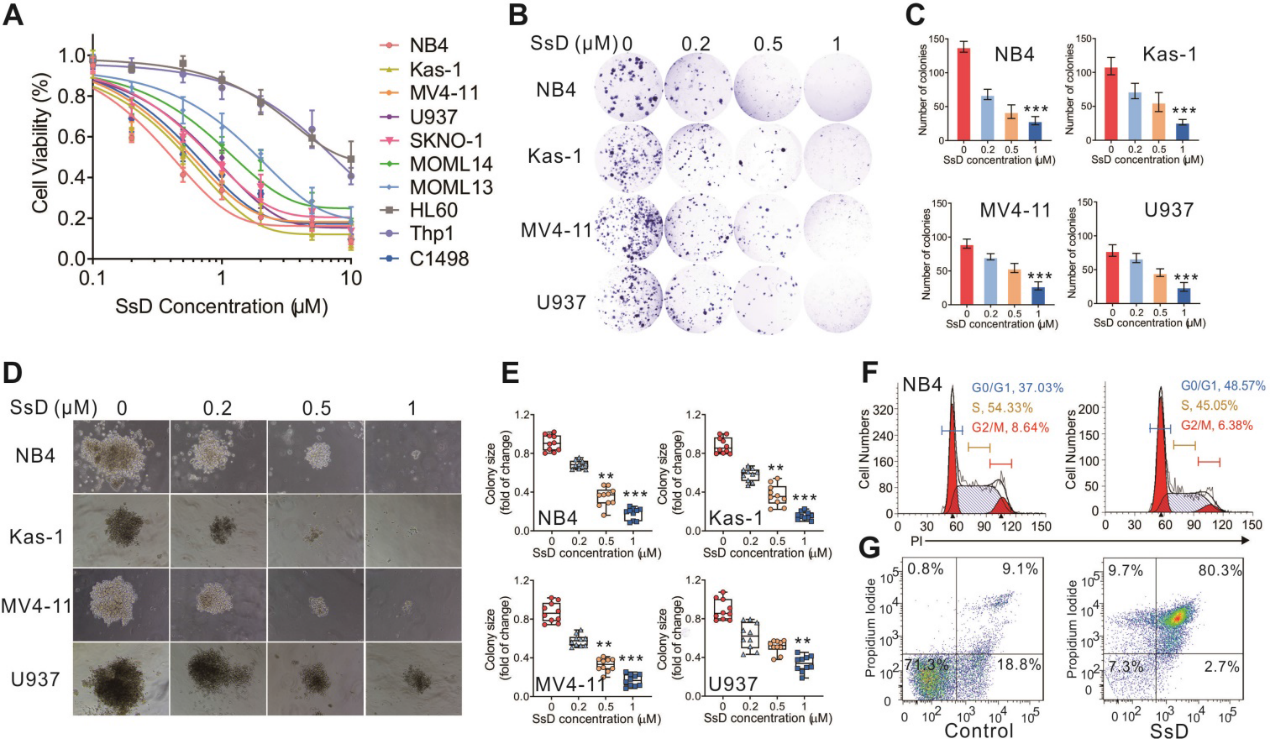
为了阐明SsD在白血病中的药理作用,我们在10个人白血病细胞系中探讨了一系列SsD浓度的影响。我们发现SsD在大多数白血病细胞系中以剂量依赖的方式抑制细胞活力(图1A)。为了进一步研究SsD对白血病的抑制作用,我们在4种白血病细胞系NB4、kas1、MV4-11和U937 (SsD敏感性排名前4位的细胞)进行了集落实验。与细胞活力结果相似,SsD显著抑制了所测细胞系的集落数量和大小(图1B-E)。有趣的是,SsD对细胞增殖和活力的抑制可能是由于细胞周期阻滞在G1期和NB4细胞凋亡增加(图1F-G)。
2)SsD响应相关基因和通路的鉴定
为了进一步确定可能与白血病细胞中SsD敏感性相关的潜在靶点,我们对SsD处理过的NB4细胞进行了RNA测序。我们共发现3732个上调基因和3442个下调基因(图2A)。为了揭示SsD的潜在机制,我们进行了富集分析并研究了差异基因相关的通路。我们筛选了上调和下调基因富集的前10个通路(图2B)。此外,我们使用GSEA研究SsD处理影响的信号通路(图2C)。我们的数据显示,SsD处理导致MYC靶点、E2F靶点和G2M检查点信号级联受到抑制。有趣的是,这些发现与FTO抑制剂和内源性FTO的下调抑制的信号通路相一致。因此,SsD的抑制作用可能有助于FTO抑制细胞周期和增殖(图2D-E)。此外,绝大多数通过FTO敲低而上调的信号通路对SsD富集,同样,绝大多数被SsD抑制的信号通路也被FTO敲低而抑制(图2F)。更重要的是,SsD介导的m6A相关基因的变化具有显著的一致性(图2G)。综上所述,SsD可能参与了FTO介导的m6A RNA甲基化途径。

3)FTO是SsD的直接靶点
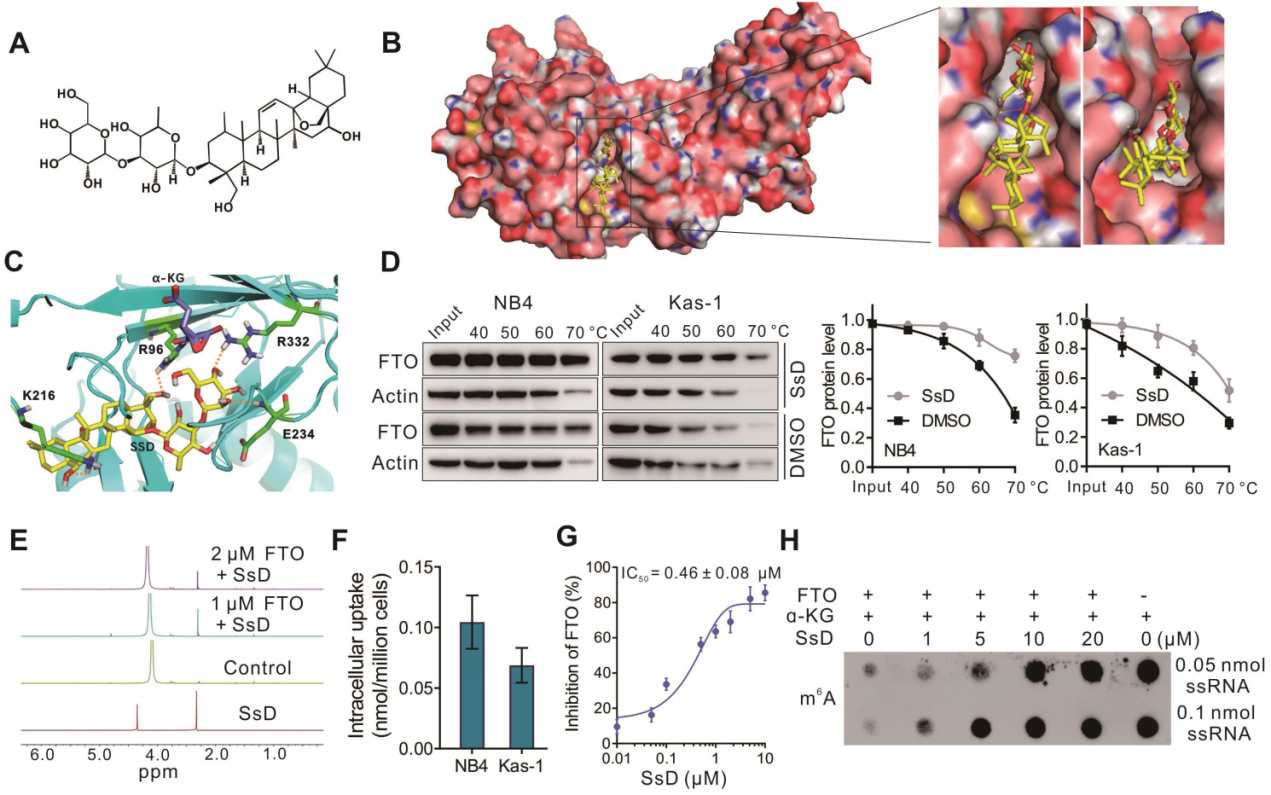
基于基因芯片数据,SsD介导的白血病发生抑制主要是由于m6A通路,我们假设SsD可能调节白血病m6A RNA甲基化。我们确定了FTO在白血病发生中起作用。为了验证SsD与FTO的直接结合,我们首先基于已发表的FTO晶体结构进行分子对接分析。SsD的最佳结合位点表现出与底物结合位点互补的特殊形状,占据了整个结合口袋(图3A-B)。4个氨基酸残基(R96, K216, E234, R332)参与了与SsD的相互作用(图3C),在抑制FTO活性方面发挥了关键作用。在NB4和Kas-1 AML细胞中,SsD与FTO蛋白的结合导致了明显的热转移,表明对热降解有保护作用(图3D)。接着,我们利用NMR进一步研究了FTO和SsD之间的相互作用,在滴定过程中观察到信号的剂量依赖性衰减(图3E)。这些结果表明,FTO干扰了SsD的状态。接下来,我们使用LC-MS/MS定量分析了细胞对SsD的摄取(图3F)。在NB4和Kas-1细胞中,SsD在0.05-0.14 nmol/百万细胞中检测到。HPLC显示SsD对体外FTO去甲基化的抑制活性(图3G)。此外,在无细胞系统中,斑点印迹试验证实了SsD介导的FTO活性竞争性抑制(图3H)。综上所述, FTO是SsD的直接靶点,可能是SsD诱导的白血病细胞生长抑制作用的主要介质。
4)SsD通过直接抑制FTO m6A去甲基化活性来诱导m6A修饰
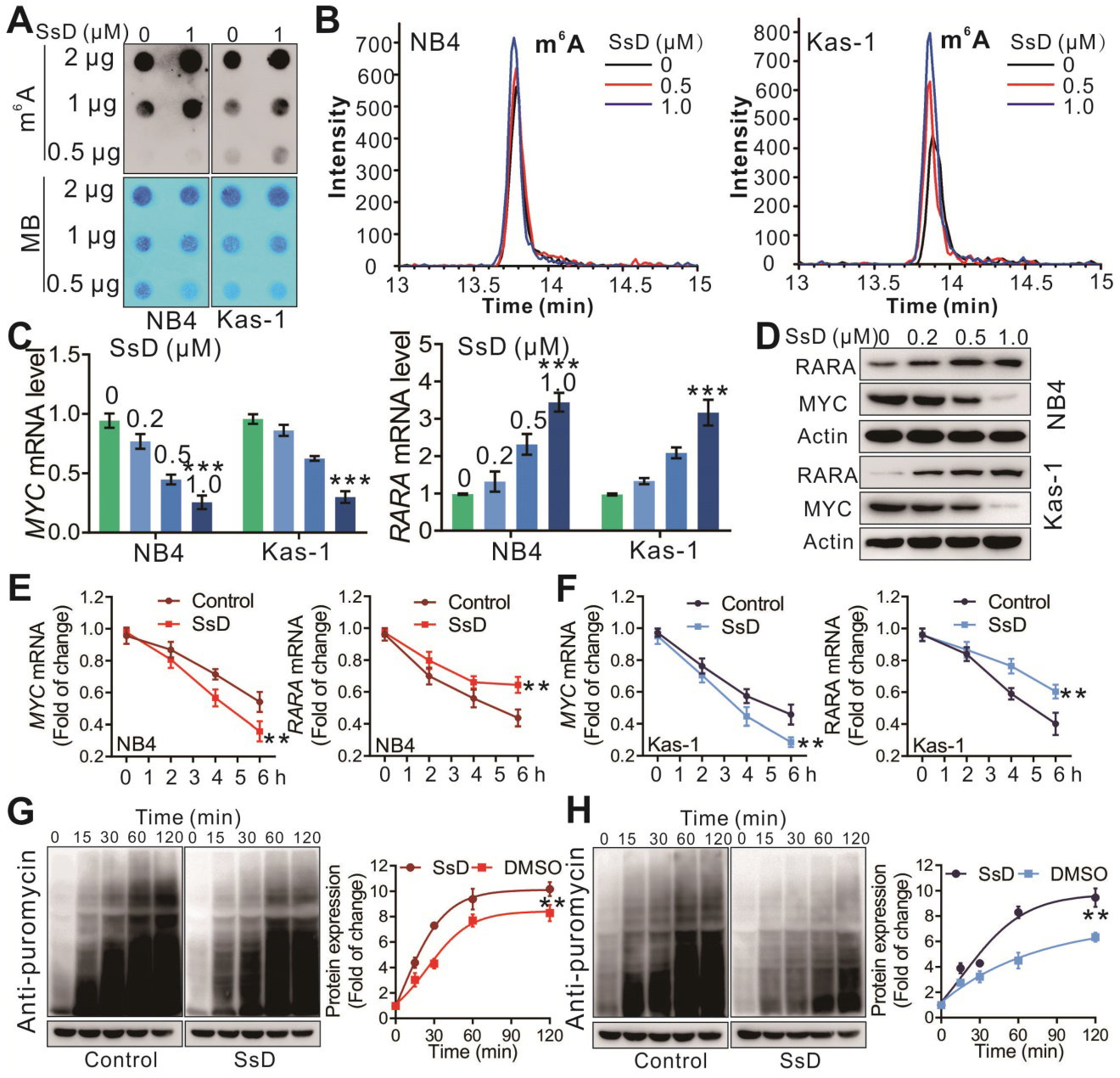
为了检测m6A在RNA上的变化,我们在SsD处理的白血病细胞中进行了m6A点印迹实验。如图4A所示,SsD显著增加了m6A在转录组中的丰度。此外,HPLC-MS/MS定量证实了SsD处理的NB4和Kas-1细胞mRNA中细胞m6A的增加(图4B)。接下来,我们检测了FTO的两个直接靶点MYC和RARA在SsD处理的细胞中的表达。SsD在mRNA和蛋白水平显著下调了NB4和Kas-1细胞的MYC,而上调了RARA(图4C-D)。有趣的是,SsD依赖的MYC和RARA的减少是由于FTO过表达细胞中mRNA和蛋白稳定性的降低(图4E-4H)。综上所述,这些结果证明了FTO及其下游靶点(如MYC, RARA)是FTO过表达白血病细胞中SsD的主要效应因子。
5)SsD可显著抑制AML在体内的进展
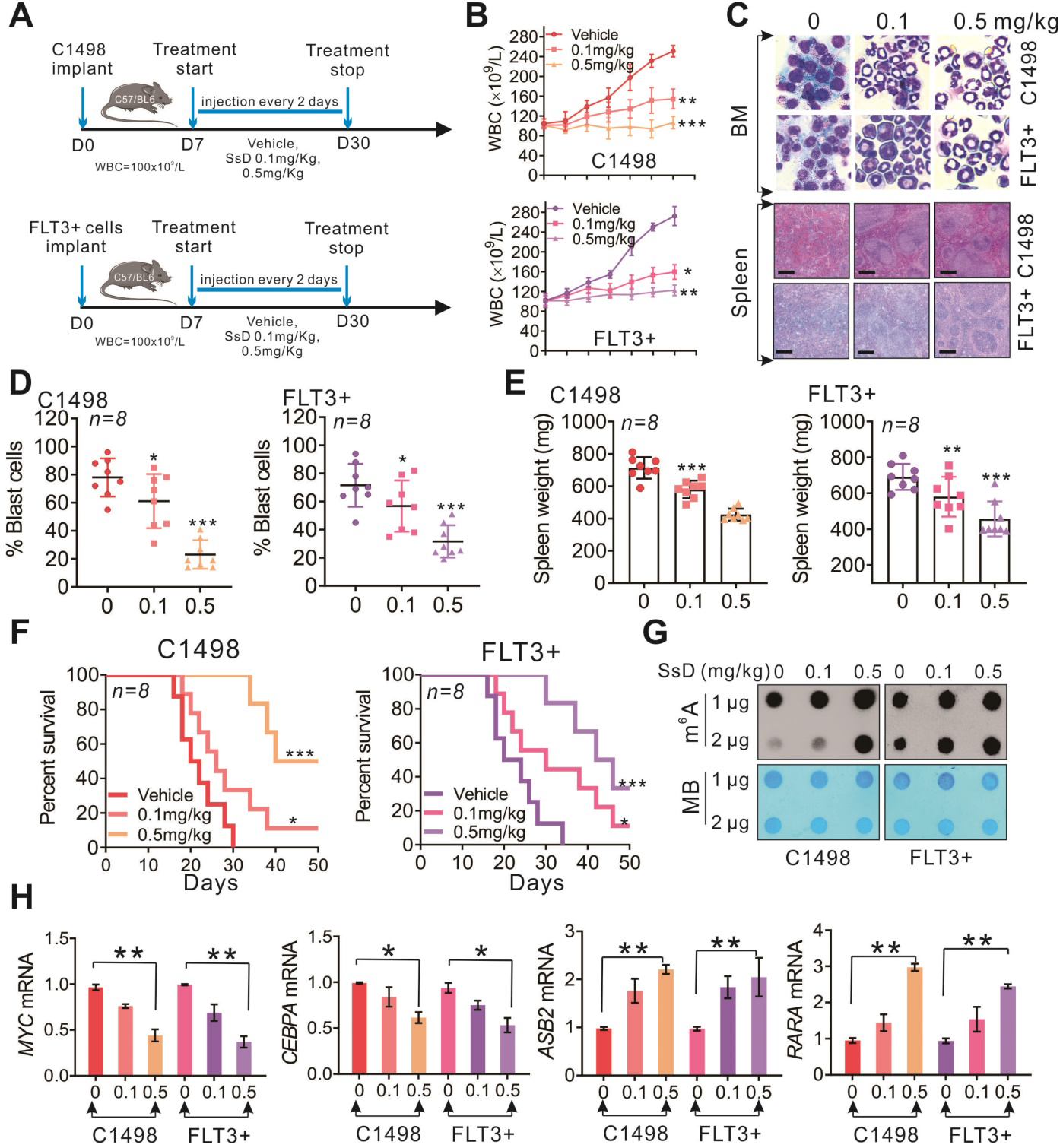
为了研究SsD在体内对白血病的治疗效果,我们建立了C1498和FLT3+白血病小鼠模型(图5A)。对照组小鼠的白细胞生长较快。0.1 mg/kg或0.5 mg/kg剂量的SsD显著抑制WBC生长(图5B)。与对WBC的抑制作用一致,SsD也有效地损害了骨髓(BM)克隆原性潜能(图5C和5D)。此外,与对照组相比,接受SsD治疗组的小鼠的脾脏更轻,表明SsD处理显著逆转了脾肿大,抑制了脾脏转移性肿瘤细胞(图5C和5E)。与病理表型一致,SsD处理小鼠的生存时间也明显延长(图5F)。机制上,SsD在体内的抗白血病作用是通过其m6A RNA甲基化活性介导的(图5G);因为SsD处理小鼠的BM增加了m6A RNA甲基化,从而调节靶基因(图5H)。
6)SsD抑制患者原代细胞
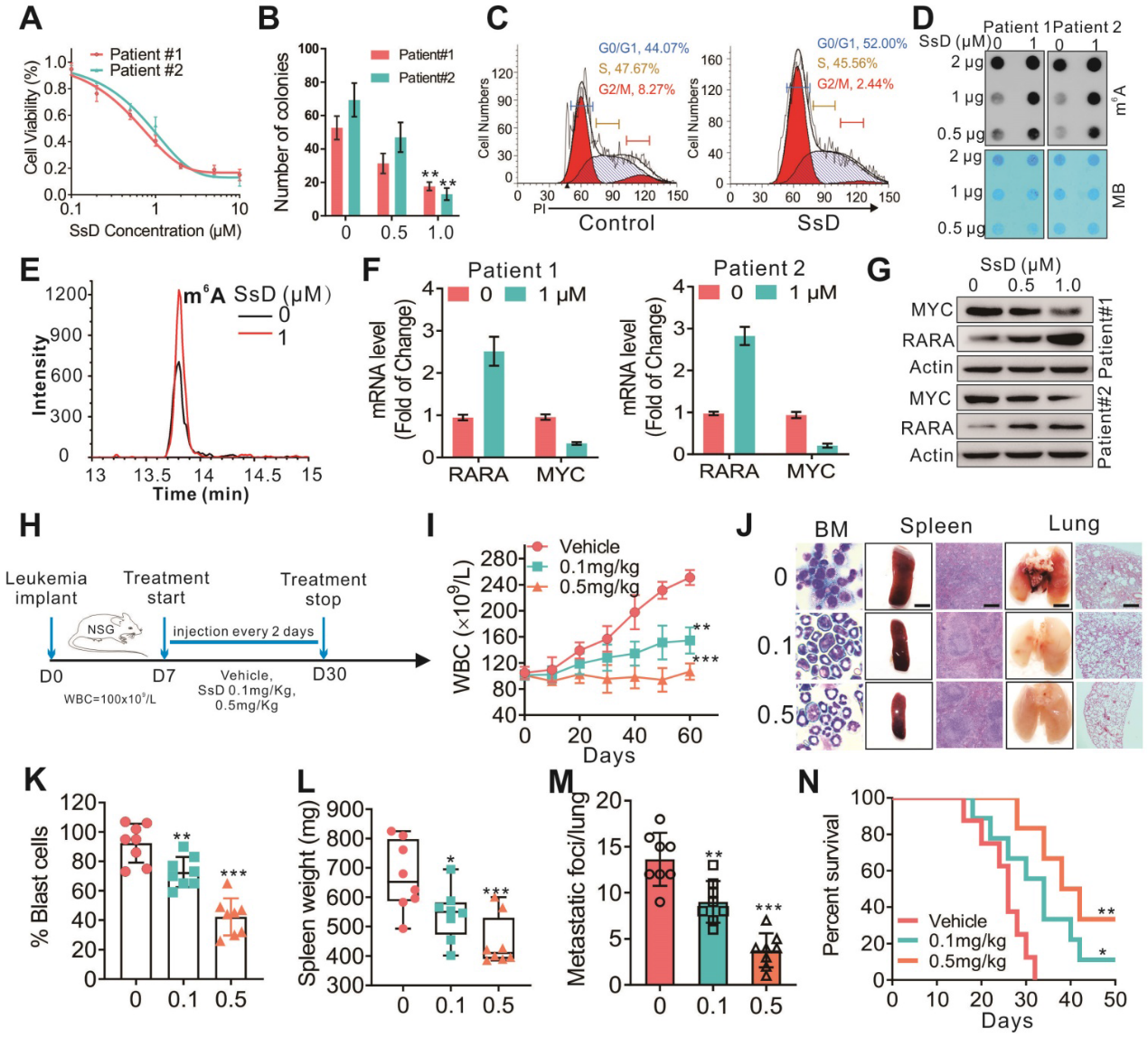
我们从吉林大学第一医院肿瘤组织/生物标本库获取AML患者外周血,进一步评估SsD对白血病进展的影响。SsD显著抑制了白血病细胞增殖(图6A)、集落形成能力(图6B)、诱导细胞周期阻滞(图6C)。在机制上,这是由FTO介导的m6A RNA甲基化及其在SsD处理的原代细胞中的靶点调控的(图6D-G)。当我们使用“人-鼠”异种移植白血病模型来评估SsD在体内对白血病进展的影响时(图6H),与上述类似,使用SsD治疗显著抑制AML进展,包括降低WBC,减少BM中的白血病母细胞,减少脾肿大,抑制肺转移,延长AML原代细胞异种移植小鼠的存活时间(图6I-N)。因此,这些体内研究结果表明SsD具有治疗FTO介导的AML的潜力。
7)SsD克服了m6A介导的白血病对酪氨酸激酶抑制剂的耐药性
由于FTO抑制使耐药细胞对酪氨酸激酶抑制剂(TKI)治疗敏感,我们检测了SsD对TKI耐药细胞的疗效。我们发现SsD联合尼洛替尼或PKC412在降低细胞活力方面更有效(图7A),这表明SsD显著抑制了Kas-1NR和MV4-11PR细胞的增殖。细胞的分子特征也显示TKIS介导的m6A低甲基化被挽救(图7B-C)。虽然SsD没有改变Kas-1NR和MV4-11PR细胞中ALKBH5、METTL3、YTHDF2的蛋白水平(图7D),但TKI上调的m6A相关基因MerTK、BCL-2和STAT3的表达受损(图7E)。与上述结果一致,MerTK、BCL-2和STAT3在TKI耐药细胞的mRNA和蛋白水平上更稳定。然而,SsD治疗降低了MerTK和BCL-2转录本的稳定性,这随后导致了它们的翻译降低(图7F和7G)。基因特异性m6A qPCR证实MerTK、BCL-2和STAT3的RNA或蛋白水平的变化是由m6A介导的mRNA稳定性引起的。为了在体内检测这些效应,我们将Kas-1尼洛替尼耐药细胞移植给裸鼠。细胞接种后,为了保持耐药表型,我们继续每周两次腹腔注射尼洛替尼,直到肿瘤体积接近100mm3。然后,随机分组给予次优剂量的SsD (图7H)。SsD本身略微减缓了耐药肿瘤的生长(图7I和7J)。在机制上,我们观察到mRNA m6A甲基化的总体增加(图7K)。

结论:我们的研究揭示了FTO/m6A修饰信号之间之前未被认识到的联系,并阐明了SsD在AML中的功能。该研究可能为靶向FTO/m6A的表转录组提供一个有前途的策略,并突出柴胡皂甙治疗白血病的临床潜力。






