FOXO3A诱导的LINC00926抑制乳腺肿瘤的生长和转移

磷酸甘油酸激酶1 (PGK1)是糖酵解途径的重要组成部分,与多种癌症的发生发展有关。然而,PGK1抑制剂在癌细胞中的抑制机制和生理意义尚不清楚。因此,今天给大家介绍于2021年4月发表于“Molecular Therapy”(IF=8.986)的文章“FOXO3A-induced LINC00926 suppresses breast tumor growth and metastasis through inhibition of PGK1-mediated Warburg effect”。在这里,我们鉴定了一个负调控PGK1表达的lncRNA LINC00926,并预测乳腺癌良好的临床预后。我们的研究建立了FOXO3A/LINC00926/PGK1作为调节乳腺癌生长和进展的关键轴。靶向PGK1或补充LINC00926或FOXO3A可能是乳腺癌的潜在治疗策略。
技术路线
结果
1)LINC00926被筛选为PGK1负调控的lncRNA,与乳腺癌临床结果相关
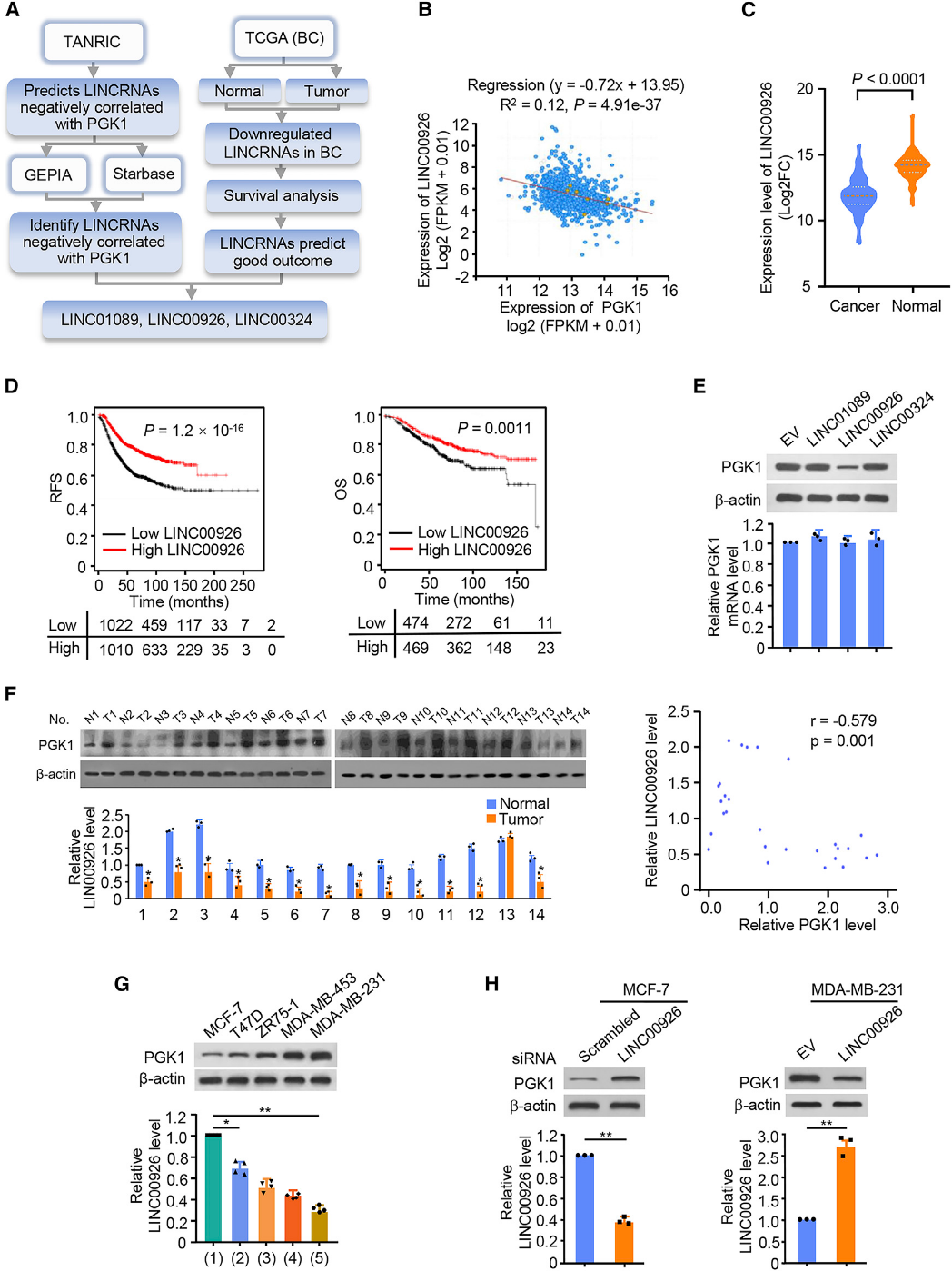
为了探索负调控PGK1的lncRNAs,我们根据图1A所示的筛选策略对乳腺癌的三个数据库进行了分析。我们鉴定了3个lncRNA,LINC00926,LINC01089和LINC00324与PGK1呈负相关,且表现出良好的临床结果(图1B-1D)。为了研究鉴定出的lncRNAs是否下调了PGK1的表达,我们分别用这三个lncRNAs分别转染了乳腺癌细胞。我们的结果表明,在mRNA水平不变的情况下,只有LINC00926导致MCF-7和MDA-MB-231细胞中PGK1蛋白水平显著下降(图1E),表明LINC00926下调了乳腺癌细胞中PGK1的表达。此外,与非肿瘤组相比,13/14(92.9%)例乳腺癌患者的LINC00926表达降低,12/14(85.7%)例乳腺癌患者的PGK1表达上调。在乳腺癌样本中,LINC00926的表达与PGK1的表达呈负相关(图1 F)。有趣的是,我们发现内源性PGK1蛋白水平和LINC00926水平在5种乳腺癌细胞系(MCF-7、T47D、ZR75-1、MDA-MB-453、MDA-MB-231)中均呈负表达。在相对转移性细胞系MDA-MB-231中PGK1表达量最高,LINC00926表达量最低;而恶性程度较低的细胞系MCF-7中PGK1表达量较低,LINC00926表达量较高(图1G)。敲除LINC00926后,MCF-7细胞中PGK1的表达显著增加,而过表达LINC00926后,MDA-MB-231细胞中PGK1的表达显著降低(图1H)。这些结果表明,LINC00926下调PGK1的表达,可能与PGK1介导的乳腺癌发展呈负相关。
2)LINC00926通过抑制乳腺癌细胞中PGK1的表达来抑制增殖、迁移和侵袭
为了研究LINC00926在乳腺癌细胞中的生物学功能,我们用LINC00926感染细胞,对其进行细胞生长、迁移和侵袭分析。细胞增殖和集落形成实验显示,过表达LINC00926可降低MDA-MB-231和MCF-7细胞的增殖(图2A和2B)。在LINC00926转染的细胞系中,PGK1的表达可逆转上述作用。过表达LINC00926也显示出迁移和侵袭能力下降(图2C和2D)。同样,PGK1在LINC00926转染的细胞中重新表达逆转了这些作用。此外,敲除PGK1还可以抑制LINC00926调控乳腺癌细胞增殖、迁移和侵袭的能力(图2E-2H),表示LINC00926通过抑制PGK1的表达来抑制乳腺癌细胞的增殖、迁移和侵袭。

3)LINC00926通过抑制乳腺癌细胞中PGK1的表达来抑制糖酵解
由于PGK1是一种关键的糖酵解酶,而LINC00926被鉴定为负调控PGK1的lncRNA,我们想知道需氧糖酵解是否在LINC00926介导的乳腺癌细胞增殖抑制中发挥作用。我们测试了LINC00926对葡萄糖摄取、乳酸生成和ATP生成的调节作用。结果表明,LINC00926降低了葡萄糖摄取、乳酸生成和ATP生成(图3A)。在LINC00926转染的细胞中,PGK1的表达逆转了这些作用。LINC00926还显示出细胞外酸化率下降(图3B和3C)。PGK1在LINC00926转染的细胞中重新表达挽救了这些效果。在PGK1敲低的MDA-MB-231或MCF-7细胞中敲低LINC00926对糖酵解表型没有影响(图3D-3F),表明LINC00926通过PGK1抑制糖酵解表型。综上所述,LINC00926通过抑制乳腺癌细胞中PGK1的表达来抑制糖酵解。

4)LINC00926通过增强STUB1介导的泛素-蛋白酶体途径调节PGK1蛋白的稳定性
亚细胞定位结果显示,LINC00926主要定位于细胞质,FISH实验进一步证实了这一点(图4A和4B)。结合LINC00926没有改变PGK1 mRNA水平的事实,我们推测LINC00926在转录后水平下调了PGK1的表达。事实上,蛋白酶体抑制剂MG132的加入阻断了LINC00926过表达介导的PGK1降解,这表明泛素-蛋白酶体途径参与了LINC00926对PGK1蛋白稳定性的调节(图4C)。LINC00926过表达增加PGK1泛素化(图4D)。下调LINC00926基因后,PGK1蛋白水平升高,泛素化水平降低(图4E)。为了寻找负责LINC00926调控PGK1蛋白稳定性的E3泛素连接酶STUB1,我们接下来通过RNA下拉实验确定了LINC00926在乳腺癌细胞中的蛋白伴侣。质谱分析结果显示了特异性差异表达谱带。我们鉴定出了几个可能与LINC00926相互作用的蛋白,包括两个E3连接酶,STUB1和E6AP(图4F)。免疫印迹进一步证实,只有STUB1与LINC00926相互作用,而E6AP则没有(图4G)。此外,RIP分析也表明,PGK1和STUB1免疫沉淀中,LINC00926显著富集(图4H)。此外,LINC00926增强了STUB1介导的PGK1泛素化(图4I)。敲低STUB1大大减弱了LINC00926对PGK1泛素化的影响(图4J)。这些数据表明,STUB1在LINC00926调控PGK1泛素化过程中起着关键作用。与LINC00926对STUB1介导的PGK1泛素化的影响一致,LINC00926增加了STUB1和PGK1之间的相互作用(图4K)。而敲低STUB1大大减弱了LINC00926对PGK1降解的影响(图4L)。

5)缺氧主要通过FOXO3A转录抑制LINC00926的表达,激活PGK1的表达
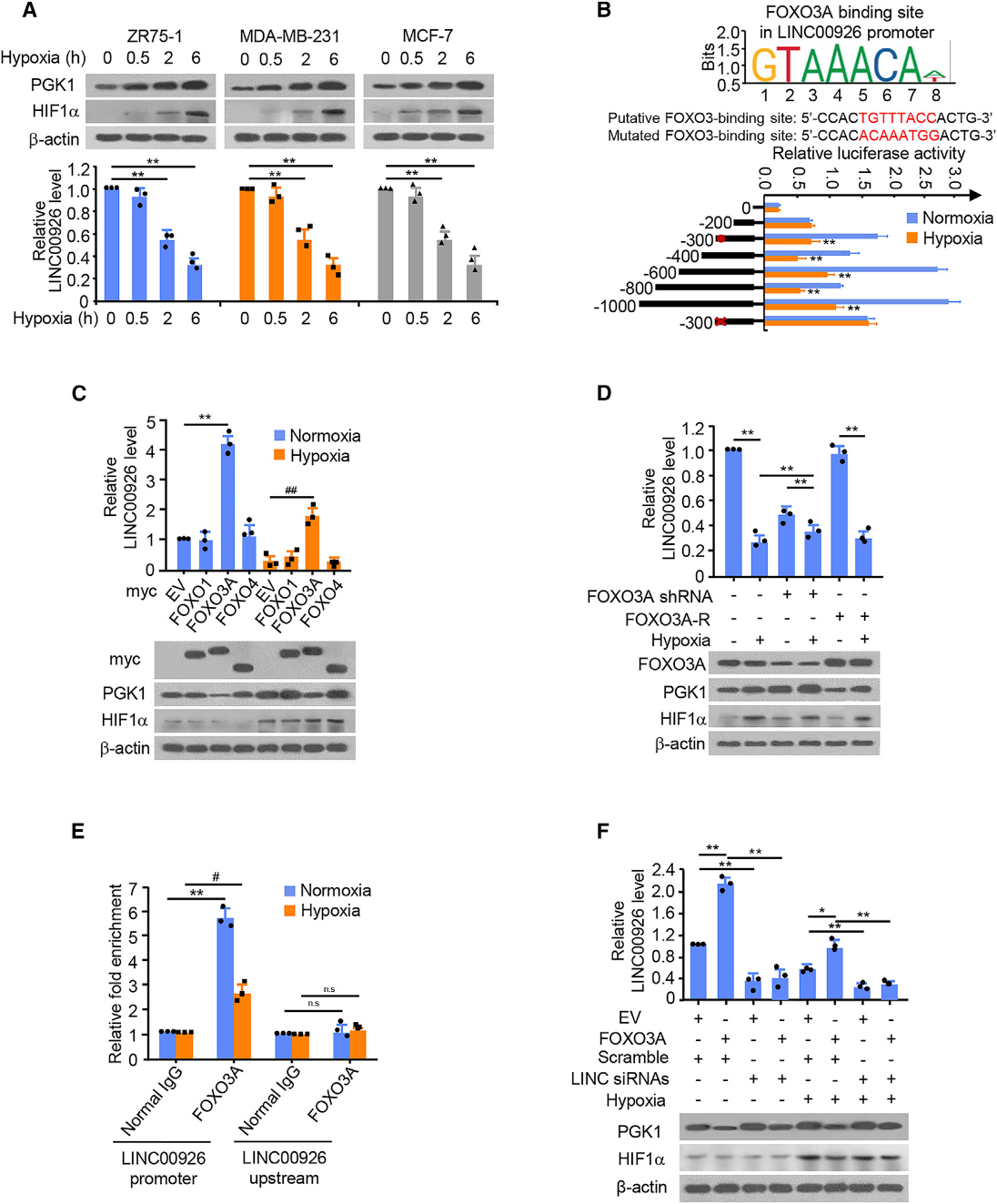
由于缺氧是癌症的一个关键现象,我们确定了LINC00926/PGK1轴是否在缺氧下糖酵解的调节中发挥作用。缺氧刺激了PGK1在mRNA和蛋白水平上的表达,并降低了LINC00926的表达(图5A)。为了确定缺氧如何抑制乳腺癌细胞中LINC00926的表达,我们研究了缺氧后对LINC00926启动子的抑制。对不同的LINC00926启动子缺失报告基因的分析显示,启动子区域在300 - 200 bp之间包含一个缺氧抑制元件(图5B)。该区域假定的FOXO3A结合位点的突变会导致抑制的丧失。在常氧或缺氧条件下,FOXO3A影响LINC00926和PGK1的表达,说明FOXO3A是LINC00926调控的特异性转录因子(图5C和5D)。ChIP分析表明,在常氧条件下,FOXO3A被募集到LINC00926启动子内包含FOXO3A结合位点的区域,但没有被募集到LINC00926启动子上游的区域,在缺氧条件下募集减少(图5E)。FOXO3A提高了LINC00926水平,降低了PGK1水平,而且重要的是,在正常或缺氧条件下,下调LINC00926均严重损害了FOXO3A调节LINC00926和PGK1表达的能力(图5F)。此外,敲除LINC00926还大大削弱了缺氧对PGK1上调的影响。这些数据表明,缺氧主要通过FOXO3A转录抑制LINC00926的表达,激活PGK1的表达。
6)FOXO3A通过调控乳腺癌细胞中LINC00926的表达抑制增殖、迁移和侵袭,抑制糖酵解
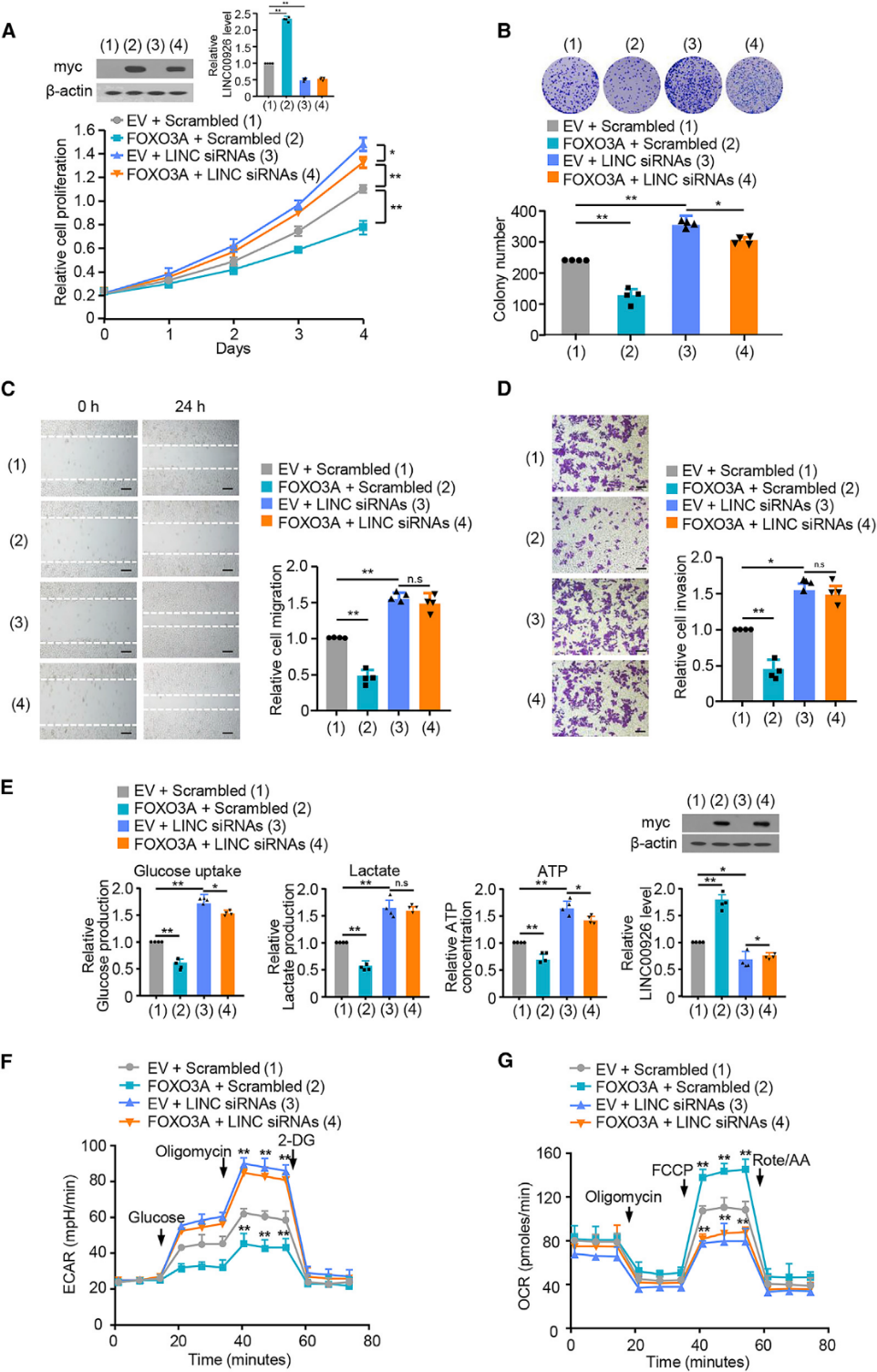
我们研究了FOXO3A是否通过LINC00926调节这些效应。细胞增殖和集落形成分析显示FOXO3A过表达抑制了乳腺癌细胞的生长,而LINC00926敲低则促进了细胞的生长(图6A和6B)。重要的是,下调LINC00926显著减弱了FOXO3A调控细胞增殖的能力,表明FOXO3A主要通过表达LINC00926来降低乳腺癌细胞的增殖。接下来,我们通过LINC00926检测FOXO3A是否抑制细胞迁移、侵袭和糖酵解。如预期,FOXO3A减少了乳腺癌细胞的迁移和侵袭(图6C和6D)。敲除LINC00926大大削弱了FOXO3A抑制细胞迁移和侵袭的能力。FOXO3A过表达抑制葡萄糖摄取、乳酸生成和ATP生成,降低ECAR和增加OCR。然而,敲除LINC00926极大地减弱了FOXO3A调节细胞迁移、侵袭和糖酵解的能力(图6C-6G)。综上所述,FOXO3A抑制乳腺癌细胞的迁移和侵袭,以及糖酵解主要依赖于LINC00926。
7)FOXO3A/LINC00926/PGK1轴调节乳腺癌肿瘤生长和肺转移
为了证实FOXO3A/LINC00926/PGK1通路的体内表型,我们首先通过将MDA-MB-231细胞注射到BALB/c小鼠的乳腺脂肪垫上,研究了LINC00926/PGK1轴对乳腺癌生长的影响。与预期的一样,下调LINC00926显著增加了乳腺肿瘤的生长。相反,当PGK1被敲除时,肿瘤生长被抑制。更重要的是,当PGK1被敲除时,LINC00926敲除对肿瘤生长的影响显著减弱(图7A-7C)。接下来,我们研究了FOXO3A/LINC00926轴对乳腺癌生长的影响。结果显示FOXO3A过表达显著降低了乳腺癌的生长。当LINC00926敲低时,肿瘤生长增加,FOXO3A过表达对肿瘤生长的影响显著减弱(图7D-7F)。接下来,我们研究了该途径对乳腺癌转移的影响。与对照组相比,LINC00926基因抑制组在整个肺区域扩散的结节数量明显增加(图7G)。相反,PGK1基因敲低导致乳腺癌细胞向肺转移扩散的减少。然而,PGK1下调极大地减弱了下调LINC00926调节肺转移的能力(图7G)。与肿瘤生长实验结果一致,下调LINC00926显著减弱了FOXO3A调控肺转移的能力(图7H)。

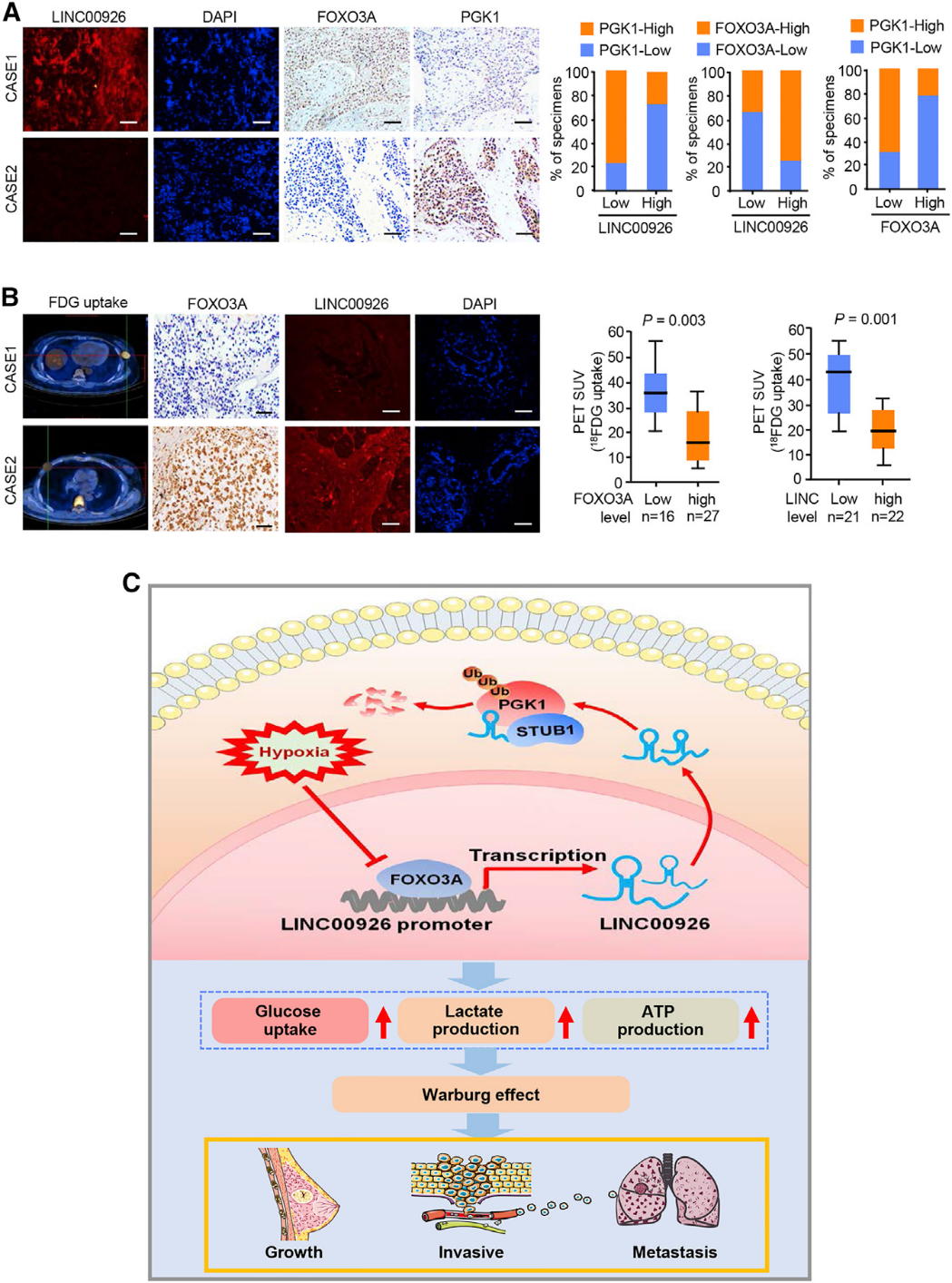
8)人类乳腺癌患者中LINC00926和PGK1表达的相关性及LINC00926与葡萄糖摄取的相关性
我们通过IHC和FISH检测109例人乳腺癌样本中PGK1和LINC00926的表达情况。与培养细胞中LINC00926抑制PGK1的结果一致,LINC00926的表达与PGK1的表达呈负相关,与FOXO3A呈正相关(图8A)。通过18FDG PET扫描评估葡萄糖摄取增加的乳腺肿瘤患者显示LINC00926和FOXO3A表达降低,而PGK1表达增加(图8B)。综上所述,这些数据表明了LINC00926/PGK1轴在乳腺癌中的重要病理作用。
结论
我们的研究首次证实了LINC00926通过抑制糖酵解关键酶PGK1的表达来抑制糖酵解,从而在体内外抑制乳腺癌细胞的增殖、侵袭和转移。在乳腺癌患者中,FOXO3A调控的LINC00926与PGK1表达呈负相关。这些发现概述了FOXO3A/LINC00926/PGK1轴在Warburg效应和乳腺肿瘤发生进展中的重要性。因此,上调LINC00926可能是治疗PGK1过表达的乳腺癌患者的一种有前途的方法。






