巨噬细胞表型协调急性胰腺炎损伤后的炎症和修复再生
急性胰腺炎 (AP) 是最常见的炎症性胃肠道疾病之一,在小鼠和人类模型中似乎通过外分泌腺泡细胞的再生而恢复。巨噬细胞是由组织损伤引发的炎症和组织再生反应的重要驱动因素,包括感染、自身免疫性疾病、机械或毒性损伤以及其他原因。在组织损伤时,骨髓 (BM) 衍生的巨噬细胞和/或组织驻留巨噬细胞被激活并以促炎方式响应局部环境,然后迅速转变为伤口修复表型。巨噬细胞的表型和作用已在急性和慢性胰腺炎中得到充分证明。然而,关于巨噬细胞如何调节损伤后的胰腺修复/再生,包括 ADM 和腺泡再分化,我们知之甚少。
今天讲一篇关于巨噬细胞表型变化与AP炎症相关的文章,该文章题名为:Macrophage phenotypic switch orchestrates the inflammation and repair/regeneration following acute pancreatitis injury,IF=5.737,一区杂志。
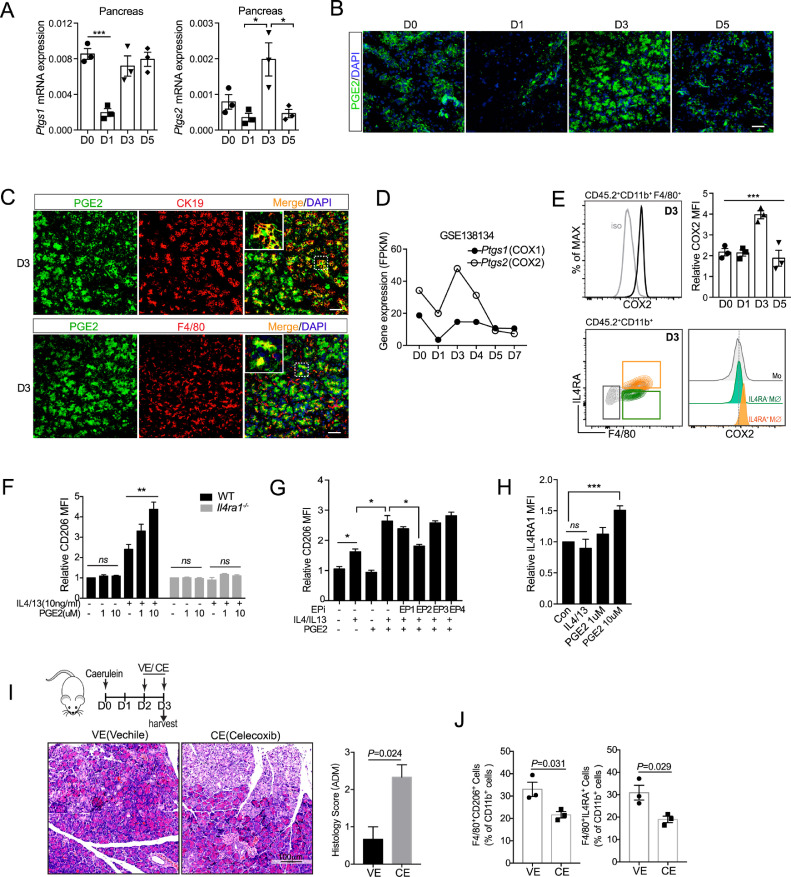
AP损伤后胰腺巨噬细胞的表型变化
A动物模型使用雨蛙素诱导,。为了研究AP后的修复/再生过程,用更高剂量的雨蛙素(100μg/kg,每小时10次)诱导 AP,并在一周内的不同时间点收集胰腺。接受雨蛙素诱导治疗的AP小鼠在24小时后显示出腺泡坏死和白细胞浸润的组织学迹象以及血清淀粉酶升高。第3天出现典型的腺泡-导管化生 (ADM) 结构,第7天左右迅速恢复正常腺泡。
为了检测免疫细胞的比例,分离并分析了 AP 诱导后的胰腺白细胞。发炎的胰腺内最丰富的免疫细胞是巨噬细胞(CD11b+F4/80+CD11c-)。流式细胞术分析的胰腺巨噬细胞数量在第1天和第3天显着增加。根据 F4/80 水平,胰腺巨噬细胞从第 1 天到第 3 天逐渐成熟。巨噬细胞在组织中的积累以两种方式发生:单核细胞的募集和驻留巨噬细胞的增殖。AP 急性炎症期的大多数巨噬细胞来自单核细胞的浸润。根据我们的研究结果,与第 1 天相比,第 3 天的胰腺巨噬细胞具有更高的增殖能力。这可能部分解释了第 3 天巨噬细胞的增加。此外,流式细胞术数据显示 M2 样巨噬细胞 (CD206 + IL4RA + )的百分比在第 1 天(急性炎症期)下降并从第 3 天开始增加(ADM 阶段),而这些 M2 样巨噬细胞的数量在第 3 天达到峰值,然后迅速减少。此外,流式细胞术数据与免疫荧光分析一致,其中 F4/80 + CD206 +细胞在第 3 天最丰富。
接下来,我们想知道这些 CCR2 +单核细胞/巨噬细胞是否可以在胰腺损伤后重新编程为 M2 样巨噬细胞。在植入和诱导 AP 8 周后,我们发现第 3 天的增殖巨噬细胞 (Ki67 + ) 主要来自 CCR2 WT小鼠。与来自 CCR2 KO小鼠的巨噬细胞相比,来自 CCR2 WT小鼠的巨噬细胞表现出更高的 CD206 和 IL4RA 表达水平。综上所述,结果表明,ADM 阶段的 M2 样巨噬细胞主要来源于 CCR2 +单核细胞/巨噬细胞,这些细胞在 AP 早期募集。
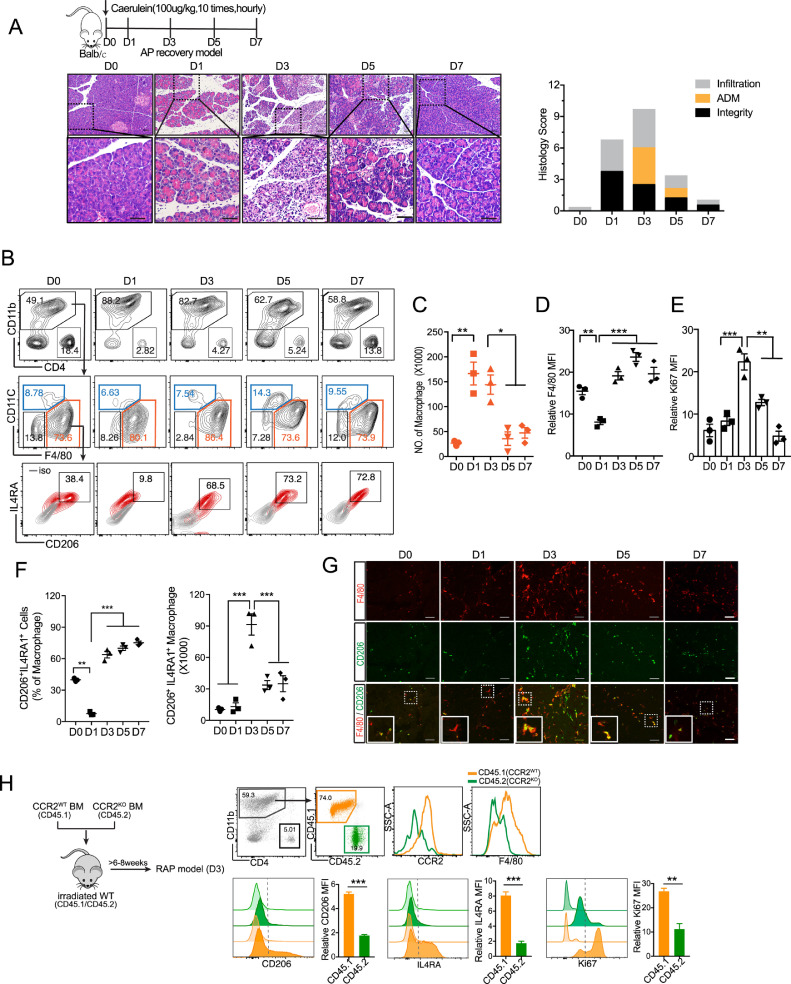
巨噬细胞在 AP 恢复不同阶段的不同作用
鉴于 AP 恢复过程中巨噬细胞的表型变化,接下来试图通过用脂质体清除巨噬细胞来检查巨噬细胞在不同修复/再生阶段的作用。首先,我们在急性炎症反应后(从第 1 天到第 2 天)立即消耗了胰腺巨噬细胞,并在第 3 天检查了胰腺。如图所示,第 3 天之前巨噬细胞的消耗可以在很大程度上减少导管样结构,这表明巨噬细胞在ADM的形成。AP 损伤后第 3天巨噬细胞的消耗显着延迟了胰腺修复。Ki67 +细胞在第3天达到峰值,并随着胰腺恢复逐渐下降。与组织学结果一致,发现CN处理组的Ki67 +细胞从第 5 天到第 7 天大幅下降,但在 CL 处理组中没有,表明 CL 处理小鼠的修复过程受损。
此外,流式细胞仪分析证实,第 7 天胰腺中CD11b + F4/80 + CD206 +巨噬细胞显着减少,这与免疫荧光数据一致。在总 CD11b +单核细胞/巨噬细胞中,成熟巨噬细胞 (F4/80 + MHCII hi ) 减少,而未成熟巨噬细胞 (F4/80 mid MHCII - ) 在第 7 天增加,此时胰腺巨噬细胞在 ADM 阶段(第 3 天)短暂消耗。F4/80 mid MHCII -巨噬细胞表达更高水平的 CCR2 和 TNFα,表明它们与炎症单核细胞(CD11b + Ly6C hi CCR2 +)分化并可能导致组织损伤。上述结果表明,ADM期胰腺巨噬细胞的耗竭(以M2样表型为主),将触发炎性单核细胞再次流入胰腺,从而在第7天造成组织损伤。
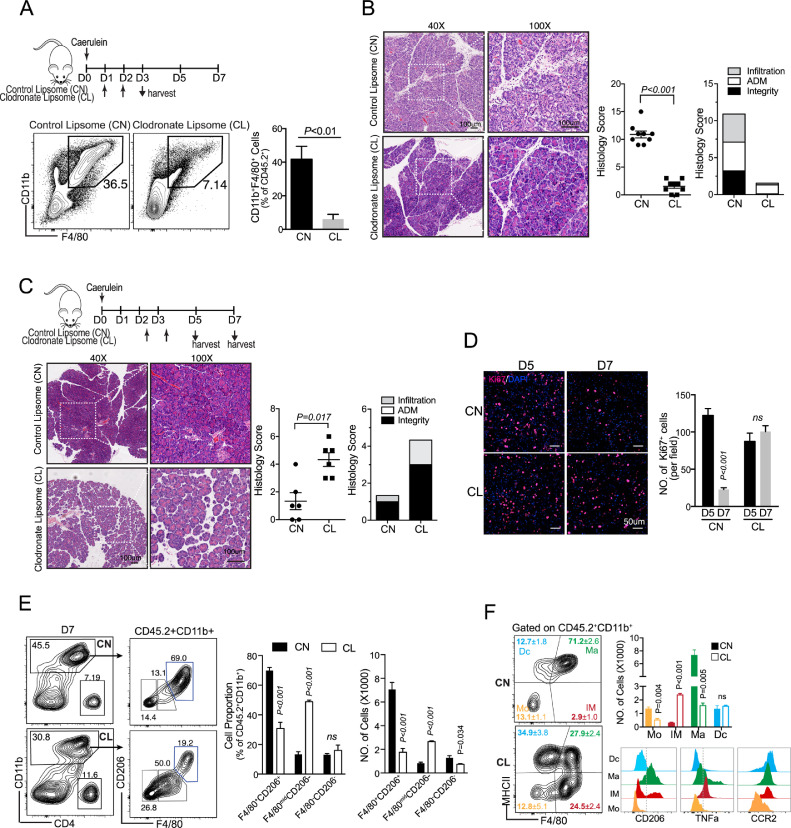
再生胰腺中胰腺巨噬细胞的动态转录组谱
为了进一步了解 AP 恢复过程中巨噬细胞的表型和功能,分离出胰腺巨噬细胞用于 RNA-seq 分析。显着性差异表达基因绘制热图。为了评估这些基因簇的功能,使用网络工具 DAVID Gene Ontology (GO) 进行了功能注释分析。值得注意的是,在急性炎症期(簇32,D1 特征簇)高度表达的基因特别富集炎症反应和 CCR2 依赖性趋化性。簇 25 和 27 包含在 ADM 阶段(第 3 天)高表达的基因,具有不同的表达模式和功能,表明该阶段的巨噬细胞异质性。例如,与ECM-受体相互作用和PI3K-AKT信号通路相关的基因在簇27中富集,而与细胞周期相关的基因在簇25中富集。

巨噬细胞中 PI3K-AKT 激活促进 ADM 期后炎症消退
基于 RNA-seq 数据,PI3K-AKT 信号在 ADM 期间在巨噬细胞中显着富集。当观察PI3K-AKT 通路中这些升高的基因时,发现80%的基因与细胞外基质 (ECM)-受体相互作用、生长因子/细胞因子-受体相互作用有关,表明它们参与了巨噬细胞与相邻细胞之间的串扰。同时,在第 3 天在 CD11b + F4/80 + CD206 +胰腺巨噬细胞中观察到更高的 AKT 激活。在ADM 阶段抑制巨噬细胞的 PI3K-AKT 激活时,胰腺修复/再生明显受到阻碍。通过流式细胞术分析,我们发现胰腺中 M2 样巨噬细胞(CD11b + F4/80 + CD206 +)的数量变化较小,而未成熟巨噬细胞(CD11b + F4/80 mid)、炎性单核细胞(CD11b + Ly6C hi ) 和中性粒细胞 (CD11b + Ly6G + ) 显着升高。总之,阻断胰腺巨噬细胞中的 PI3K-AKT 信号将触发促炎反应和组织损伤,表明这些巨噬细胞在 ADM 阶段(第 3 天)具有抗炎或促消退表型。
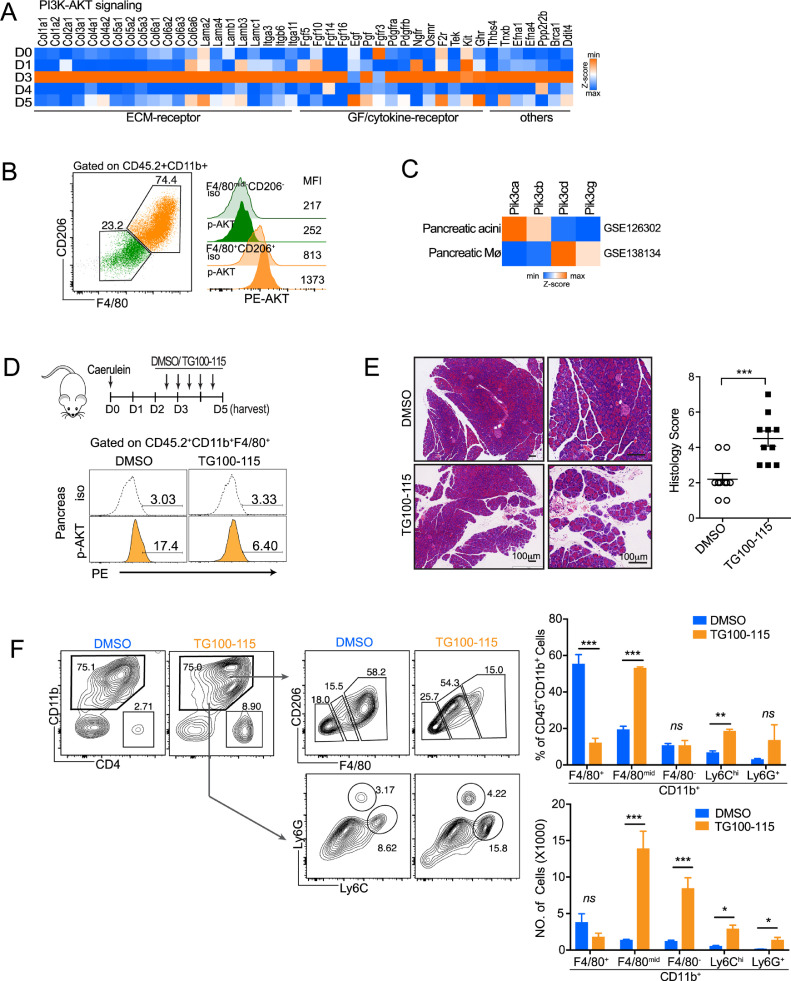
Il4ra缺陷小鼠的M2 样巨噬细胞减少和再生失调
为了探索再生过程中胰腺巨噬细胞的调节机制,我们进行了基因集富集分析 (GSEA) 以比较第 3 天和第 1 天巨噬细胞的转录组谱。巨噬细胞的 M2 激活和 IL4 刺激特征从第 3 天开始富含巨噬细胞。我们发现,表达IL-4和IL-13分别提高在第1天,和表达Il4ra自第1天升高,达到峰值在第3天。为了进一步确定受体和配体的细胞来源,在 AP 损伤后一天从胰腺中分离并比较了 CD45.2 +和 CD45.2 -细胞,有趣的是,Il4ra1被显性免疫细胞上表达(CD45.2 +),而IL4和IL13中主要表达于实质细胞(CD45.2 - )。此外,通过使用Il4ra 缺陷小鼠,我们证明了 IL4Rα 信号在 AP 损伤后胰腺修复/再生过程中介导了 M2 巨噬细胞的极化。值得注意的是,与它们的对应物相比,来自Il4ra -/-小鼠的胰腺在第 3 天和第 5 天具有更多的 ADM 结构。总的来说,这些发现表明 IL4/IL4Rα 轴是 AP 恢复过程中胰腺巨噬细胞 M2 极化所必需的,发挥抗炎功能来控制 ADM 形成的程度。

PGE2 增强 IL4Rα 信号以增强巨噬细胞的 M2 激活
巨噬细胞能够响应可变的局部微环境信号从一种功能表型切换到另一种功能表型。除了经典的信号级联(例如,IL4/IL4Rα),巨噬细胞还可以整合由细胞外刺激触发的代谢线索,以激活它们的 M2表型。在这里,我们想知道 PGE2 是否也参与了 AP 损伤后胰腺巨噬细胞的 M2 极化。为此,我们首先检查了 AP 损伤后 PGE2 的动态表达。COX1 和 COX2 是产生前列腺素的两种关键酶。在这里我们发现Ptgs2 (COX2)的表达在第 3 天达到峰值,而Ptgs1 (COX1)的表达在第 1 天下降并在第 3 天回到基础水平。一致地,免疫荧光分析显示 PGE2 在第 3 天升高,并在第 5 天迅速恢复到基础水平。值得注意的是,PGE2在第 3 天主要与导管样细胞(CK19 +细胞)共表达,以及部分与巨噬细胞(F4/80 +细胞)共表达。此外,根据我们的 RNA-seq 数据和流式细胞术分析,我们发现巨噬细胞中 COX2 的表达也在第 3 天达到峰值。更有趣的是,与 IL4Rα -巨噬细胞和单核细胞相比,IL4Rα +巨噬细胞表达了更高水平的 COX2。
为了研究 PGE2 是否有助于 M2 活化,来自野生型 (WT) 和Il4ra -/-小鼠的BM 衍生巨噬细胞 (BMDM)在体外与 PGE2 一起经受 IL4/IL13。PGE2 单独不影响 M2 激活,但大大增强了 IL4/IL13 触发的 M2 激活。更有趣的是,IL4/IL13 促进了巨噬细胞中ptgs2 的表达,在 PGE2 的存在下可以进一步升高。PGE2 通过与称为 E-前列腺素 (EP) 1-4 受体的 4 种不同 G 偶联受体结合而发挥作用。不同受体的亚型决定了不同细胞类型的特定生理反应。通过使用特定的 EP 抑制剂,我们确定 PGE2 促进 M2 极化主要由 EP2 受体介导。此外,PGE2 可以促进 IL4Rα 表达,从而增强 IL4/IL4Rα 信号传导。在 ADM 阶段(第 2 天)之前抑制 PGE2 合成在很大程度上降低了 M2 激活并在第 3 天增加了胰腺中的 ADM 结构。总之,这些结果表明导管样细胞和胰腺巨噬细胞在第 3 天释放的 PGE2 增强了 M2 活化,并限制了再生胰腺中 ADM 的形成。