染色质定向蛋白质组学鉴定的前列腺癌细胞内源性雄激素受体网络

雄激素和雄激素受体(AR)是激素激活转录因子(TF),是驱动前列腺癌(PCa)发生发展的关键因素。因此AR是晚期PCa激素治疗的主要分子靶点。雄激素剥夺疗法,特别是第二代抗雄激素和雄激素合成抑制剂最初是有效的。然而,由于患者仍然可以从晚期PCa进展到致命性去势抗性前列腺癌(CRPC),需要新的治疗靶点和生物标志物。靶蛋白的一个来源可能是ar相关的染色质蛋白。
大多数目前已知的核受体(NR)相互作用蛋白,包括那些AR,已经通过遗传筛选,如双杂交系统,免疫共沉淀和基于肽段的体外方法。尽管亲和纯化-质谱耦合(MS)已经启发了NRs的辅助调节器,但它很少在代表NRs自然环境的条件下进行。然而,通过利用RIME(内源性蛋白快速免疫沉淀MS), Paltoglou等人和Stelloo等人已经从PCa细胞交联染色质中鉴定了几种内源性AR相关蛋白。
核心调节因子通常作为蛋白质复合物中的亚基存在,并以多种方式参与转录调控,例如通过调节组蛋白修饰和染色质结构。哺乳动物BRG1-或brm相关的染色质重塑复合物(BAF, SWI/SNF)改变了癌细胞染色质可及性景观。该复合物是细胞周期和增殖的关键调控因子,也是前列腺癌的驱动因子,具有多种癌症特异性作用。此外,频繁发生的TMPRSS2-ERG融合基因易位可使BAF复合物重新靶向于染色质,促进前列腺癌的发生。互斥的ATPase亚基BRG1 (SMARCA4)和BRM (SMARCA2)是复杂功能的关键组件。此外,AR与DNA序列特异性转录因子(如FOXA1、GATA2、ERG和HOXB13)之间的合作已经建立。TF FOXA1可以结合到封闭的染色质区域,调节其染色质可及性,从而促进AR结合染色质引发PCa。
2021年6月,在Oncogene杂志上发表了文章“Chromatin-directed proteomics-identified network of endogenous androgen receptor in prostate cancer cells..”。此报道通过运用了一种强大的染色质导向蛋白质组学方法,称为ChIP-SICAP,揭示去势抗性前列腺癌(CRPC)细胞中内源性AR周围染色质蛋白网络(染色质蛋白网络)的组成。在CRPC细胞雄激素信号通路的背景下,进一步研究了与AR相关蛋白作用的染色质重塑者SMARCA4和SIM2。通过整合ChIP-seq、RNA-seq、ATAC-seq和功能实验的数据,揭示SMARCA4和AR在染色质上广泛共存,SMARCA4缺失影响了一组AR靶基因的染色质可及性和表达,也抑制了CRPC细胞的生长,验证了SMARCA4在CRPC细胞中的功能。虽然SIM2的沉默同样降低了染色质的可及性,但它影响了更多的雄激素调节基因的表达。在鸡胚绒膜尿囊膜实验中,SIM2沉默也降低了CRPC细胞的增殖和肿瘤的大小。总之,此研究鉴定的AR染色体是研究这一重要药物靶点的重要资源。
技术路线:

一、CRPC细胞中AR的染色体

散点图显示在VCaP细胞的两个生物重复中由AR ChIP-SICAP鉴定的染色质相关蛋白。在暴露于R1881(合成AR激动剂)中使用差异的silac标记。在190个ChIP-SICAP定量蛋白中,87个形成了r1881诱导的AR染色体,从而发现了可能与受体功能相互作用的蛋白。r1881诱导的AR chromatome被分为不同的功能蛋白组(图1b)。DNA和rna结合蛋白,组蛋白,DNA修复和mRNA加工相关蛋白形成了大部分(~50%)的网络。
二、SMARCA4共占据了大多数ar结合位点,但对其染色质可及性的影响有限
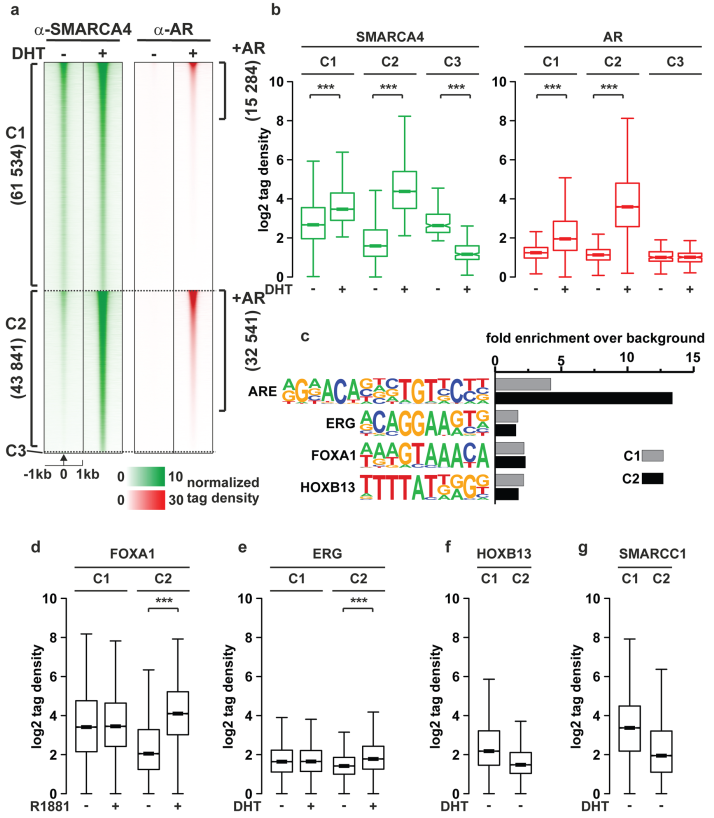
SMARCA4和AR共同占据的位点,以及雄激素如何影响共同占据。SMARCA4(61534)的大多数染色质结合位点没有受到DHT的影响(簇C1,图2a),在C2位点,AR和SMARCA4与结合高度相关。DHT增强了SMARCA4在这些位点的招募(集群C1,图2b)。基序分析显示,与C1位点相比,C2位点具有更高的雄激素响应元件(AREs)富集,进一步支持雄激素诱导的SMARCA4到染色质上的募集。FOXA1、ERG和HOXB13的基序依次在C1和C2位点上同样富集(图2c)。ChIP-seq数据集显示,FOXA1和ERG的结合随着激素暴露在C2位点而增加,而在C1位点则不增加(图2d和e)。然而,HOXB13似乎在C1位点结合更多(图2f)。与SMARCA4类似,SMARCC1[15](在ChIP-SICAP中发现)显示与C1和C2位点相结合(图2g)。
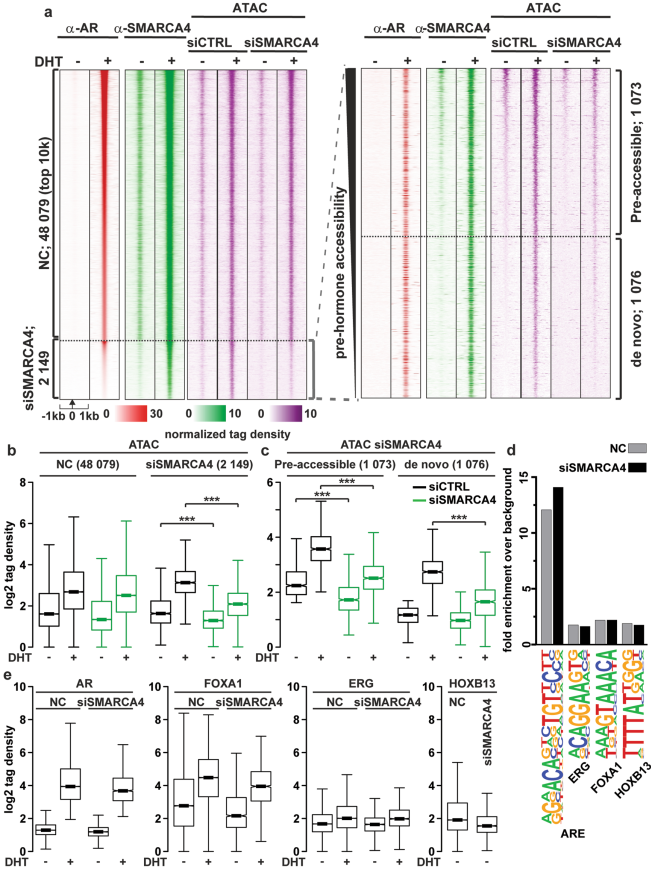
重点分析了ARBs染色质可及性的变化,发现雄激素通常增加了ARBs的可及性(图3a, ATAC, siCTRL)。尽管SBs和ARBs之间有很大的重叠,但SMARCA4删除仅减少了2149个ARBs的染色质可及性。这些sismarca4受影响的位点中有一半是开放的,不管激素暴露与否(pre-accessible),其余的在激素暴露后显示其可及性增加(de novo位点,图3a和c)。被AR招募的SMARCA4增加染色质可及性,潜在地协助其他因素招募到这些位点(图3d,补充表2)。由于雄激素诱导了FOXA1在sismarca4影响位点的结合(图3e), AR诱导的SMARCA4的招募可能有助于雄激素诱导FOXA1的结合。上述结果表明SMARCA4在CRPC细胞染色质景观的调节中既有AR依赖的作用,也有非ARr独立的作用。
三、SMARCA4调节AR靶基因的表达,参与细胞外基质组织和细胞粘附

使用RNA-seq研究了SMARCA4缺失对有DHT和没有DHT的VCaP细胞基因表达的全基因组影响。后一组中,雄激素(A)下调的基因占大多数(~70%),而在前一组中,雄激素(A)下调和上调的基因数量增加大致相等(图4a) 。与具有DHT的siCTRL相比,siSMARCA4有931个差异表达基因(DEGs),其中363个基因雄激素显著调控(图4b, c)。对差异雄激素调节基因集进行metasscape分析。耗尽SMARCA4可增加雄激素应答基因的表达,例如,分支结构的形态发生和参与分化的细胞形态发生,而耗尽SMARCA4可抑制嘌呤代谢和细胞对药物的反应中富集的基因的表达(图4d)。上述结果表明smarca4介导的染色质可及性变化促进了它们的表达。

使用测量细胞一致性的活细胞成像作为细胞生长和扩散的代理,来测试SMARCA4消耗的影响是否转化为VCaP细胞生长的改变。如图5所示,在没有雄激素的情况下,SMARCA4删除并不影响细胞的生长,而在有雄激素的情况下,它降低了细胞的相对融合,尽管程度低于去除AR。SMARCA4删除同样会降低LNCaP细胞的相对融合。
四、SIM2沉默改变了arb亚群的染色质可及性

SIM2沉默降低了2434个arb染色质可及性,三分之二受siSIM2影响的arb在雄激素暴露前可及(图6a c中可获得),而其余在雄激素暴露后可及(图6a c中重新获得)。根据ChIP-SICAP数据,siim2受影响的位点中最富集的motif是ARE,尽管其在这些位点的富集程度低于未受siim2影响的位点(NC位点,图6d)。AR、FOXA1、ERG和HOXB13在sisim2影响的位点的标签密度与NC位点相比均呈上升趋势(图6e),表明SIM2是一种与AR协同的TF。

SIM2是否也影响AR与染色质的结合,我们在SIM2沉默后进行AR ChIP-seq。如图7所示,受体与大多数arb的结合没有改变。然而,SIM2沉默影响2265 ARBs药物通过降低和增加染色质占用大约相同数量的地点(图7 a、b)。当反映这些siSIM2-affected染色质易访问性的变化,有趣的是,减少可访问性是在690年siSIM2-DN ARBs药物(图7 c、e、f),而在siSIM2-UP arb中,染色质可及性的变化不明显(图7c)。其余的(1744)siSIM2位点在AR结合方面没有变化。大多数由SIM2沉默改变的arb并不与FOXA1缺失改变的arb重叠,这得到了基元分析的支持,表明FOXA1基元在siSIM2-DN arb上的富集少于在AR结合没有变化的位点上的富集(图7d)。
五、SIM2对ar介导的基因表达有显著影响

利用RNAseq研究SIM2沉默后SIM2对基因表达的影响。沉默SIM2使dht调控的基因数量增加了一倍多,2394个基因受到雄激素调控,而只有180个基因受到雄激素调控(图8a, b)。此外,沉默SIM2导致6867个deg,其中2937个deg受到雄激素调控(图8c, d, Supplementary Fig. S19f)。SIM2沉默也减轻了雄激素对AR表达的抑制(补充图S20)。根据RT-qPCR的评估,ARNT沉默实质上再现了SIM2对选定AR靶基因和DEGs的影响(补充图S21a, b)。对雄激素调节基因集的meta分析显示,通过SIM2沉默,几种途径显著富集。A_up/ siSIM2_up基因组和A_up/siSIM2_dn基因组中富集的最上面的通路分别是膜运输和细胞对外界刺激的反应(图8e)。






