肿瘤的自我促进——外泌体miR-934诱导巨噬细胞M2极化促进CRC肝转移
越来越多的证据表明肿瘤相关巨噬细胞(TAMs)和外泌体在转移前niche(生态位)形成中发挥重要作用。TAMs是转移前生态位形成和结直肠癌肝转移(CRLM)的基础。然而,肿瘤来源的外泌体miRNAs与TAMs相互作用的分子机制仍然很大程度上未知。本研究发现肿瘤来源外泌体miR-934可以诱导巨噬细胞M2极化,进而促进CRC的肝转移。该文于2020年11月发表在《Journal of Hematology and Oncology》IF:11.059期刊上。
技术路线

主要实验结果
1、miR-934表达升高与CRLM进展及预后不良呈正相关
为了揭示参与CRLM的miRNA,作者基于TCGA数据库比较了CRC的1期肿瘤和4期肿瘤的miRNA表达谱,发现miR-934是在4期肿瘤中高表达差异表达最显著的miRNA(Fig. 1a, b)。此外,作者将110个CRC组织按有无肝转移分为两组,发现肝转移组与未转移组相比,组织和血清miR-934表达上调(Fig. 1c, d)。接下来,为了研究miR-934在CRLM进展中的作用,使用ISH比较了miR-934在包含308个CRC样本的组织芯片(TMA)中的表达,与正常粘膜组织相比,CRC组织中miR-934的表达明显上调;miR-934表达增加与T分期、M分期、晚期AJCC分期和肿瘤复发呈正相关,尤其是在肝转移的病例中(Fig. 1e)。以上数据提示,miR-934异常高表达与结直肠癌肿瘤进展及肝转移显著相关。生存分析显示,与miR-934表达较低的患者相比,miR-934表达较高的患者总生存期(OS)和无病生存期(DFS)较低(Fig. 1f, g)。因此,在CRLM患者中,miR-934高表达与CRLM进展和预后不良呈正相关。
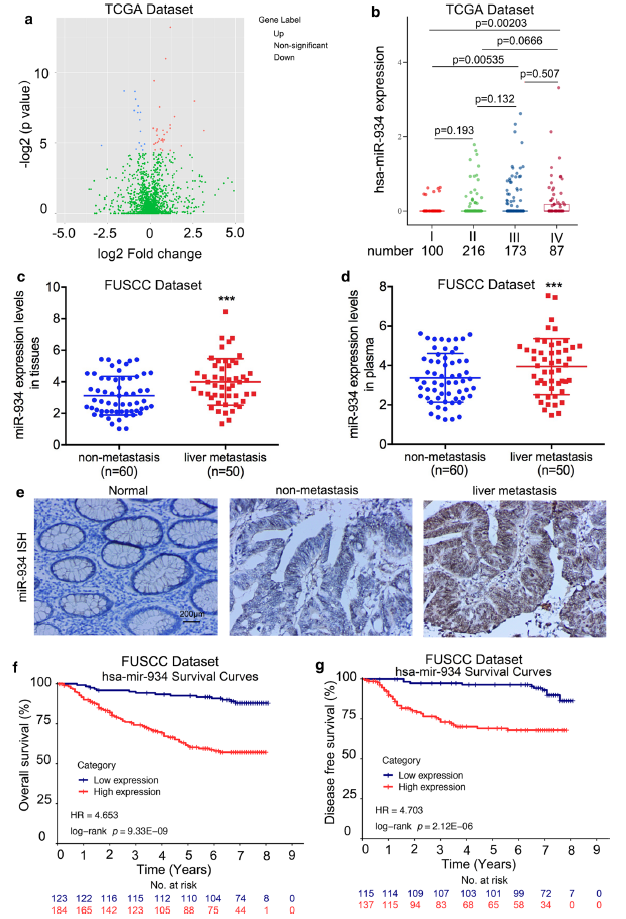
图1 miR-934表达升高与CRLM进展及预后不良呈正相关
2、miR-934存在于CRC细胞衍生的外泌体中
miR-934在HCT-8和LoVo的CM中的表达显著高于其它细胞(Fig. 2a)。随后,研究发现HCT-8和LoVo的CM中miR-934的表达显著高于细胞核和细胞质(Fig. 2b, c)。并且,miR-934在CM中的表达不随RNase A的处理而改变,而随RNase A+Triton X-100的处理显著下降(Fig. 2d),这表明细胞外的miR-934被膜包裹,而不是直接分泌。因此,推测miR-934可能是被外泌体传输。电镜和纳米颗粒追踪分析表明,miR-934表达水平较高的CRC细胞分泌的外泌体比miR-934表达水平较低的CRC细胞分泌的外泌体更多(Fig. 2e, f)。各组外泌体标志物CD9,ALIX,TSG101均被WB检测到(Fig. 2g)。为了阐明miR-934是否主要来源于CRC细胞的外泌体,使用GW4869抑制CRC细胞的外泌体分泌,发现miR-934在CRC细胞来源的外泌体中的表达水平明显高于外泌体耗尽的CRC细胞(Fig. 2h)。此外,采用qPCR分析miR-934在总CM、外泌体耗尽CM(超离心耗竭)和外泌体中的表达,结果显示,miR-934在总CM或外泌体中的表达显著高于外泌体缺失的CM(Fig. 2i)。此外,使用qPCR研究了上述四种CRC细胞系的外泌体中miR-934的表达,发现外泌体中miR-934的表达模式与CRC细胞CM中的表达模式一致(Fig. 2j)。以上结果表明miR-934主要包裹在CRC细胞来源的外泌体中。
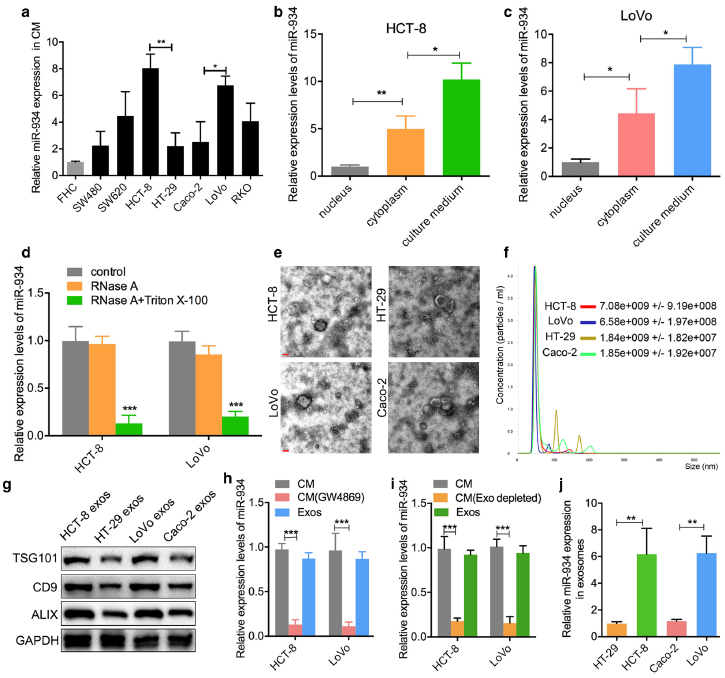
图2 miR-934存在于CRC细胞衍生的外泌体中
3、CRC细胞来源的外泌体miR-934诱导巨噬细胞M2极化
为了探索miR-934促进CRLM的分子和细胞基础,通过Cytoscape软件注释了TCGA cohort中191个miR-934相关基因的细胞功能,发现miR-934广泛参与多种炎症反应,提示miR-934可能参与了CRC免疫微环境(Fig. 3a)。然后发现miR-934与巨噬细胞的基因信号特异性相关(Fig. 3b)。为了研究在CRLM中TAM的浸润与miR-934之间的相关性,我们在原发性结直肠癌组织和CRLM组织样本中采用免疫组化染色检测TAM标记CD163。如图3c所示,在CRLM组织中CD163+ TAM浸润丰富的区域观察到miR-934表达升高。
将THP-1细胞与PMA孵育,诱导分化为M0巨噬细胞,M0巨噬细胞具有适当的贴壁形态和巨噬细胞标志物CD68的高表达(Fig. 3d)。接下来,研究了CRC细胞来源的外泌体对巨噬细胞M2极化的影响。如Fig. 3e所示,当与巨噬细胞共培养时,标记有DiO(绿色)的CRC细胞来源的外泌体被未染色的巨噬细胞内化。相比于低表达miR-934的细胞的外泌体孵育的巨噬细胞或PBS孵育的细胞,M2标记物 (CD206, arginase-1, IL10和CD163)的表达在高表达miR-934的CRC细胞的外泌体孵育的巨噬细胞中显著增加,而M1标记物(iNOS和IL-1β)几乎无差异(Fig. 3f, g)。
为了确定CRC细胞来源的外泌体miR-934是否诱导巨噬细胞的M2极化,首先生成了miR-934 mimics和anti-miR-934来过表达或抑制miR-934的表达。与对照组相比,转染miR-934 mimics的巨噬细胞M2标记物(CD163、CD206、arginase-1和IL10)的表达明显增加(Fig. 3h, i)。此外,用anti-miR-934、miR-934 mimics或其阴性对照载体转染HCT-8和HT29细胞,提取其外泌体并添加到PMA处理的THP-1细胞中。结果显示,转染anti-miR-934或miR-934 mimics的CRC细胞的外泌体中M2标记物(CD206、arginase-1、IL10和CD163)在PMA处理的THP-1细胞中表达明显低于或高于载体对照组(Fig. 3j, k)。综上所述,证实CRC细胞来源的外泌体miR-934可以诱导巨噬细胞M2极化。
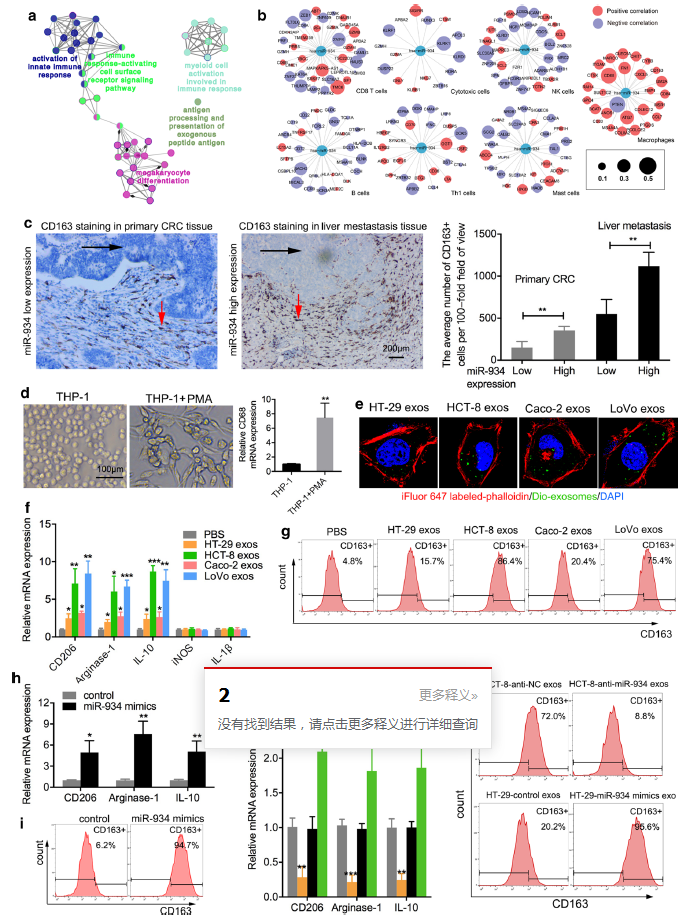
图3 CRC细胞来源的外泌体miR-934诱导巨噬细胞M2极化
4、hnRNPA2B1在外泌体miR-934向巨噬细胞转移中发挥作用
据报道,外泌体RNA的分泌需要一种特定的RNA结合蛋白来转运。通过RNA pull-down分析和质谱分析,鉴定了三种可能参与miR-934转运的RNA结合蛋白,并发现敲除hnRNPA2B1可以降低外泌体miR-934的表达(Fig. 4a, b)。hnRNPA2B1是一种RNA结合蛋白,通过与特定基序GGAG/CCCU结合,参与miRNAs的运输和转录后调控。特别是,由于miR-934序列中有两个GGAG基序,我们推测hnRNPA2B1可能通过与GGAG序列结合,介导miR-934包装成外泌体的过程。此外,miRNA pull-down分析显示,在细胞质和外泌体中,miR-934和hnRNPA2B1之间存在显著的结合关系,然而,突变miR-934的结合序列(GGAG)可削弱这种结合(Fig. 4c)。RNA免疫沉淀分析进一步证明,无论是在CRC细胞及其外泌体裂解物中,miR-934在anti-hnrnpa2b1抗体组中比在anti-IgG抗体组中更显著富集(Fig. 4d)。此外,敲除hnRNPA2B1可以抑制外泌体miR-934从HCT8和LoVo细胞转移到巨噬细胞的过程(Fig. 4e)。因此,这些结果证实hnRNPA2B1可以通过与miR-934的GGAG序列结合,介导miR-934包装到CRC细胞外泌体中,并将外泌体miR-934转移到巨噬细胞中。
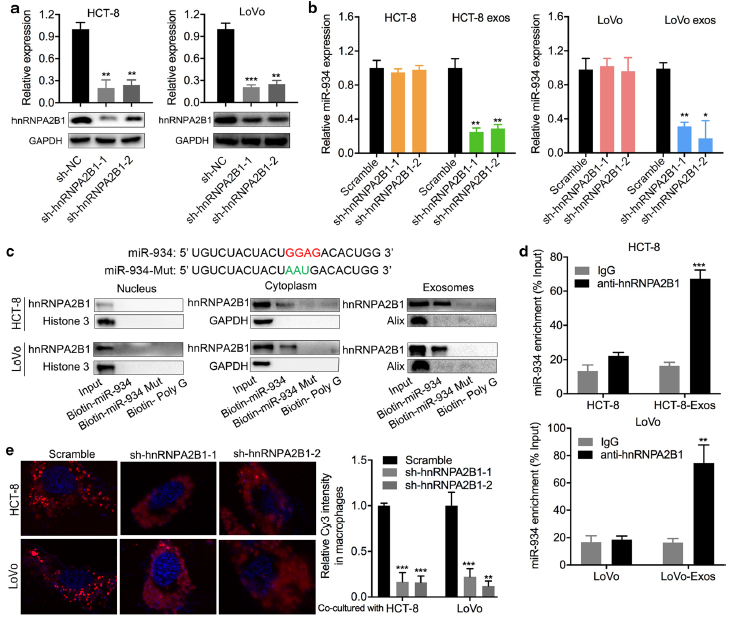
图4 hnRNPA2B1在外泌体miR-934向巨噬细胞转移中发挥作用
5、外泌体miR-934通过下调PTEN表达和激活PI3K/AKT信号通路诱导巨噬细胞M2极化
进一步探索肿瘤来源的外泌体miR-934诱导M2巨噬细胞极化的机制。miR-934序列与PTEN的3 ' -UTR序列存在比对,提示miR-934可能靶向PTEN诱导M2巨噬细胞极化(Fig. 5a)。如Fig.5b所示,将miR-934 mimics或anti-miR-934及其控制载体转染到PMA处理的THP-1细胞中,发现分别转染miR-934 mimics或anti-miR-934和PTEN野生型结合位点组中PTEN的3’-UTR荧光素酶活性显著降低或升高(Fig. 5b)。有趣的是,当细胞与转染了anti-miR-934、miR-934 mimics或其对照载体的HCT-8或HT29细胞的外泌体共培养时,荧光素酶活性模式显示出与上述趋势相同(Fig. 5c)。此外,PMA处理的THP-1细胞转染miR-934 mimics或anti-miR-934,与各自的对照细胞相比,分别在mRNA和蛋白水平下调或上调了PTEN的表达(Fig. 5d)。类似的,分别用转染anti-miR-934或miR-934 mimics的CRC细胞的外泌体孵育PMA处理的THP-1细胞,结果发现PTEN,PI3K/AKT的表达明显高于或低于各自的对照组(Fig. 5e, f)。这些表明在PMA处理的THP-1细胞中,外泌体来源的miR-934可以通过靶向其3 ' -UTR和激活PI3K/AKT通路来下调PTEN的表达。
IL-3/IL-4能诱导M2巨噬细胞极化,预先用50ng /mL IL-3/IL-4处理THP-1细胞3天,验证anti-miR-934对M2巨噬细胞极化的影响。结果显示PTEN过表达部分减弱了miR-934和HCT-8细胞来源外泌体对M2标记物(CD206, arginase-1和IL10)表达的增强作用,而PTEN的沉默则相应地逆转了anti-miR-934对M2标记物表达的衰减效应(Fig. 5g, i)。流式细胞术检测M2巨噬细胞标志物CD163在PMA处理的THP-1细胞中的表达,结果与上述结果一致(Fig. 5j)。总之,研究结果表明,miR-934增强了CRC细胞来源的外泌体对M2巨噬细胞极化诱导的增强作用,而anti-miR-934减弱了其增强作用。
PTEN是一种肿瘤抑制因子,调节多种细胞功能,包括细胞增殖和分化,PI3K/AKT信号通路是PTEN通过其磷酸酶活性靶向的最重要通路之一。因此,推测PI3K/AKT信号通路可能参与CRC细胞来源的外泌体miR-934诱导M2巨噬细胞极化。WB结果显示过表达PTEN可以部分减弱miR-934和HCT-8细胞源外泌体对p-AKT和p-PI3K表达的增强作用,而沉默PTEN则相反(Fig. 5k)。更重要的是,当与HCT-8细胞来源的外泌体和PI3K抑制剂(LY294002)共培养时,PMA处理的THP-1细胞中p-AKT和M2标记物(CD206、arginase-1和CD163)的表达下调(Fig. 5l, m)。综上所述,CRC细胞来源的外泌体miR-934可以通过下调PTEN表达和激活PI3K/AKT信号通路诱导M2巨噬细胞极化。
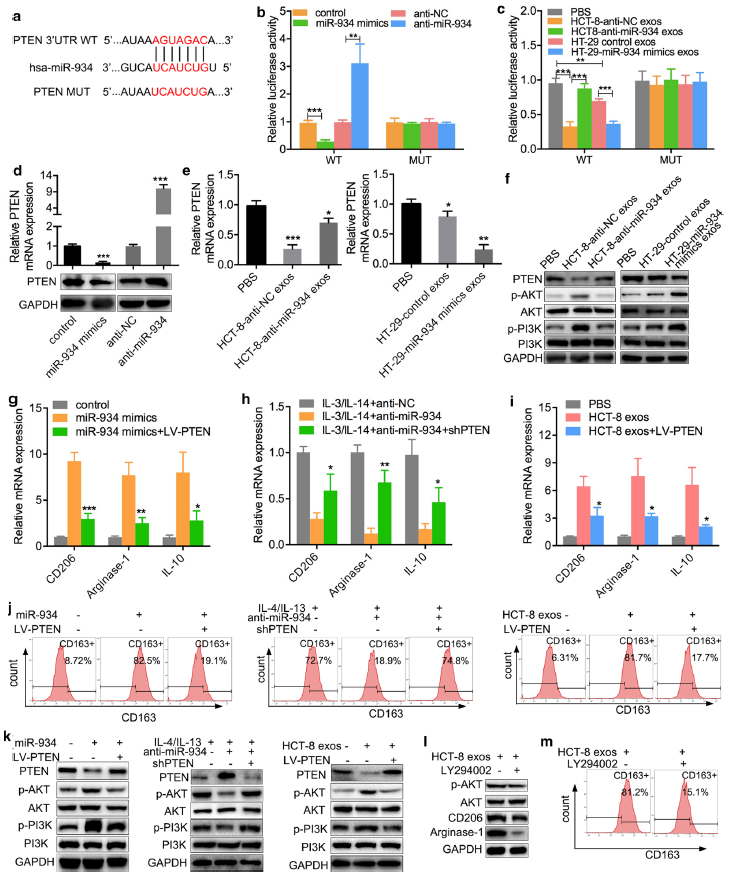
图5外泌体miR-934通过下调PTEN表达和激活PI3K/AKT信号通路诱导巨噬细胞M2极化
6、CRC细胞来源的外泌体miR-934诱导M2巨噬细胞极化促进CRLM
将弱转移的CRC细胞系SW480和RKO与miR-934 mimics预处理的THP-1细胞的CM共培养。结果显示,无论是体内还是体外,侵袭和转移能力都随着miR-934 mimics外泌体处理而升高,随着anti-miR-934外泌体处理而下降(Fig. 6c–g)。这些结果表明,CRC细胞来源的外泌体miR-934诱导M2巨噬细胞极化可以增强CRC细胞的侵袭和肝转移能力。

图6 CRC细胞来源的外泌体miR-934诱导M2巨噬细胞极化促进CRLM
7、CRC细胞来源的外泌体miR-934诱导M2巨噬细胞极化,通过激活CRC细胞中的CXCL13/CXCR5轴促进CRLM
用HCT-8细胞来源的外泌体与阴性对照处理或PMA预处理的THP-1细胞孵育,分析趋化因子水平。如Fig.7a所示,CXCL13、IL-10和CCL22的表达水平远远高于其他趋化因子的水平。然后,PMA-pretreated THP-1细胞转染miR-934 mimics或NC,ELISA表明CXCL13的表达显著增加(大约10倍)而CCL22和IL - 10(二至三倍),这表明CXCL13可能在CRLM的进展扮演了一个重要的角色(Fig. 7b)。此外,结果显示,过表达miR-934或下调miR-934可部分增强或减弱HT29/HCT8细胞来源外泌体对M2巨噬细胞分泌CXCL13的增强作用(Fig. 7c)。
因为CXCL13是一种趋化剂,可以促进表达CXCR5的细胞趋化,使用IHC染色评估其在CRC中的表达,结果显示CXCR-5在结直肠癌组织中的染色强于正常组织,说明M2极化巨噬细胞分泌的CXCL13主要作用于CRC细胞(Fig. 7d)。PMA预处理后的THP-1细胞转染miR-934 mimics,并与加入anti-CXCL13抗体或IgG的SW480细胞或RKO细胞共培养。此外,上述TPH-1细胞液与敲除CXCR5的细胞共培养。体外transwell实验显示,在与miR-934过表达PMA处理的THP-1细胞的CM共培养组中,anti-CXCL13抗体抑制了CRC细胞的迁移和侵袭;转染了shCXCR5的SW480和RKO细胞与miR-934过表达PMA处理的THP-1细胞共培养时,迁移和侵袭能力降低(Fig. 7e, f)。此外,小鼠体内肝转移检测表明,与对照组相比,用anti-CXCL13抗体或敲除CXCR5的CRC细胞的肝转移菌落减少(Fig. 7g–i)。

图7 CRC细胞来源的外泌体miR-934诱导M2巨噬细胞极化,通过激活CRC细胞中的CXCL13/CXCR5轴促进CRLM
8、CXCL13/CXCR5/NFκB/p65/miR-934正反馈环路在CRLM期间介导M2巨噬细胞和CRC细胞之间的相互作用
如Fig. 8a所示,WB显示,与对照组相比,SW480和RKO细胞中,CXCL13促进p65磷酸化,NFκB、MMP2和MMP9的表达上调而IκBα的表达下调。CXCR5表达下调可部分减弱CXCL13的增强作用。此外,PMA处理的THP-1细胞用miR-934 mimics预处理,然后与SW480细胞或RKO细胞与anti-CXCL13抗体共培养,或与shCXCR5共培养。我们发现CRC细胞中的anti-CXCL13抗体或CXCR5敲低可以抑制miR-934过表达诱导的NFκB信号通路的活化(Fig. 8b)。值得注意的是,helenalin抑制NFκB/p65信号后,SW480和RKO细胞中miR-934、MMP2和MMP9的表达显著低于对照组(Fig. 8c),这表明miR-934也可能通过正反馈回路被NFκB/p65信号正调控。
由于p65转位到细胞核并促进其靶向基因的转录,假设NFκB/p65信号通路的激活可通过p65的转录活性上调miR-934表达。在p65和miR-934启动子之间发现了5个潜在的转录结合区域和2个特异性结合位点(Fig. 8d)。随后,用miR-934启动子中含有p65结合区域的载体转染SW480和RKO细胞;ChIP实验证明p65对miR-934的转录在-2002和-1500 bp(区域1)之间的区域内显著增高,在其他四个结合区域中未观察到明显变化(Fig. 8e)。这些数据表明,区域1可能在调节CRC细胞中p65介导的miR-934转录诱导中起关键作用。荧光素酶报告基因检测证实p65对SW480和RKO细胞中miR-934启动子的转录影响(Fig. 8f)。作者发现只有突变结合位点1可以下调p65的荧光素酶报告基因活性,抑制miR-934的转录表达,这证明p65可以通过结合位点1正向直接调节miR-934的表达(Fig. 8f)。此外,作者证明了SW480和RKO细胞中的突变结合位点1可以消除CXCL13的促进作用和NFκB/p65信号对miR-934表达的抑制作用(Fig. 8g,h)。综上所述,这些结果证明CXCL13/CXCR5/NFκB/p65信号通路促进CRC细胞中miR-934的转录,形成一个正反馈回路,参与持续的M2巨噬细胞极化和CRC细胞的侵袭和转移。
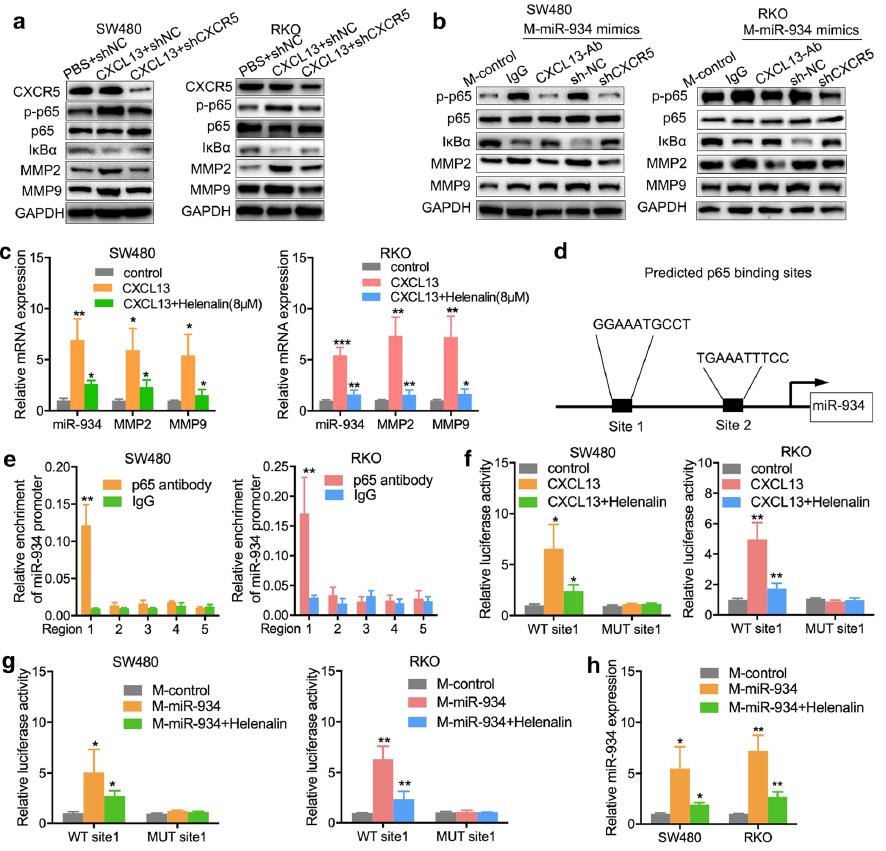
图8 CXCL13/CXCR5/NFκB/p65/miR-934正反馈环介导M2巨噬细胞与CRC细胞之间的相互作用CRLM
总之,如Fig. 9,CRC来源的外泌体miR-934可通过下调PTEN表达和激活PI3K/AKT信号通路诱导M2巨噬细胞极化。此外,外泌体miR-934极化的M2巨噬细胞可以通过CXCL13/CXCR5/NFκB/p65/miR934正反馈环促进CRLM。因此,研究阐明了促进肿瘤细胞和TAMs相互作用的CRLM的新分子机制,这将有助于开发CRLM的有效预防和治疗策略。更重要的是,血清外泌体中miR-934高表达与CRLM相关,提示其可能是未来液体活检和预测CRLM风险的一个有前景的生物标志物。此外,靶向外泌体miR-934介导的肿瘤细胞与TAMs之间的串扰可能为CRLM的治疗提供新策略。

图9 图形摘要
参考文献:
Zhao Senlin., Mi Yushuai., Guan Bingjie., Zheng Binbin., Wei Ping., Gu Yanzi., Zhang Zhengxiang., Cai Sanjun., Xu Ye., Li Xinxiang., He Xuefeng., Zhong Xinyang., Li Guichao., Chen Zhiyu., Li Dawei.(2020). Tumor-derived exosomal miR-934 induces macrophage M2 polarization to promote liver metastasis of colorectal cancer. J Hematol Oncol, 13(1), 156. doi:10.1186/s13045-020-00991-2






