与奥沙利铂耐药相关外泌体miR-208b促进CRC的Treg扩增
奥沙利铂耐药是结直肠癌(CRC)患者治疗中的一个挑战。调节性T细胞(Treg)以其免疫抑制作用而闻名,靶向Treg是提高化疗敏感性的有效途径。Treg是一种提高化学敏感性的有效方法。外泌体递送的miRNA被用作预测化疗敏感性的潜在生物标志物。然而,Treg和外泌体miRNAs之间的关系仍然很大程度上是未知的。本研究结果表明,肿瘤分泌的miR-208b通过靶向PDCD4促进Treg扩增,这可能与CRC中奥沙利铂化疗敏感性的降低有关本。这些发现突出了外泌体miR-208b作为奥沙利铂治疗反应的预测生物标志物的潜在作用,并且它们是免疫治疗的新靶点。本研究于2021年4月发表于《Molecular Therapy》IF: 8.986期刊上。
技术路线:
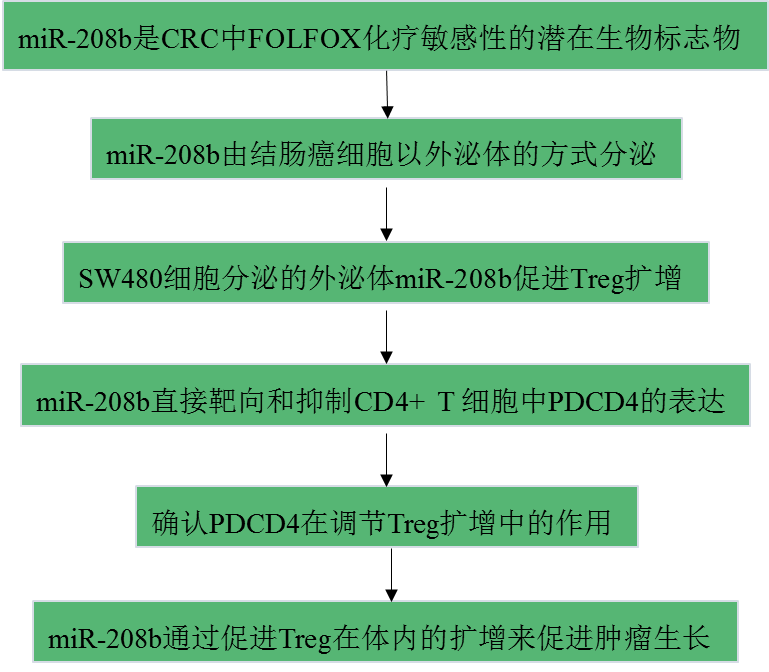
主要实验结果:
1、循环miR-208b是CRC中FOLFOX化疗敏感性的一种很有前途的生物标志物
如图1所示,作者设计了一项多期研究,以确定新的血清miRNAs作为预测和监测奥沙利铂联合亚叶酸和5-FU(FOLFOX)化疗反应的替代标志物。
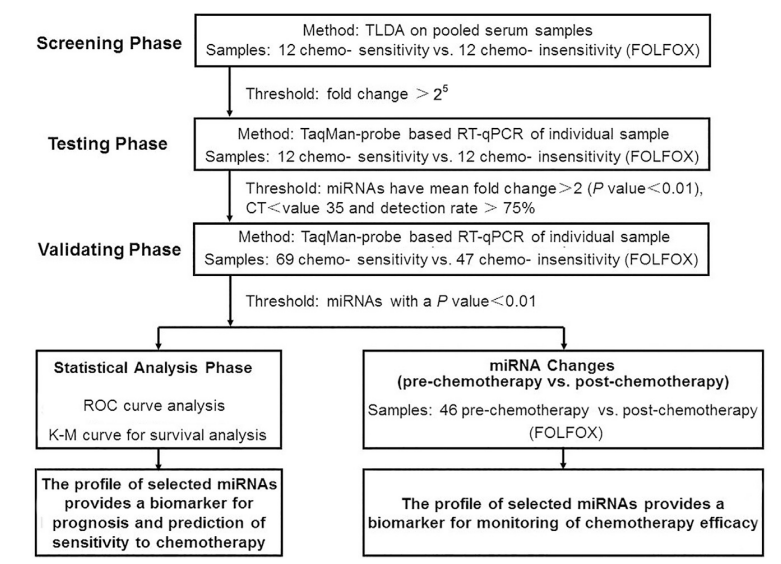
图1描述实验设计的流程图
作者检测了69个化疗敏感和47个化疗不敏感患者的血浆中miR-208b表达,结果显示与未响应组相比,miR-208b的表达水平在响应组显著下调(图2A-B)。同时检测了血清癌胚抗原(CEA)水平,血清miR-208b的曲线下面积(AUC)与血清CEA的AUC相比,优于血清CEA水平。在化疗响应组,在化疗前miR-208b的表达高于化疗后,而在未响应组,化疗前低于化疗后水平(图2C)。生存分析显示,无进展生存期化疗响应组显著高于未响应组,miR-208b低表达组显著高于高表达组(图2D)。这些结果表明miR-208b可作为预测CRC中FOLFOX化疗敏感性的非侵袭性标志物。
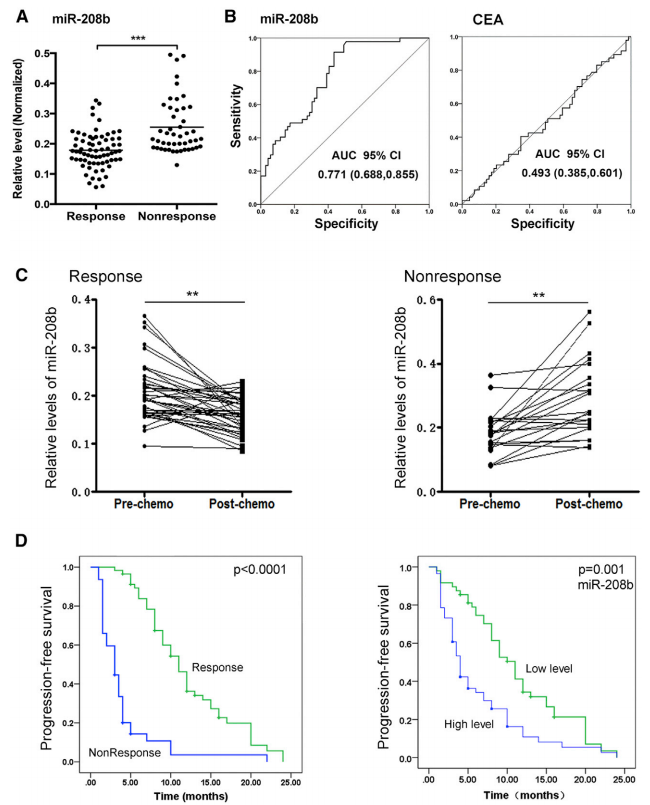
图2循环miR-208b是CRC中FOLFOX化疗敏感性的很有前途的生物标志物
2、miR-208b由结肠癌细胞以外泌体的方式分泌
随后,作者探究了miR-208b的存在方式是否由外泌体介导。分离鉴定了3株CRC细胞系的外泌体,并检测了其中miR-208b的表达。外泌体中miR-208b的表达模式和在细胞中的模式一致,在SW480-OXA显著高于SW480显著高于NCM460。这些结果表明CRC中miR-208b的是以外泌体的模式分泌,这可能和顺铂化疗敏感性有关。
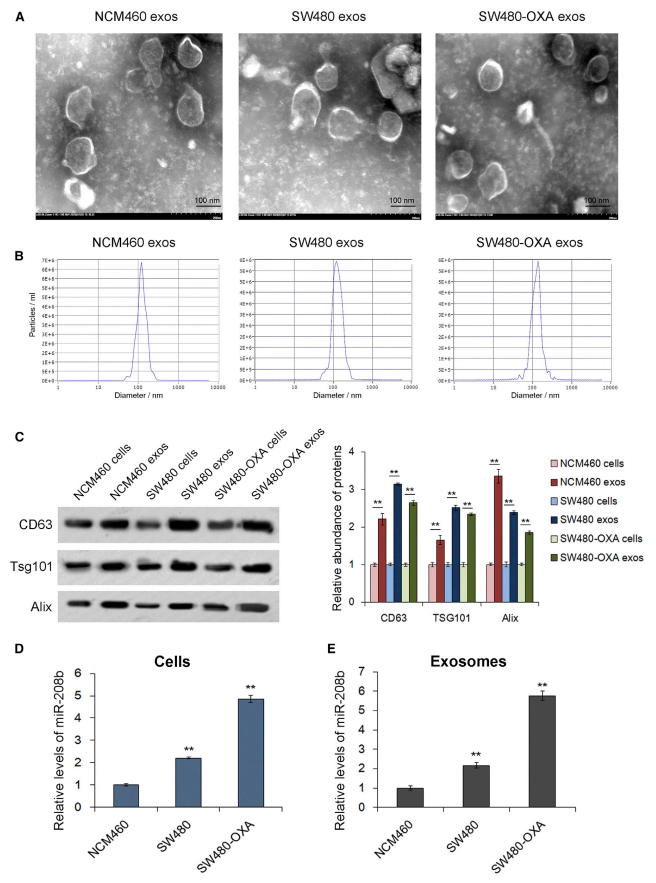
图3 miR-208b由结肠癌细胞以外泌体的方式分泌
3、SW480细胞分泌的外泌体miR-208b促进Treg扩增
前人研究表明顺铂会影响肿瘤免疫微环境。MiRNA可能通过促进Treg扩增诱导免疫侵袭。因此,作者探究了CRC分泌外泌体miR-208b对T细胞分化的影响。使用siRNA去除miR-208b,然后收集外泌体,将含有不同水平miR-208b的外泌体与原代CD4+ T细胞共培养(图4A-B)。6h后,受体CD4+ T细胞中miR-208b显著增加,尤其是SW480-OXA组,而外泌体miR-208b缺失组则没有显著改变,表明CD4+ T细胞中miR-208b是由外泌体传输(图4C-D)。此外,SW480和SW480-OXA来源外泌体处理组的CD4+CD25highFoxp3+ Tregs细胞数显著增加,而外泌体miR-208b缺失对其阳性细胞数则没有明显影响。表明外泌体miR-208b促进Treg扩增。
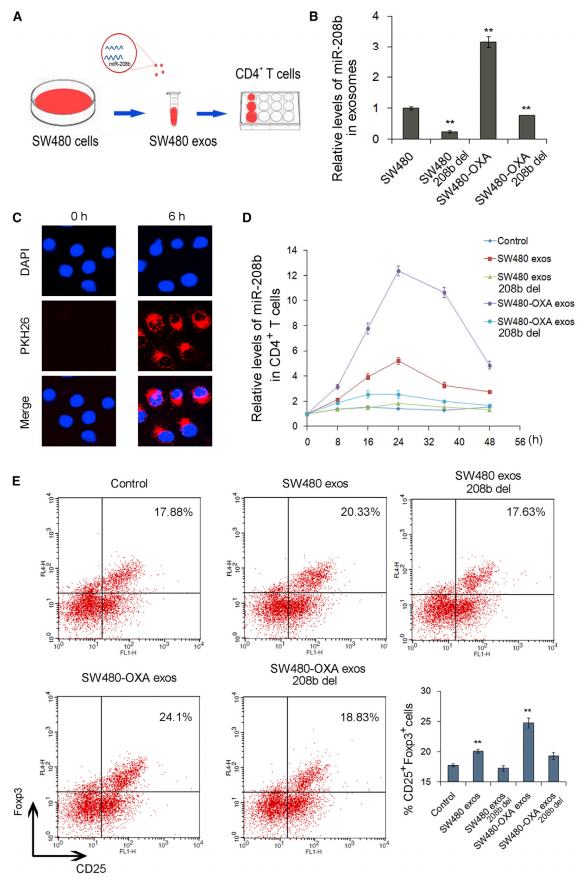
图4 SW480细胞分泌的外泌体miR-208b促进Treg扩增
4、miR-208b直接靶向和抑制CD4+ T 细胞中PDCD4的表达
为了进一步探究miR-208b的分子机制,探究了其下游靶基因机制,使用生信预测了其靶基因,最终挑选到PDCD4(图5A)。荧光素酶进一步证实了miR-208b和PDCD4之间的结合(图5C-D)。研究发现,T细胞中PDCD4的表达在SW480外泌体处理组显著下降,而这个抑制作用在SW480-OXA组更加明显,PCD表达在miR-208b缺失组则显著升高(图5E)。此外,加入miR-208b mimics后,PDCD4蛋白显著降低,而抑制miR-208b后,PDCD4蛋白的表达相对增强,此外,PDCD4在mRNA水平的表达没有明显变化(图5F)。然后,评估了miR-208b对CD4+ T细胞扩增的影响。研究表明,转染miR-208b mimics显著增强了Treg的扩增,而抑制miR-208b水平则抑制了Treg的扩增(图5G-H)。这些结果表明miR-208b直接靶向抑制PDCD4的表达,导致Treg分化。

图5 miR-208b通过直接靶向和抑制PDCD4的表达来促进Treg的扩增
5、确认PDCD4在调节Treg扩增中的作用
随后探究了PDCD4在调节Treg扩增中的作用。如图A-C所示,成功构建了PDCD4的过表达和干扰表达细胞系。与对照组相比,PDCD4过表达显著降低了Treg细胞的扩增率,而干扰其表达则显著提高了Treg细胞的扩增率。表明PDCD4是负调节Treg细胞扩增的关键基因。
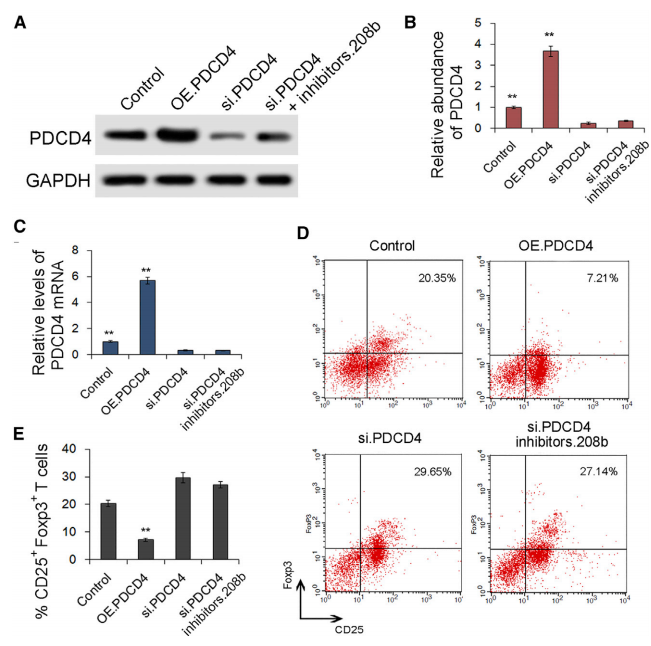
图6 PDCD4与Treg扩增密切相关
6、肿瘤来源外泌体miR-208b影响体内化疗效果和肿瘤生长
随后作者探究了肿瘤来源外泌体miR-208b体内对化疗效果和肿瘤生长的影响。用慢病毒转染CT26细胞产生miR-208b过表达和miR-208b敲低细胞系。动物实验设计示意图如图7A所示,实验采用6组(每组10只小鼠),其中3组使用奥沙利铂,BALB/c小鼠植入CT26细胞,建立肿瘤植入模型。如图7B-7D所示,miR-208b-OE组肿瘤生长速度较快,而中miR-208-KD组肿瘤生长明显慢于对照组。
从各组小鼠中分离出外周血CD4+ T细胞,结果显示miR-208b-OE组中PDCD4的显著下调,miR-208-KD组的结果则相反(图7E和7F)。然而,在PDCD4 mRNA水平上没有观察到差异(图7G)。从血清中分离出外泌体,检测miR-208b水平(图7H)。如预期的,miR-208b在miR-208b-OE组中显著升高,而miR-208b-KD组中miR-208b水平下降 (图7I)。这些结果表明,肿瘤分泌的miR-208b在体内可以充分地传递到CD4+ T细胞中,抑制PDCD4的表达。此外,这种现象在奥沙利铂治疗组更加显著(miR-208b-OE + OXA和miR-208b-KD+ OXA)。

图7 miR-208b通过促进Treg在体内的扩增来促进肿瘤生长
接下来,测定了分泌的miR-208b对体内Treg和存活的影响,如图8A-B所示,CD4+- CD25+ Foxp3+ Treg在外周血和脾脏分离的总CD4+ T细胞群中的比例在miR-208b-OE组和miR-208b-OE + OXA组显著升高,而在miR-208b-KD和miR-208b-KD + OXA显著下降。与此一致,miR-208b低表达组的生存率也显著高于高表达组(图8C)。综上所述,这些结果表明,肿瘤分泌的miR208b增加了Treg的百分比,促进了肿瘤在体内的生长。此外,奥沙利铂在体内可以通过miR-208b调控Tregs的数量,这与奥沙利铂成分的化学敏感性有关。
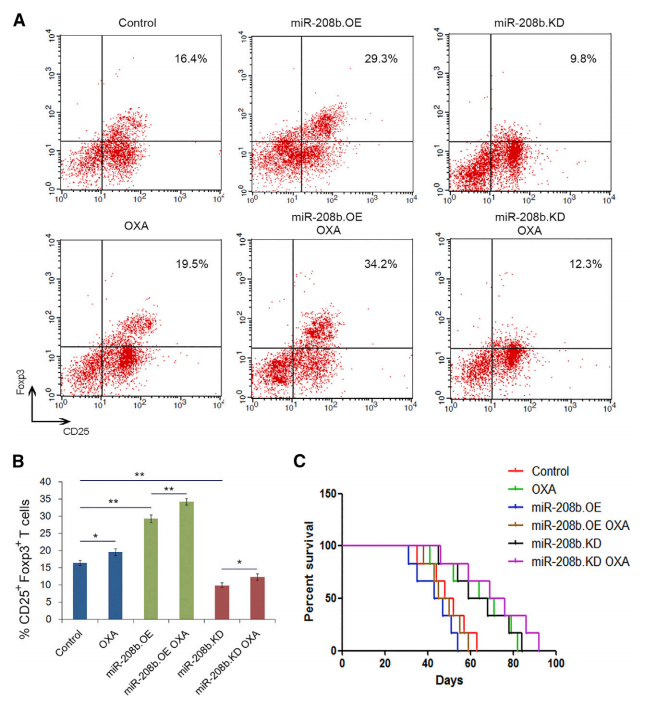
图8癌细胞分泌的miR-208b增加了体内Treg的数量
参考文献:
Ning et al., Exosomal miR-208b related with oxaliplatin resistance promotes Treg expansion in colorectal cancer, Molecular Therapy (2021), https://doi.org/10.1016/j.ymthe.2021.04.028






