lncRNA MIR210HG促进子宫内膜癌的进展
上皮-间充质转化(EMT)促进肿瘤发生和转移,增加肿瘤对治疗干预的耐受性。TGF-b和Wnt通路的异常激活诱导EMT。lncRNAs显著影响EMT调控。2021年6月发表于Molecular Therapy-Nucleic Acids(IF=8.886)的文章“lncRNA MIR210HG promotes the progression of endometrial cancer by spongingmiR-337-3p/137 via the HMGA2-TGF-b/Wnt pathway”对此展开了研究。在此,我们发现MIR210HG在子宫内膜癌组织中过表达,与不良预后相关。MIR210HG的沉默在体外显著抑制了细胞增殖、迁移、侵袭和EMT表型的形成以及在体内的肿瘤发生。生物信息学分析、RIP分析和荧光素酶分析表明,MIR210HG作为miR-337-3p和miR-137的分子海绵,调节HMGA2的表达。此外,MIR210HG过表达显著增强了Wnt/b-catenin和TGF-b/Smad3信号通路基因,而MIR210HG或HMGA2下调抑制了Wnt/b-catenin和TGF-b/Smad3信号通路基因。我们在MIR210HG-miR-337-3p/137-HMGA2轴上的发现说明了其作为子宫内膜癌治疗发展的靶点的潜力。

技术路线

结果
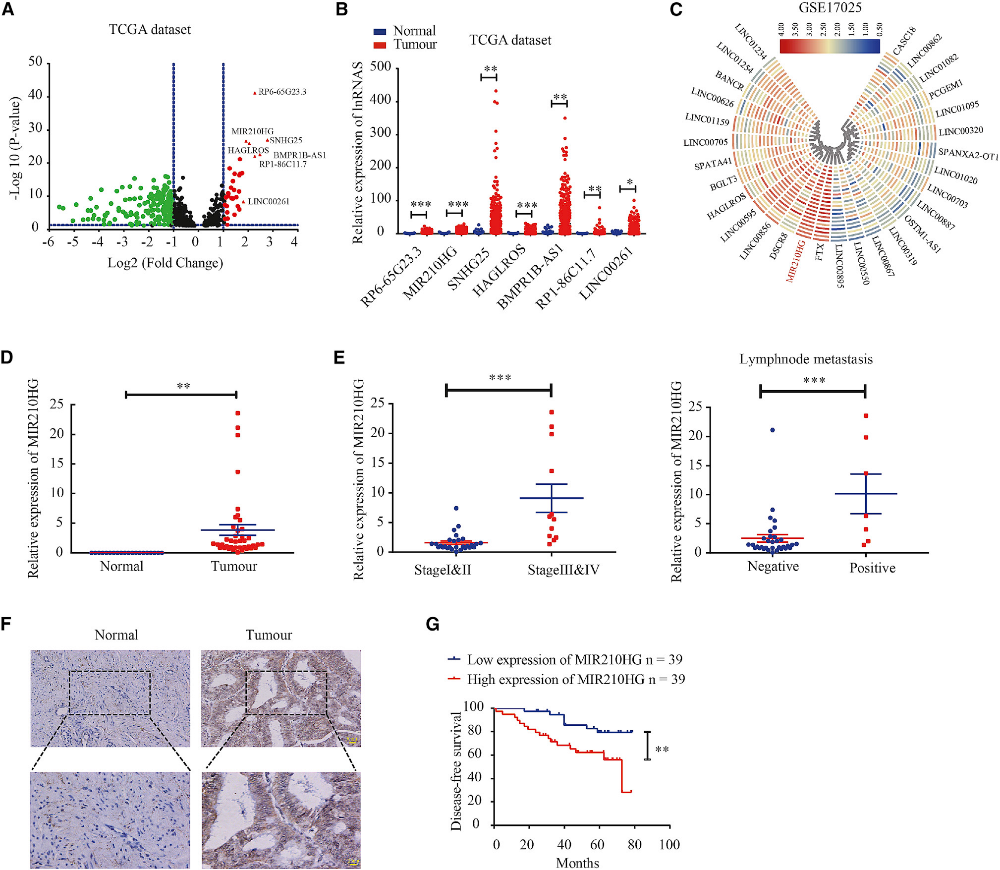
1)MIR210HG与子宫内膜癌患者的低生存率相关
为了识别子宫内膜癌组中异常表达的lncRNA,我们分析了来自TCGA的数据。表达阵列分析显示332个lncRNA的表达差异有统计学意义。7个lncRNA表达上调(图1A和1B)。然后,我们分析了GEO数据集,发现在子宫内膜癌GSE17025队列中MIR210HG的表达也上调(图1C)。qPCR显示MIR210HG在子宫内膜癌中的表达明显高于正常子宫内膜组织(图1D)。此外,我们分析了MIR210HG的表达与子宫内膜癌患者临床病理参数的关系,发现MIR210HG在从I、II期到III、IV期的进展过程中增加。MIR210HG的表达与淋巴结转移显著相关(图1E)。原位杂交实验结果显示,MIR210HG在子宫内膜癌中的表达水平高于正常子宫内膜组织(图1F)。MIR210HG高表达的子宫内膜癌患者生存率较低(图1G)。
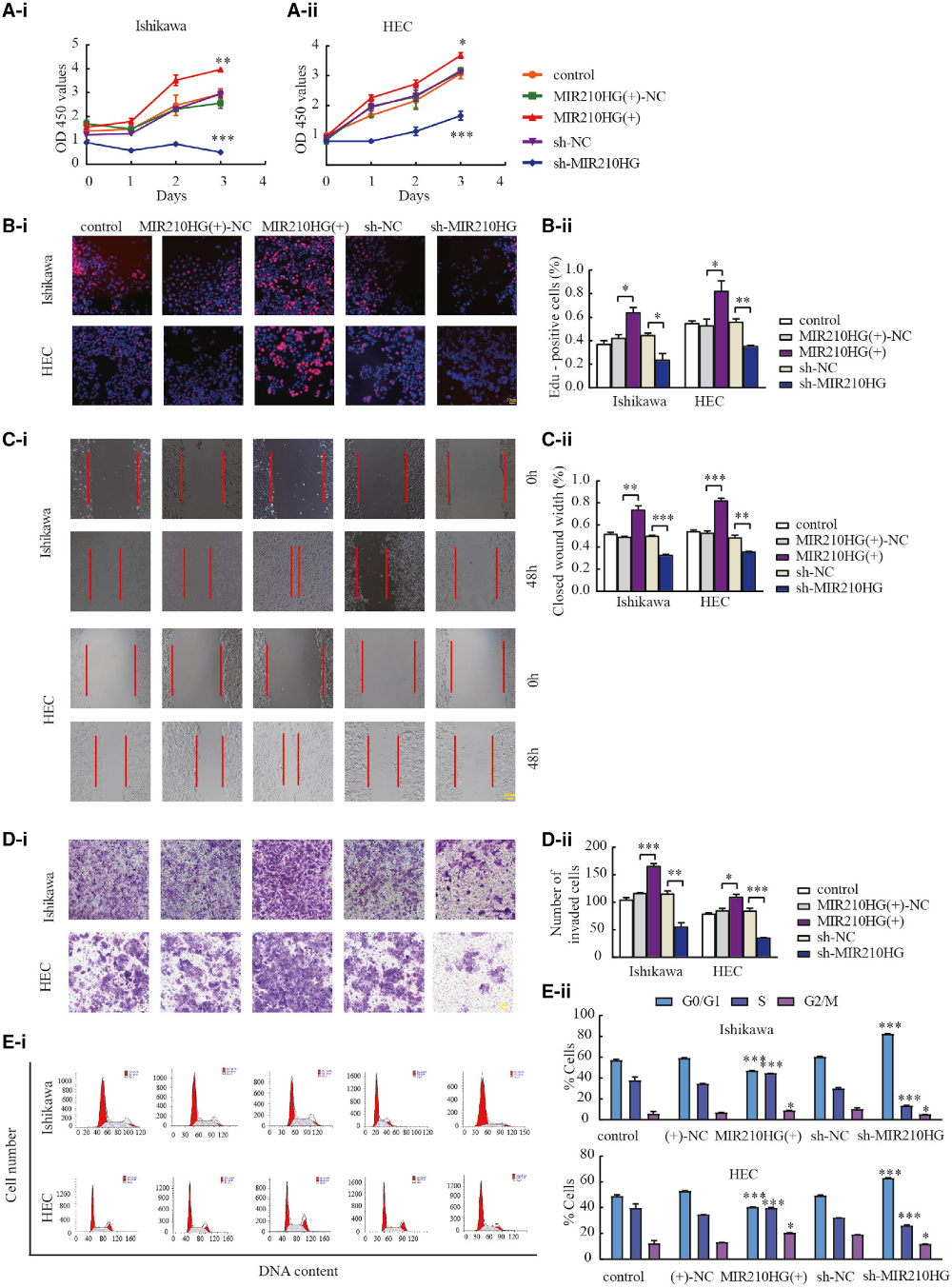
2)下调MIR210HG可抑制子宫内膜癌细胞的增殖、迁移和侵袭
我们研究了MIR210HG在子宫内膜癌细胞中的生物学功能。我们发现MIR210HG的下调有效地降低了Ishikawa和HEC-1A细胞的增殖(图2A和2B)。采用创面愈合实验和Transwell实验研究MIR210HG对肿瘤迁移和侵袭的影响。与sh阴性对照组(NC)相比,转染sh-MIR210HG的细胞迁移和侵袭减少(图2C和2D)。流式细胞术分析细胞周期分布(图2E)。以上结果提示MIR210HG在子宫内膜癌中起致癌基因的作用。
3)MIR210HG可能参与了由lncRNA-miRNA-mRNA调控网络介导的子宫内膜恶性生物学行为
利用TCGA数据集对子宫内膜癌样本进行基因集合富集分析,探索MIR210HG参与调控子宫内膜癌的生物学通路。MIR210HG的表达与TGF-b和Wnt通路显著相关,而Smad3基因在这些关联中发挥了重要作用(图3A)。搜索工具STRING的分析也显示SMAD3和HMGA2是强相关的(图3B)。我们探究HMGA2是否为MIR210HG的下游基因,发现MIR210HG下调后HMGA2蛋白表达水平降低。相反,当MIR210HG高表达时,HMGA2的表达显著增加(图3C)。这表明MIR210HG可能通过上调HMGA2的表达来促进子宫内膜癌细胞的恶性生物学行为。荧光原位杂交和核胞质RNA分数实验结果显示,MIR210HG在Ishikawa细胞和HEC-1A细胞中均位于核和细胞质内(图3D和3E)。我们假设MIR210HG对miRNAs起海绵作用。为了探究MIR210HG是否参与了一个新的MIR210HG- miRNA -HMGA2调控网络,我们使用TargetScan、miRanda、CLIP-Seq和miRDB生物信息学数据库来预测与HMGA2结合的mirna(图3F)。选择3个软件程序分析交叉处的miRNAs作为候选miRNAs。通过将野生型双荧光素酶载体介导的HMGA2构建物共转染HEK293T细胞,共鉴定和筛选了110个miRNAs。转染后,23个miRNA转染细胞的荧光素酶活性显著降低(图3G)。在上述23种miRNAs中,转染miR-3373p、miR-137、let-7c-5p和miR-98-5p时,荧光素酶活性显著降低,其中转染miR-337-3p和miR-137时,荧光素酶活性降低最多。利用生物信息学数据库TargetScan预测miR-337-3p和miR-137中与HMGA2结合的位点。双荧光素酶基因报告基因检测结果显示,miR-337-3p和miR-137在其预测的结合位点上结合HMGA2(图3H)。qPCR结果显示,miR-337-3p和miR-137负调控HMGA2的表达(图3I)。采用Pearson’s秩相关法分析MIR210HG与HMGA2表达的相关性,发现HMGA2的表达与MIR210HG呈正相关(图3 J和K)。这些结果表明MIR210HG可能参与了新的MIR210HG-miR-337-3p/137-HMGA2调控网络。

4)miR-337-3p/miR-137在子宫内膜癌组织中表达较低,miR-337-3p/miR-137是MIR210HG的靶点
qPCR结果显示,肿瘤组织中miR-337-3p和miR-137的表达明显下调(图4A)。此外,采用Pearson等级相关法分析miR-337-3p、miR-137与MIR210HG表达的相关性(图4B)。随后,我们分析了HMGA2与miR-337-3p/137表达的关系(图4C)。我们进行了荧光素酶实验,以确定MIR210HG是否可以直接靶向miR-337-3p和miR-137在预测的结合位点(图4D)。为了确定MIR210HG是否与miRNA核糖核蛋白复合物结合,我们使用抗AGO2抗体进行RIP实验。与对照免疫球蛋白G 免疫沉淀相比,lncRNA MIR210HG和miR-337-3p/miR-137在含AGO2的免疫沉淀中显著富集(图4E)。当MIR210HG在Ishikawa和HEC-1A细胞中过表达时,miR-337-3p和miR-137表达水平降低。相比之下,转染sh-MIR210HG后,细胞中miR-337-3p和miR-137的表达水平显著升高,说明MIR210HG可以调控miR-337-3p和miR-137的表达(图4F)。随后,我们研究了miR-337-3p和miR-137是否负调控MIR210HG的表达,发现过表达miR-337-3p/137会下调MIR210HG的表达,而敲除miR-337-3p/137会上调MIR210HG的表达(图4G)。

5)过表达miR-337-3p和miR-137抑制子宫内膜癌细胞的恶性生物学行为
为了研究miR-337-3p和miR-137在子宫内膜癌生物学行为中的可能作用,我们分别用agomir-337-3p/137和antagomir-3373p/137转染Ishikawa和HEC-1A细胞。使用CCK-8和EdU检测细胞增殖(图5A和5B)。伤口愈合和Transwell检测分别用于评估细胞迁移和侵袭。过表达miR-33373p和miR-137降低了Ishikawa和HEC-1A细胞的迁移和侵袭能力(图5C和5D)。流式细胞术检测并分析细胞周期分布(图5E)。以上实验结果证实,与miR-NC组相比,miR-337-3p和miR-137过表达显著抑制了细胞的增殖、侵袭和迁移。

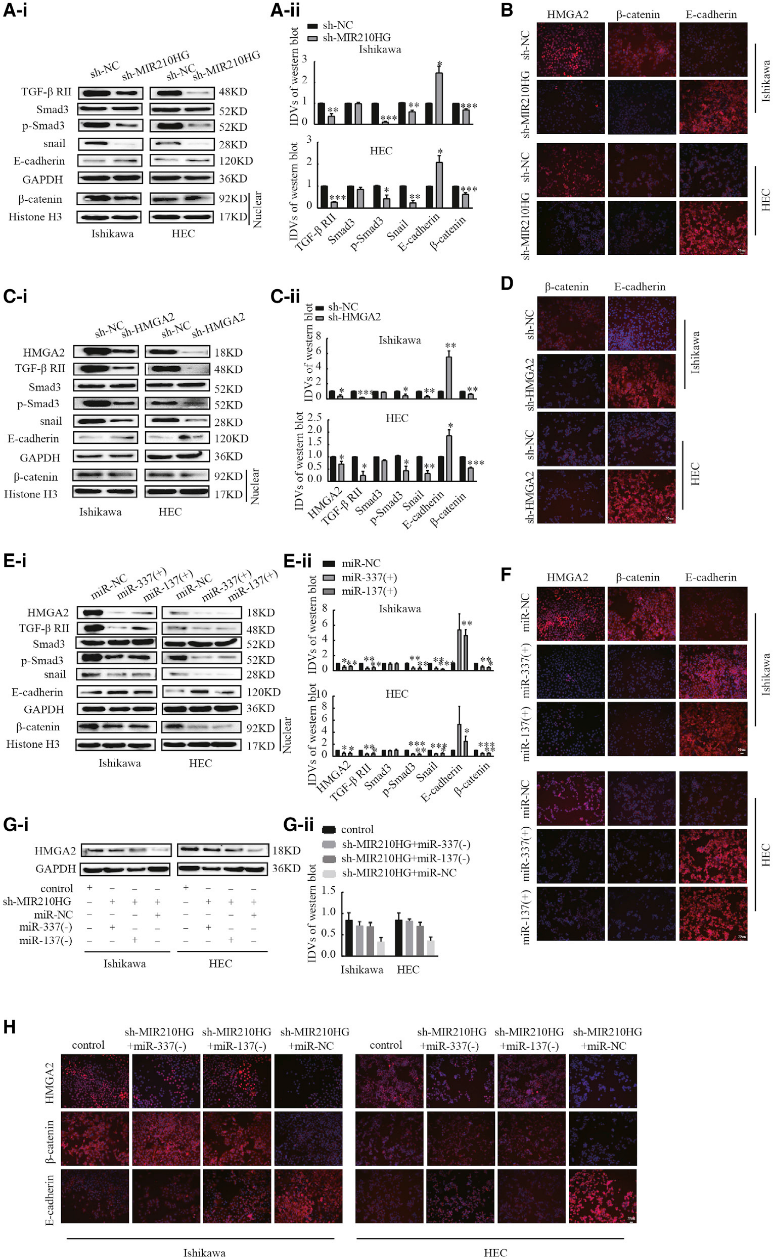
6)沉默MIR210HG可以通过miR-337-3p/137-HMGA2轴阻断TGF-b和Wnt信号通路
之前的GSEA表明MIR210HG与TGFb/Smad3和Wnt/b-catenin信号通路相关。为了进一步研究MIR210HG调控子宫内膜癌细胞进展的机制,我们检测了MIR210HG、HMGA2、miR-337-3p和miR-137对TGF-b、Wnt和EMT通路相关蛋白水平的调控作用。MIR210HG的下调降低了TGF-bII、p-Smad3和Snail的表达以及b-catenin在细胞核中的分布(图6A和6B)。基于这些结果,我们推测MIR210HG可能通过靶向miR-3373p/137-HMGA2调控轴抑制EMT、TGF-b和Wnt信号通路。干扰HMGA2显著降低TGF-bII、p-Smad3和Snail的表达,b-catenin在细胞核中的分布(图6C和6D)。我们之前曾报道过HMGA2在Ishikawa和HEC-1A细胞系中调节Snail、Slug、N-cadherin、MMP-2和MMP-9的表达。我们接下来研究了miR-337-3p/137表达的诱导是否影响TGF-b、Wnt和EMT通路相关蛋白的水平。结果显示,过表达miR-337-3p和miR-137抑制了HMGA2、TGF-bII、p-Smad3和Snail的表达(图6E和6F)。agomir-3373p/137处理和sh-MIR210HG-或sh- HMGA2处理Ishikawa和HEC-1A细胞中,b-catenin在细胞核中的分布减少,E-cadherin的表达增加。然后,我们研究了MIR210HG是否通过改变miR-337-3p/137-HMGA2轴来影响EMT进展。Western blotting和免疫荧光结果显示,MIR210HG的下调降低了Ishikawa和HEC1A细胞中HMGA2蛋白的表达,而加入miR-337-3p/137抑制剂后,对HMGA2、b-catenin和E-cadherin表达的抑制作用被逆转(图6G和6H)。
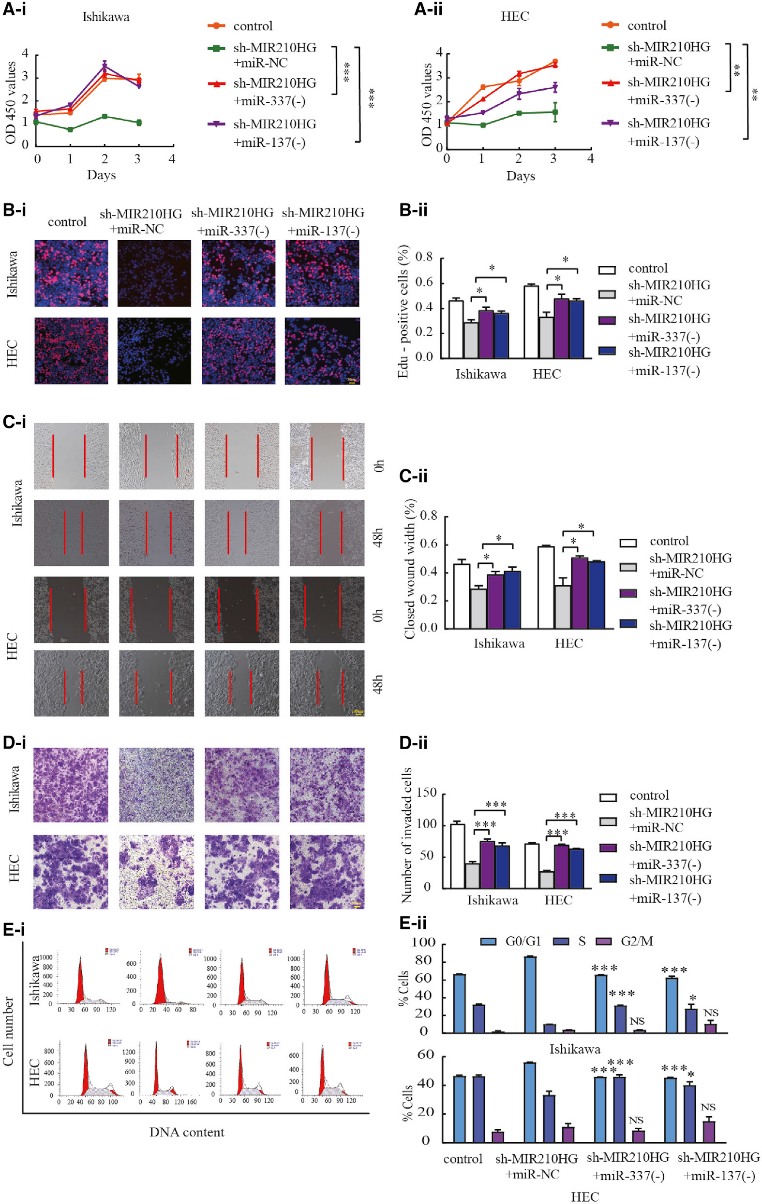
7) MIR210HG通过miR-337-3p和miR-137促进肿瘤进展
为了确定MIR210HG下调对Ishikawa和HEC-1A细胞系恶性行为的抑制作用是否通过miR-337-3p/137介导,我们进行了功能挽救实验。结果证实MIR210HG沉默对Ishikawa和HEC-1A细胞迁移和侵袭的恶性抑制作用被miR-337-3p/137敲低显著逆转(图7A-7E)。这表明MIR210HG通过miR-337-3p/137调控Ishikawa和HEC-1A细胞的恶性生物学行为。
8)抑制MIR210HG和miR-337-3p/137过表达抑制肿瘤生长
我们测定了MIR210HG和miR-337-3p/137在体内肿瘤模型中的功能。裸鼠实验中,每组实验小鼠3只。结果表明与对照组相比,转染sh-MIR210HG并过表达miR-337-3p和miR-137降低了肿瘤体积(图8A)。转染shMIR210HG并同时过表达miR-337-3p和miR-137的组肿瘤体积最小。免疫组化分析显示,与单独转染agomir-337-3p/137和sh-MIR210HG组相比,共转染组HMGA2和Ki-67的表达较低(图8B)。
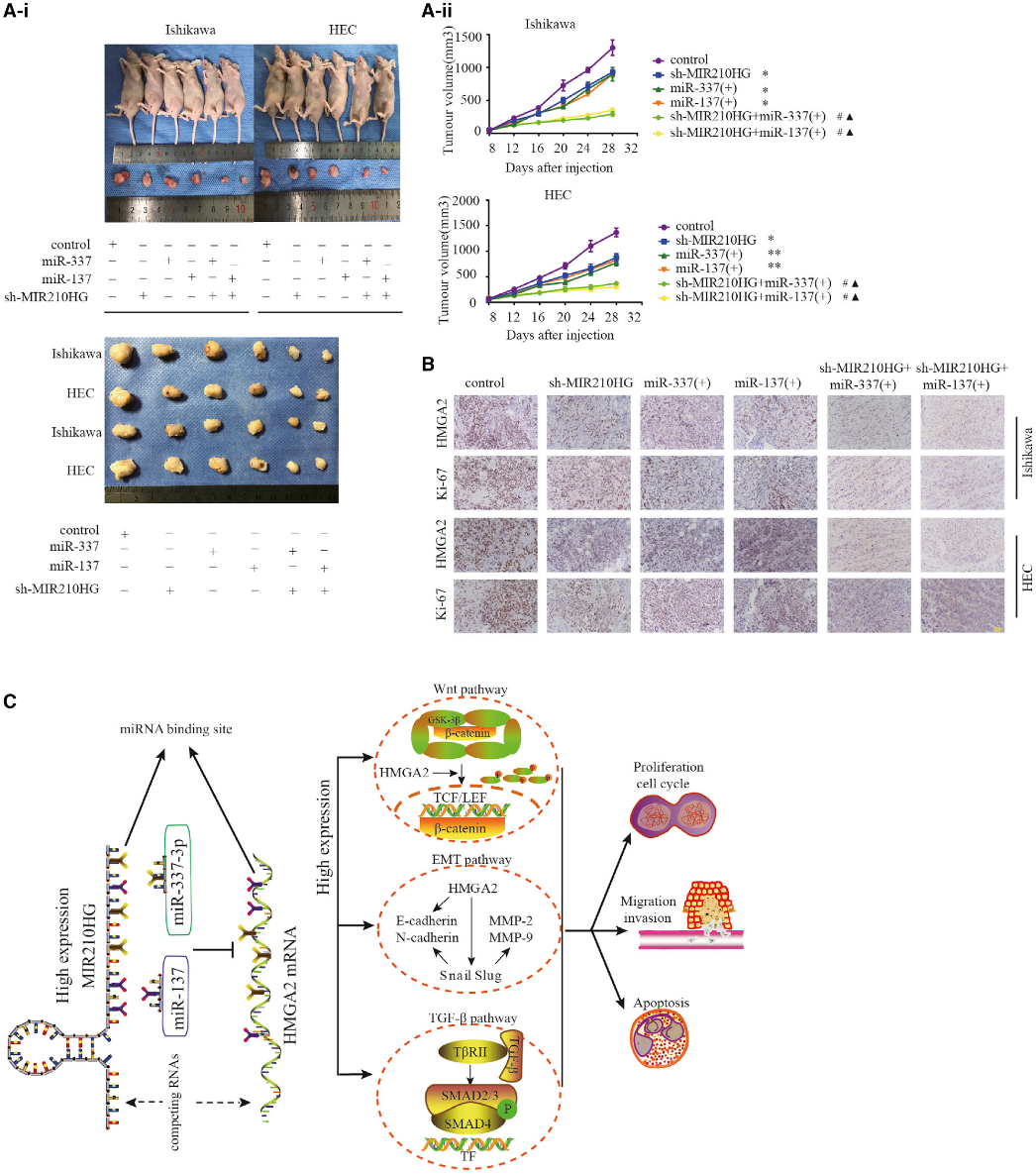
结论:MIR210HG在子宫内膜癌患者中是一个独立的预后因素,干扰MIR210HG的体内外表达可抑制子宫内膜癌细胞的恶性表型。MIR210HG-miR-337-3p/137被发现介导HMGA2调节子宫内膜癌细胞恶性行为的能力。MIR210HG-miR-337-3p/137-HMGA2轴是新的子宫内膜癌分子预后标志物和潜在的治疗靶点。






