USP35通过靶向铁转运蛋白调节肺癌铁死亡
铁死亡对调节肿瘤生长至关重要,是一种很有前途的肺癌治疗靶点。泛素特异性蛋白酶35 (USP35)属于deubiquitinases家族,与细胞增殖和有丝分裂有关。于2021年4月发表于“Clin. Transl. Med”(IF=11.492)的文章“Deubiquitinase USP35 modulates ferroptosis in lung cancer via targeting ferroportin”对此展开了研究。本研究旨在阐明USP35在肺癌中的潜在作用和分子基础。研究表明USP35在人肺癌组织和细胞系中大量存在。USP35敲除促进铁死亡,抑制肺癌细胞的细胞生长、集落形成和肿瘤进展。USP35过表达在基础条件下不影响肿瘤发生和铁死亡,但减少erastin/RSL3触发的铁紊乱和铁死亡,从而促进肺癌细胞生长和肿瘤进展。进一步的研究确定USP35直接与铁转运蛋白(FPN)相互作用,并作为一种双激酶来维持其蛋白质稳定性。更重要的是,我们观察到USP35敲除使肺癌细胞对顺铂和紫杉醇化疗敏感。总而言之,USP35通过靶向FPN调节肺癌铁死亡,是一个很有前途的肺癌治疗靶点。

技术路线

结果
1)USP35敲除抑制肺癌细胞生长、集落形成和肿瘤进展
我们首先检测了肺癌组织和细胞系中USP35丰度的变化。如图1A所示,USP35在肺ADC和SCC肿瘤中都显著上调。与正常的BEAS2B和HBE肺上皮细胞系相比,USP35 mRNA水平在肺癌细胞系(A549、H358、H460、H1299和H1650)中也高度表达(图1B)。鉴于H460和H 1299细胞中USP35 mRNA的丰度较高,我们在下一项研究中使用了这两种细胞系。与mRNA水平一致,在H460和H1299细胞中USP35蛋白也增加了(图1C)。为了阐明USP35在肺癌发病机制中的作用,我们在H460和H1299细胞中沉默了USP35(图1D)。有趣的是,USP35敲除抑制了H460和H1299细胞在体外的生长能力和集落形成(图1E、F)。来自肿瘤异种移植实验的数据进一步表明,USP35沉默抑制了25天生长后的肿瘤体积和重量(图1G,H)。总之,USP35在调节肺癌细胞生长和肿瘤进展中起着关键作用。

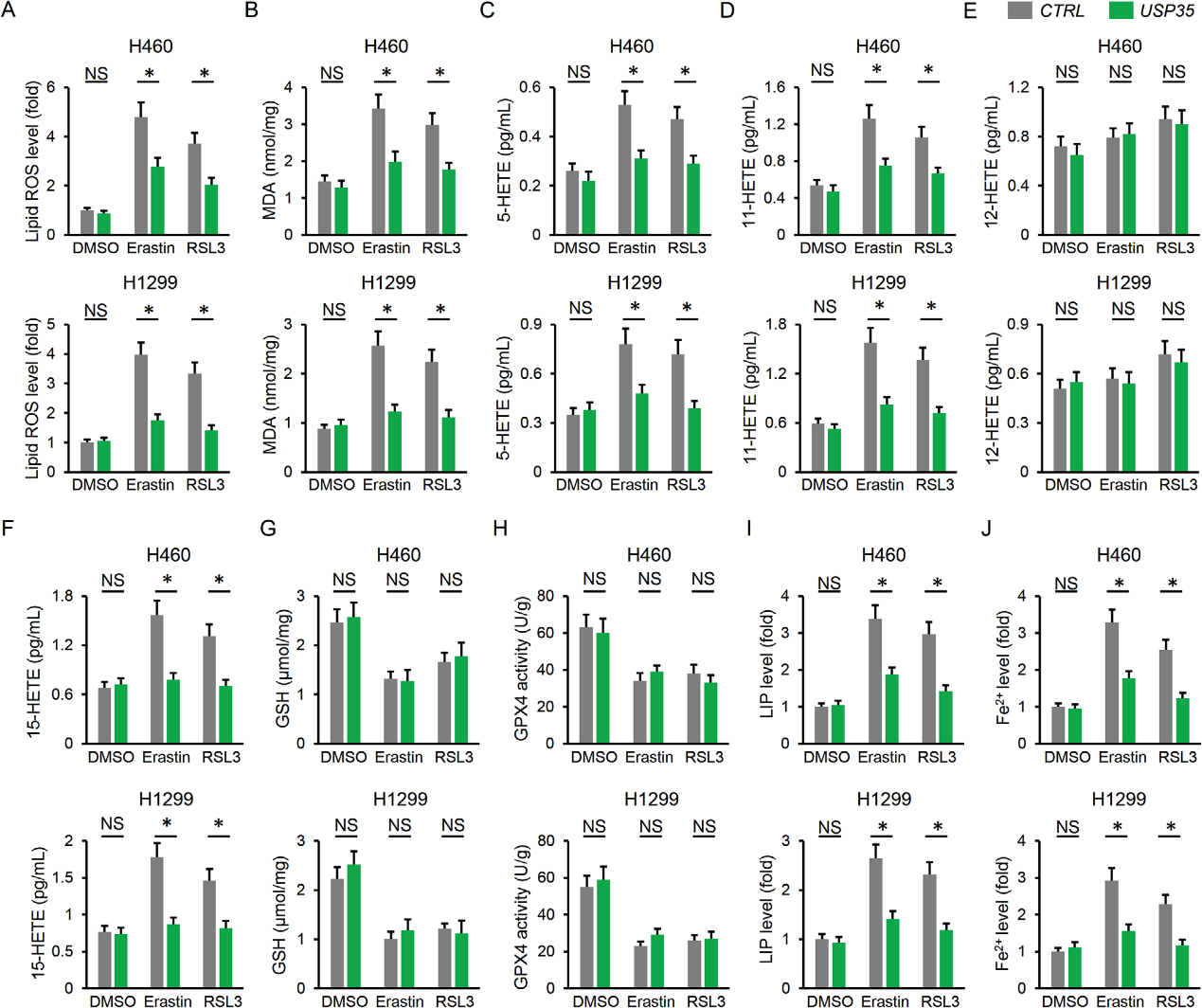
2)USP35敲除促进肺癌细胞的铁死亡
我们研究了shUSP35介导的肿瘤抑制是否可归因于细胞死亡的诱导。如图2A,B所示,用Nec-1,Z-VAD和CQ治疗以抑制坏死、凋亡和自噬并不影响细胞凋亡,表明可能涉及其他形式的细胞死亡。铁死亡是一种新的调节性细胞死亡,它与包括肺癌在内的肿瘤生长的发病机制有关。因此,我们使用两种铁死亡抑制剂,Fer-1和Lip-1,探索了铁死亡是否导致USP35沉默后的肺细胞死亡。如图2A,B所示,铁死亡抑制阻断了H460和H1299细胞中shUSP35介导的细胞死亡。在shUSP35感染的细胞中,集落形成被抑制,但被Fer-1和Lip 1破坏(图2C)。USP35敲除增加了脂质活性氧的产生和丙二醛的产生(图2D)。过量的活性氧导致多不饱和脂肪酸氧化损伤并分裂成各种产物,包括HETEs。我们观察到,USP35沉默促进了H460和H1299细胞中5-HETE、11-HETE和15-HETE的释放,而不影响12-HETE的释放(图2F)。GSH/GPX4为基础的ROS清除机制在防止铁缺乏期间的脂质过氧化中起着不可或缺的作用。研究表明在USP35缺乏的细胞中GSH水平降低并伴随着对GPX4活性的抑制(图2G,H)。此外,shUSP35感染细胞中的铁和Fe2+水平显著高于对照组。相比之下,补充GSH或铁螯合剂显著减少了shUSP35感染细胞的细胞死亡和集落形成(图2K,L)。因此,我们得出结论,铁死亡有助于USP35敲除诱导的肺癌细胞死亡。

3)USP35过表达阻断erastin/RSL3介导的肿瘤抑制作用
细胞也用慢病毒载体感染以在体外过表达USP35,并通过PCR验证其效率(图3A)。然而,在基础条件下,USP35过表达不影响H460和H1299细胞的细胞死亡和集落形成(图3B,C)。裸鼠的肿瘤体积和重量也不受USP35过表达的影响(图3D,E)。我们进一步研究了USP35操作是否对铁刺激引起的细胞死亡有影响。不出所料,erastin或RSL3处理显著降低了H460和H1299细胞的细胞活力或集落形成,而这是通过USP35过表达来阻止的(图3F,G)。相应地,接种CTRL肺癌细胞的裸鼠在erastin或RSL3治疗后肿瘤体积和重量减少;然而,这些肿瘤抑制作用被USP35过表达阻断(图3H,I)。总的来说,USP35过表达阻断了erastin/RSL33介导的肿瘤抑制作用。

4)USP35过表达减少erastin/RSL3触发的铁紊乱和铁死亡
erastin和RLS3诱导的ROS和MDA生成因USP35过表达而减少(图4A,B)。此外,在erastin和RLS3处理的癌细胞中,HETEs水平升高,但在除12-HETE外的USP35过表达的癌细胞中,HETEs水平降低(图4C,F)。然而,USP35过表达对GSH含量和GPX4活性没有影响(图4G,H)。如图4I,J所示,USP35的过表达显著减弱了用erastin或RSL3刺激H460和H1299细胞诱导LIP和Fe2+的作用。与表型改变一致,在基础条件下,USP35过表达对铁代谢和铁死亡也没有影响(图4A,J)。H460和H1299细胞是表皮生长因子受体(EGFR)野生型细胞,我们进一步确定了在EGFR突变的H1650细胞中,USP35对细胞生长、铁死亡诱导和肿瘤生长的作用。如图5A-C所示,USP35沉默显著减少了H1650细胞生长、集落形成和肿瘤进展。因此,在USP 35缺陷型H1650细胞中,ROS生成、MDA生成、细胞内LIP和Fe2+增加,而GSH水平和GPX4活性降低(图5D-F)。相反,USP35过表达显著阻止了erastin/RSL3诱导的体内外对H1650细胞生长、集落形成和肿瘤进展的抑制(图5G-J)。在H1650细胞中过表达USP35也降低了ROS生成、MDA产生和铁负荷的增加(图5K-M)。总的来说,USP35过表达减少了erastin/RSL3触发的铁紊乱和铁死亡。

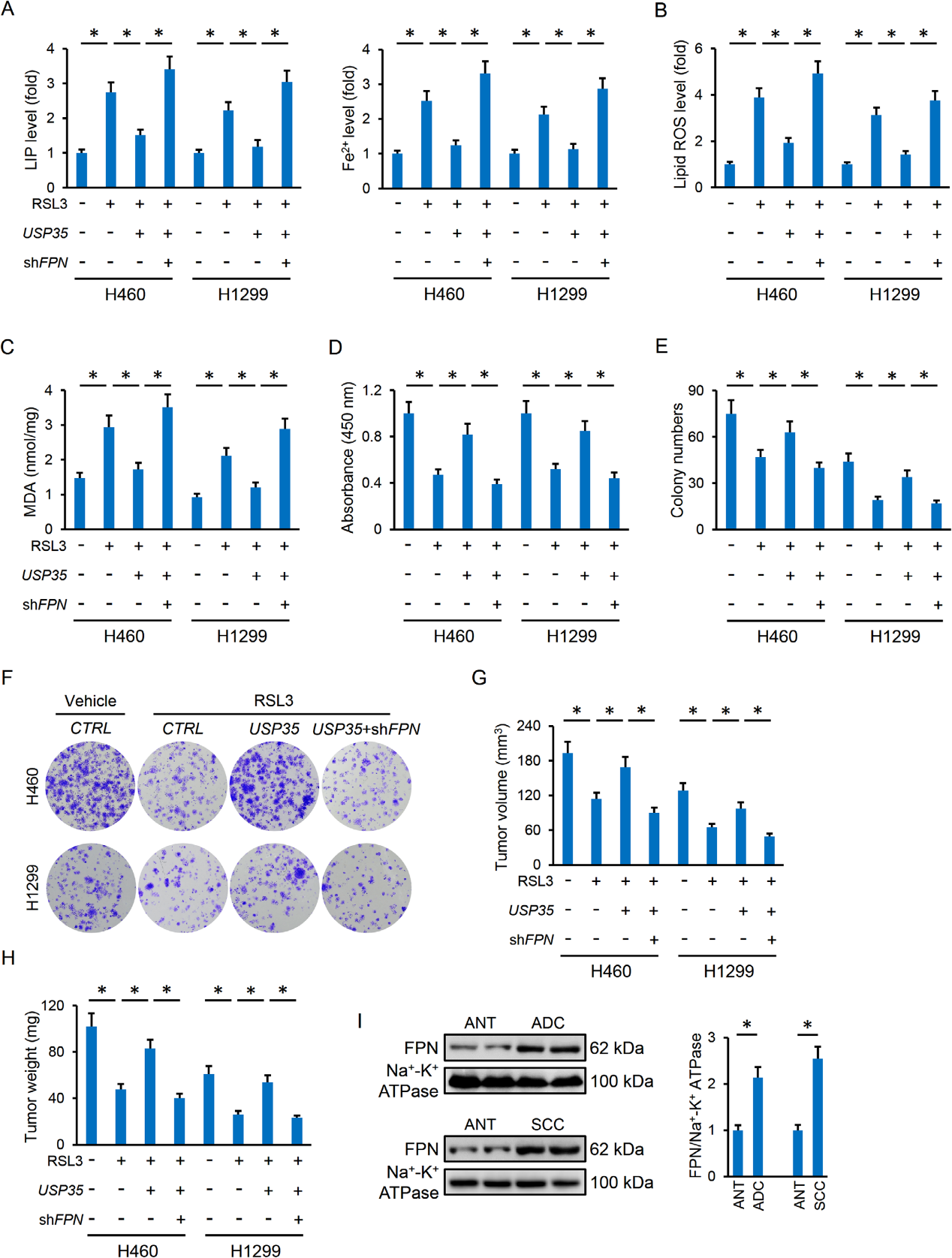
5)USP35通过靶向FPN调节铁下垂
我们接下来试图阐明USP35对铁死亡的可能机制。负责铁输入的蛋白质(Tf和TfR)没有改变;然而,哺乳动物中关键的铁转运蛋白FPN在USP35缺乏的细胞中减少,而在过表达的细胞中增加(图6A-C)。在USP35过表达的癌细胞中,细胞膜中的FPN蛋白丰度增加,但由于USP35的敲除而降低(图6D)。与分子变化一致,在USP35沉默或过表达的细胞中,胱氨酸摄取也不受影响(图6E)。为了进一步证实FPN的参与,H460和H1299细胞分别预感染shFPN以敲低内源性FPN表达。USP35过表达在铁刺激时降低了肺癌细胞内LIP和Fe2+,但在FPN缺陷细胞中未能做到这一点(图6F)。此外,在敲除内源性FPN后,USP35过表达引起的ROS和丙二醛生成的减少也被减缓(图6G)。我们还评估了体内和体外RSL3治疗后FPN在肺癌细胞或肿瘤异种移植中的作用。如图7A-C所示,FPN敲除恢复了USP35过表达肺癌细胞的细胞内LIP和Fe2+水平,同时增加了ROS和MDA的形成。与此同时,FPN敲除后,由于USP35过表达而增加的细胞活力和集落形成也被逆转(图7D-F)。根据体外数据,FPN敲除后,USP35过表达细胞的肿瘤体积和重量均有所减少(图7G,H)。更重要的是,我们发现FPN的膜分布在肺ADC和SCC肿瘤中显著增加(图7I)。综上所述,这些数据表明FPN是USP35调节铁死亡和肿瘤进展的潜在靶点。

6)FPN蛋白在肺癌细胞中的稳定性需要USP35
USP35属于DUBs家族,在控制各种蛋白质的Ub依赖性降解中起关键作用。此外,FPN泛素化和随后的内吞作用导致铁超载和铁死亡。因此,我们研究了USP35是否通过影响其蛋白质稳定性来调节FPN表达。如图8A所示,USP35敲除增加,而USP35过表达降低泛素化FPN水平。用MG132蛋白酶体抑制剂治疗后,shUSP35感染细胞的全部或膜裂解物中FPN水平的降低被阻止(图8B)。随后,我们检查了USP35是否是FPN的直接结合伙伴。IP分析的数据揭示了内源性USP35和FPN之间的联系(图8C)。总之,这些数据表明USP35可以直接与FPN相互作用,并作为deubiquitinase发挥作用,以保持其蛋白质稳定性。

7)USP35敲除增强肺癌细胞的化疗敏感性
鉴于USP35在肺癌细胞中的高表达及其在调节铁死亡中的作用,我们最终评估了USP35沉默是否能使肺癌细胞对化疗药物敏感。如图9A-C所示,USP35缺乏的H460和H1299细胞在体外对DDP和PTX的毒性作用更敏感,细胞活力和定殖的降低证明了这一点。相应地,接种USP35缺陷癌细胞的荷瘤小鼠经DDP或PTX治疗后肿瘤体积和重量均减少(图9D,E)。酪氨酸激酶抑制剂(TKI)已成为常规化疗的替代药物,并为肺癌患者提供了显著的生存益处。然后,我们在H460和H1299细胞中测量了USP35敲除和TKI之间的协同效应,数据表明USP35沉默在体内和体外使H460和H1299细胞对GFB化疗敏感(图9F-H)。值得注意的是,EGFR突变的肺癌细胞对TKI更敏感,因此我们评估了USP35沉默是否会使H1650细胞对GFB化疗敏感。如图9I,J所示,USP35沉默进一步抑制了GFB治疗后H1650细胞的生长、集落形成和肿瘤进展。总的来说,USP35缺乏的肺癌细胞对化疗药物更敏感。

结论:FPN蛋白稳定性和肺癌细胞的铁输出需要USP35,从而保持细胞内铁稳态和肿瘤生长。而USP35敲除通过减少游离铁输出增加细胞内LIP水平和铁死亡,并伴随着肺癌细胞生长、定殖和肿瘤形成的减少,以及对DDP和PTX化学敏感性的增加。因此USP35是一个很有前途的肺癌治疗靶点。






