癌症免疫治疗新贡献——单胺氧化酶A
靶向肿瘤相关巨噬细胞(TAMs)是一种很有前途的策略,可以改变免疫抑制肿瘤微环境,改善肿瘤免疫治疗。单胺氧化酶A (MAO-A)是一种因其在大脑中的功能而著名的酶,小分子MAO抑制剂(MAOIs)用于临床治疗神经系统疾病。这里作者发现MAO-A诱导人和小鼠的TAMs进而可用于癌症的免疫治疗。该文2021年6月发表于《nature communications》IF:14.919期刊上。
技术路线:

主要实验结果:
1、MAO-A缺陷小鼠显示与TAM极化改变相关的肿瘤生长减少
将同基因B16-OVA黑色素瘤接种给C57BL/6J小鼠,分离出TAM并评估TAM基因表达谱。除了参与调节巨噬细胞免疫应答的经典基因的变化,还观察到一个Maoa基因在TAMs中的上调表达(图1a),这表明MAO-A可能参与了TAM活性的调节。首先构建MAO-A缺陷的小鼠,然后接种B16-OVA黑色素瘤细胞,结果显示,与野生型相比,MAO-A缺陷小鼠的肿瘤生长被显著抑制(图1b-d)。流式检测TAM的标志物表达,结果显示MAO-A缺陷小鼠表现出更少的免疫抑制表型,即免疫抑制标志物CD206表达显著下调,而免疫刺激分子CD9,CD86和MHC class II I-Ab的表达上调(图1e-h)。进一步的分析显示,来自Maoa KO小鼠的TAMs免疫抑制相关基因表达水平降低,如Mrc1,Chi3l3和Arg1(图1i),而免疫刺激相关基因表达上调,如Il6,Tnfα和Ccl2(图1j)。作者对野生型和Maoa KO小鼠进行单细胞测序,分析了肿瘤浸润免疫细胞(TIIs)。结果显示TIIs由六种细胞组成,即TAM/Mono, T cell, NK cell, B cell, DC and pDC(图1k)。两种小鼠细胞类别分布相似。而TAM/Mono亚群由5种细胞类别组成,即TAM_1, TAM_2, Mono_1, Mono_2 and Mono_3(图1k)。与Maoa KO小鼠的TAMs免疫表型减少一致,与野生型相比,其TAM亚群中TAM_1(Mrc1lowCd86high)比TAM_2(Mrc1 highCd86 low)的比例下降(图1l)。免疫相关基因表达表现出一致的趋势(图1m-n)。这些结果强烈表明MAO-A是参与调节TAM极化进而调控抗肿瘤免疫的。

图1 MAO-A缺陷小鼠显示与TAM极化改变相关的肿瘤生长减少
2、MAO-A直接调节TAM极化并影响TAM相关的T细胞抗肿瘤活性
为了确定MAO-A是否直接调节免疫细胞,进行一个骨髓(BM)转移实验,从Maoa WT或KO小鼠中获得的BM细胞被连续转移到BoyJ (CD45.1) WT受体小鼠中,然后该小鼠接受B16-OVA黑色素瘤细胞接种(图2a)。在本实验中,MAO-A缺乏的比较仅限于免疫细胞。结果显示免疫细胞中MAO-A缺陷导致肿瘤生长抑制(图2b-c),改变TAM极化(图2d-f),增强肿瘤浸润CD8+T细胞激活,表明MAO-A直接调节免疫细胞抗肿瘤活性,特别是TAM极化和T细胞抗肿瘤反应。
为了进一步研究MAO-A是否作为巨噬细胞自主因子直接调控TAM极化从而影响抗肿瘤免疫,进行了巨噬细胞过继转移肿瘤实验。从Maoa WT和KO小鼠中获取BM细胞,然后培养成骨髓源性巨噬细胞(bone marrow macrophages, BMDMs)。然后将这些Maoa WT或KO BMDMs与B16-OVA黑色素瘤细胞混合,皮下注射到BoyJ WT受体小鼠中建立实体肿瘤(图2g)。在本实验中,MAO-A缺乏的比较仅限于TAM细胞。在接受Maoa KO BMDMs小鼠中观察到肿瘤生长抑制(图2h-i),TAM免疫抑制markers下调(图2j),免疫刺激markers上调(图2k-l),以及增强肿瘤浸润CD8+T细胞激活(图2m)。综上所述,这些体内研究表明MAO-A作为一种直接调节TAM极化的自主因子,从而影响T细胞抗肿瘤反应性和影响肿瘤生长。
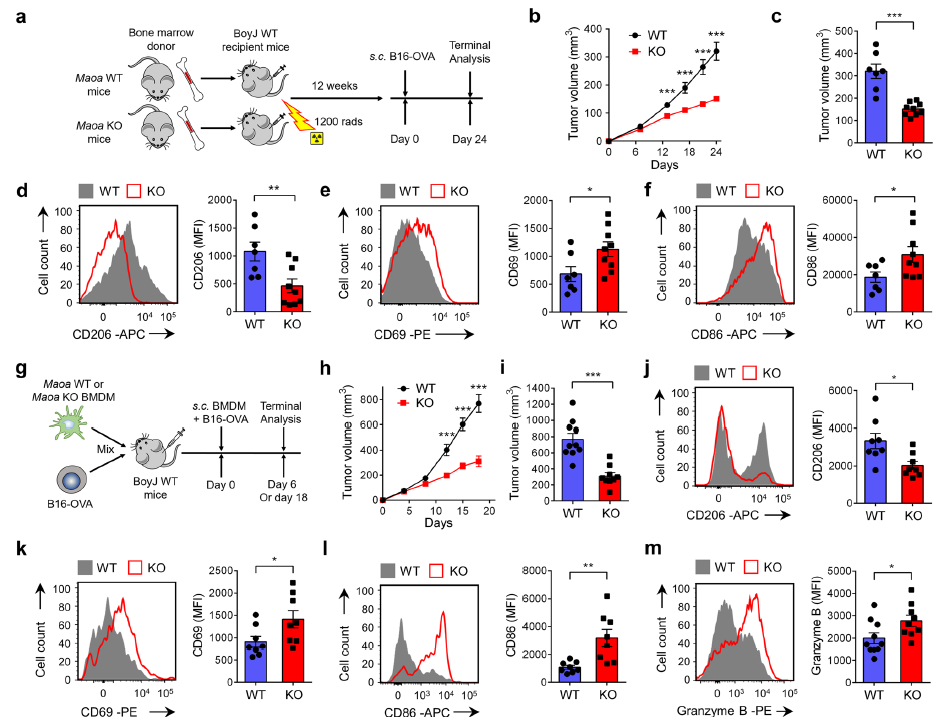
图2 MAO-A直接调节TAM极化并影响TAM相关的T细胞抗肿瘤活性
3、MAO-A促进巨噬细胞免疫抑制极化
为了研究MAO-A对巨噬细胞极化的调控,体外培养Maoa WT和KO BMDMs,并通过添加抗炎刺激(IL4和IL-13)使这些巨噬细胞向免疫抑制表型极化(图3a)。观察到,在M - CSF诱导的巨噬细胞分化过程中,Maoa mRNA的表达在Maoa野生型BMDMs中有明显的诱导作用,Maoa在成熟的BMDMs中表达趋于稳定,并维持IL-4/ IL -13诱导的免疫抑制极化(图3b-c)。Maoa KO BMDMs中MAO-A表达未检测到,证实了其MAO-A缺失基因型(图3b, d)。与野生型巨噬细胞相比,在IL-4/IL-13刺激下,Maoa KO巨噬细胞表现出更低的免疫抑制表型,这在其免疫抑制标记物的表达减少中得到了证明(图3e-g)。在巨噬细胞/T细胞共培养试验中(图3h),IL-4/ IL -13极化的Maoa KO巨噬细胞在抗CD3 /CD28刺激下,与免疫抑制表型的减弱一致,其对野生型CD8+ T细胞的抑制作用减弱(图3i-k)。
为了验证MAO-A缺乏是否直接有助于减轻Maoa KO巨噬细胞的免疫抑制极化,进行拯救实验。构建MIG-Maoa逆转录病毒载体,利用该载体转导Maoa KO BMDMs,并在这些巨噬细胞中实现了MAO-A的过表达(图3l-n)。MAO-A过表达显著加剧了IL-4/ IL-13刺激的Maoa KO BMDMs的免疫抑制表型(图3o-p)。综上所述,这些结果表明,MAO-A作为一种自主因子,在抗炎刺激下促进巨噬细胞免疫抑制极化。

图3 MAO-A促进巨噬细胞免疫抑制极化
4、MAO-A通过ROS上调促进巨噬细胞免疫抑制极化
接下来,研究调控MAO-A促进巨噬细胞免疫抑制极化的分子机制。据报道,细胞内活性氧(ROS;氧化应激)会引起巨噬细胞的免疫抑制特征。MAO-A催化单胺的氧化脱氨,从而产生过氧化氢(H2O2)作为副产物,可以增加细胞内ROS水平。因此,推测MAO-A可能通过上调TAM中的ROS水平,促进TME中TAM的免疫抑制极化(图4a)。为了验证这一假设,测量了从携带B16-OVA肿瘤的Maoa WT和KO小鼠中分离的TAMs中的ROS水平,并检测到Maoa KO TAMs中ROS水平显著降低(图4b-c)。对离体培养的Maoa野生型和KO BMMDs中ROS水平的测定也显示,在IL-4/IL-13刺激或不刺激下,Maoa KO BMMDs中ROS水平降低,与体内TAM结果一致(图4d)。向IL-4/ IL-13刺激的Maoa WT和KO BMDMs补充H2O2可将其细胞内ROS水平提高到相似水平,并消除它们在免疫抑制标记物和特征基因表达的差异(图4e-g)。另一方面,补充酪氨酸(MAO-A的底物)可增加ROS水平,并上调免疫抑制基因在Maoa WT BMDMs中的表达,但在Maoa KO BMDMs中不上调(图4h-j)。综上所述,这些数据表明MAO-A通过调节巨噬细胞内ROS水平来调节巨噬细胞的免疫抑制极化。
JAK-Stat6信号通路在介导IL-4/IL-13诱导TME中TAMs免疫抑制极化过程中起关键作用。IL-4/IL-13刺激后,JAK磷酸化,随后Stat6磷酸化,磷酸化后的Stat6二聚并迁移至细胞核,然后与IL-4/IL-13相应基因,包括那些参与巨噬细胞免疫响应功能的基因的启动子结合。据报道ROS可以促进JAK和Stat6磷酸化。因此,推测MAO-A可能通过上调ROS水平影响巨噬细胞极化,从而使JAK-Stat6信号通路敏感。事实上,直接分析从B16-OVA荷瘤Maoa WT和Maoa KO小鼠中分离的TAMs证实,与野生型TAMs相比,MAO - A缺陷的TAMs显示Stat6激活降低(图4k-l)。进一步分析IL-4/ IL-13诱导的JAK-Stat6信号通路,与在Maoa WT BMDMs中相比,在Maoa KO BMDMs中JAK-Stat6信号显著下降,补充H2O2可使其JAK-Stat6信号达到与WT类似水平(图4m)。这些数据表明MAO-A通过ROS致敏的JAK-Stat6通路激活促进巨噬细胞免疫抑制极化。
总之,这些体内外数据支持MAO-A促进TME中免疫抑制极化,通过上调TAM细胞内ROS水平,从而提高IL-4/ IL -13诱导的JAK-Stat6信号通路。
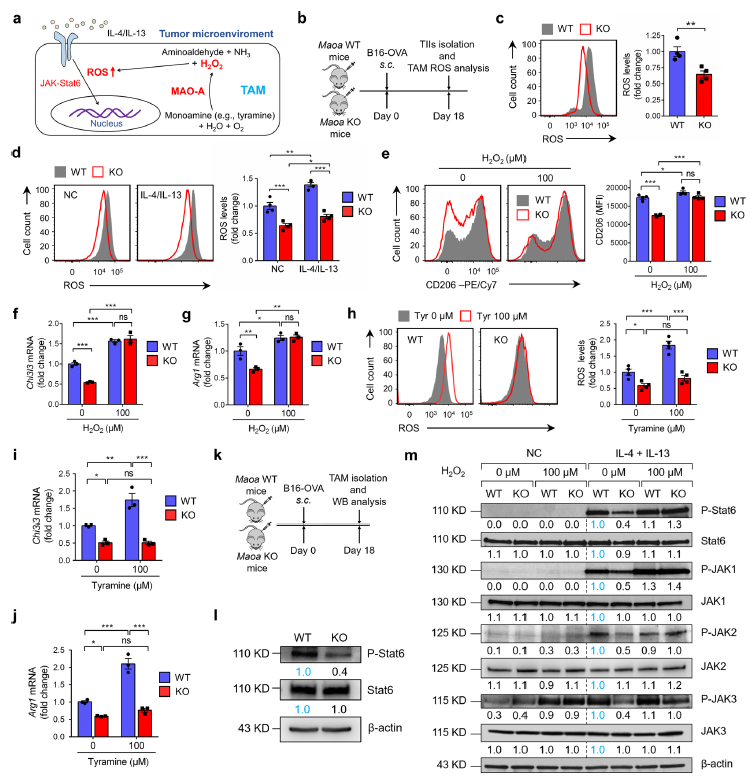
图4 MAO-A通过ROS上调促进巨噬细胞免疫抑制极化
5、MAO-A阻断肿瘤免疫治疗-小鼠肿瘤模型研究
MAO-A作为TAM免疫抑制极化的关键调控因子的鉴定使得MAO-A成为癌症免疫治疗的一个有前途的药物靶点。由于已知的MAO-A在大脑中的功能,小分子MAOIs已经被开发和临床用于治疗各种神经系统疾病,使其成为一种高度可行和有吸引力的方法来重新利用这些已建立的MAOI药物用于癌症免疫治疗。在体外IL-4/IL-13 诱导WT BMDM极化培养中(图5a),添加多种MAOIs可以有效降低BMDM中的ROS水平,抑制它们的免疫抑制极化和基因(图5b-e)。值得注意的是,图5a测试的MAOIs包括苯乙肼、克劳吉林、莫氯比胺和吡吲哚,涵盖了已建立的MAOIs的主要类别,这些类别是基于它们对MAO-A是非选择性的还是选择性的,以及它们的作用是否可逆。在这些MAOIs中,苯乙肼 (phenelzine商品名:Nardil)在美国临床可用。在接下来的研究中,以苯乙肼为代表,使用两种同基因小鼠肿瘤模型:B16-OVA黑色素瘤模型和MC38结肠癌模型,研究MAOIs用于癌症免疫治疗的可能性。值得注意的是,苯乙肼是一种非选择性不可逆的MAOI,可抑制MAO-A及其同工酶MAO-B。然而,由于小鼠巨噬细胞主要表达MAO-A,而不是MAO-B,因此在这些肿瘤模型中,苯乙肼治疗主要通过抑制MAO-A来调节TAM重编程。
首先,研究苯乙肼在B16-OVA肿瘤预防模型中的治疗潜力(图5f)。苯乙肼能有效抑制B6 WT小鼠B16-OVA肿瘤的生长(图5g-h)。当使用氯膦酸脂质体处理敲除小鼠TAM时,小鼠没有观察到肿瘤生长的差异(图5g-h),这表明苯乙肼通过调节TAMs来抑制肿瘤生长。相应地,从苯乙肼处理的小鼠中分离出的TAMs显示出较低的免疫抑制表型,表现为其免疫抑制标记物和特征基因的表达降低,而免疫刺激标志物增加(图5i-j)。在MC38肿瘤中得出类似结论。
接下来,评估苯乙肼联合治疗的潜力,特别是联合其他ICB治疗,如PD-1/PD-L1阻断治疗(图5k)。尽管大多数ICB疗法针对的是CD8+ T细胞,但这些细胞实际上受到TME中的TAMs的密切调控,使靶向TAMs成为免疫治疗的另一种潜在途径。在B16-OVA和MC38肿瘤模型中,苯乙肼治疗显著抑制了预先建立的实体肿瘤的进展,其水平与抗PD -1治疗相当,重要的是,苯乙肼与抗PD-1联合治疗具有协同抑制肿瘤的疗效(图5l-o)。总的来说,这些小鼠肿瘤模型研究为MAOIs通过靶向TAM重编程从而增强抗肿瘤T细胞反应的癌症免疫治疗潜力提供了证据。
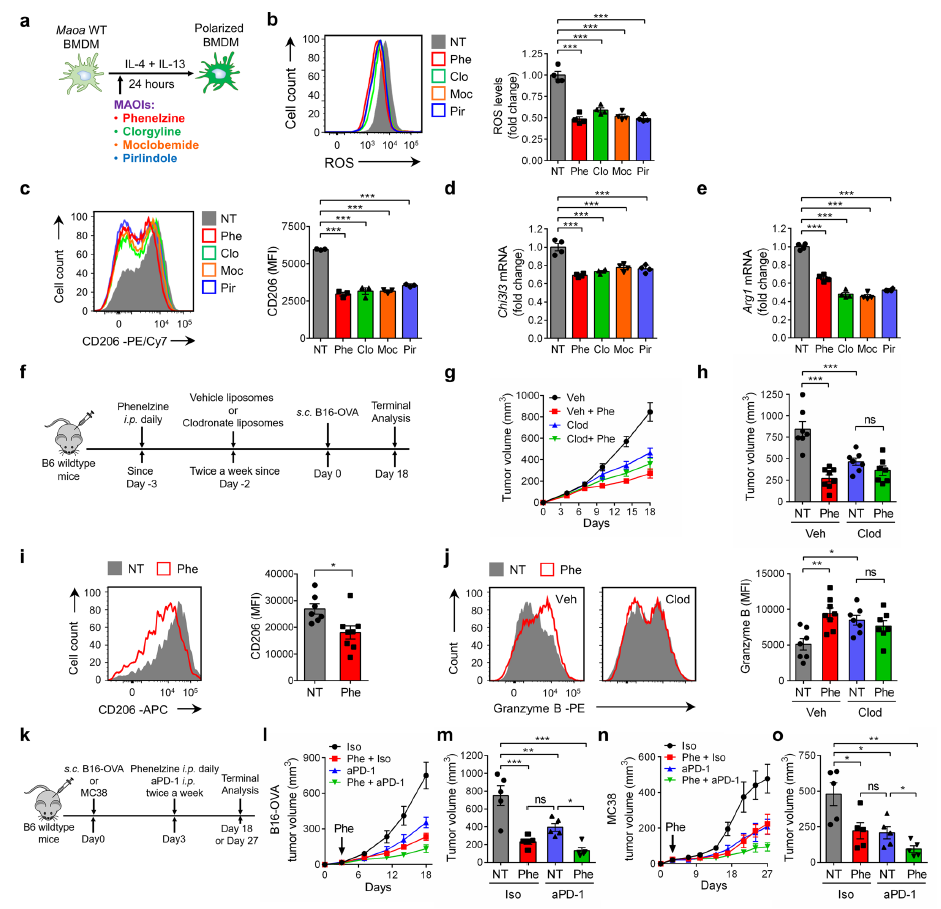
图5 MAO-A阻断肿瘤免疫治疗-小鼠肿瘤模型研究
6、MAO-A阻断肿瘤免疫治疗-人类TAM和临床数据相关性研究
为了探索MAO-A阻断治疗的翻译潜力,首先研究了MAO-A对人巨噬细胞极化的调控。分析体外培养的免疫刺激M1样和免疫抑制M2样人单核细胞源性巨噬细胞的基因表达特征。有趣的是,在所有检测的免疫检查点、免疫刺激和免疫抑制基因中,MAOA是M2样单核来源巨噬细胞(MDMs)中表达水平最高的基因(图6a),提示MAO-A可能在促进人巨噬细胞免疫抑制极化中发挥作用。MDM培养的时间过程分析证实了巨噬细胞分化过程中MAO-A基因和蛋白表达上调,并在IL-4/IL-13诱导的免疫抑制极化后进一步上调(图6b-d)。用苯乙肼阻断MAO-A可显著抑制IL-4/IL-13诱导的MDMs免疫抑制极化(图6e-g)。综上所述,这些体外数据表明MAO-A在人巨噬细胞中高表达,特别是在其免疫抑制极化期间,并且MAO-A阻断具有重新编程人巨噬细胞极化的潜力。
为了直接评价MAOIs是否能在体内重编程人TAM的极化,建立了人肿瘤/TAM异种移植NSG小鼠模型。A375人黑色素瘤细胞与健康供者外周血单个核细胞(PBMCs)分离的单核细胞混合,注射到NSG小鼠中形成实体瘤,接种后给予或不给予苯乙肼治疗(图6h)。苯乙肼能有效抑制人TAMs的免疫抑制极化(图6i-j)。
接下来,研究了MAOI诱导的人TAM重编程是否会影响人T细胞的抗肿瘤活性,使用3D人肿瘤/TAM/ T细胞类器官培养。NY-ESO-1是一种公认的肿瘤抗原,通常在多种人类肿瘤中表达,被选为模型肿瘤抗原。A375人黑素瘤细胞系设计为共表达NY-ESO-1及其匹配的MHC分子HLA-A2作为人肿瘤靶点(命名为A375-A2-ESO)。NY-ESO-1特异性人CD8+T细胞的构建是通过将Retro/ESO-TCR编码NY-ESO-1特异性TCR(命名为ESO-TCR)的逆转录病毒载体转导至健康供体外周血CD8+T细胞,将该细胞命名为ESO-T细胞,它表达ESO-TCRs,特异性靶向A375-A2-ESO肿瘤细胞,从而建立肿瘤特异性人CD8+ T细胞模型。将A375-A2-ESO人黑色素瘤细胞、ESO-T细胞和IL-4/IL-13极化的MDMs以2:2:1的比例混合,放置在模拟TME的3D肿瘤类器官培养物中(图6k)。IL-4/IL-13极化MDMs有效抑制ESO - T细胞介导的A375-A2-ESO肿瘤细胞的杀伤;在MDM极化过程中,苯乙肼的治疗在很大程度上缓解了这种免疫抑制作用(图6l)。因此,与苯乙肼处理的MDMs共培养的ESO-T细胞相比,与非苯肼处理的MDMs共培养的ESO-T细胞显示了T细胞活化的增强(图6m)。总的来说,这些数据表明MAOI诱导的人类TAM重编程具有改善抗肿瘤T细胞反应的潜力。此外,人和小鼠的TAM都高表达MAOA基因(图6n),证实MAO-A可作为人类TAMs的有效药物靶点。
最后,分析了MAOA基因表达水平与几种癌症病人临床预后的关系,结果显示瘤内MAOA基因与卵巢癌,淋巴癌和乳腺癌患者的临床总生存率呈现负相关关系(图6o-q)。此外,黑色素瘤患者肿瘤内高水平的MAOA表达很大程度上抵消了PD-1治疗提供的生存好处,提示MAO-A阻断治疗与PD-1/PD-L1阻断治疗联合可能通过调节TAM极化,从而改变免疫抑制TME,提高抗肿瘤免疫能力,提供协同治疗好处(图6r)。
综上所述,人类TAM和临床相关性研究证实了MAO-A作为人类TAM中一个有前途的药物靶点,并支持了MAO-A通过靶向TAM重编程阻断癌症免疫治疗的翻译潜力。

图6 MAO-A阻断肿瘤免疫治疗-人类TAM和临床数据相关性研究
参考文献:
Wang Yu-Chen., Wang Xi., Yu Jiaji., Ma Feiyang., Li Zhe., Zhou Yang., Zeng Samuel., Ma Xiaoya., Li Yan-Ruide., Neal Adam., Huang Jie., To Angela., Clarke Nicole., Memarzadeh Sanaz., Pellegrini Matteo., Yang Lili.(2021). Targeting monoamine oxidase A-regulated tumor-associated macrophage polarization for cancer immunotherapy. Nat Commun, 12(1), 3530. doi:10.1038/s41467-021-23164-2






