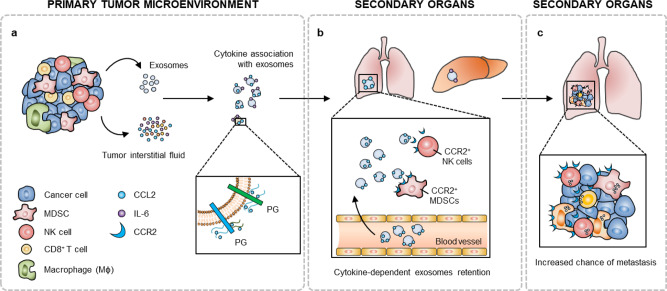
与癌症外泌体结合的肿瘤微环境细胞因子决定细胞因子受体表达细胞的摄取和生物分布
转移是癌细胞扩散到远端部位的过程,约占癌症死亡率的90%。据报道,转移起始肿瘤细胞显示了基本的内在特征,如细胞可塑性、迁移和侵袭能力增强、抗凋亡和免疫编辑。此外,原发性肿瘤可以释放细胞因子、生长因子和其他蛋白质因子,这些因子能够为循环癌细胞的到来启动远处组织,从而创造一个能够支持转移性生长的转移前生态位。癌细胞分泌囊泡,特别是外泌体,是已知的转移前生态位形成的基本介质。肿瘤细胞分泌的外泌体显着促进细胞间通讯和随后的肿瘤微环境重新编程。
今天我们讲一篇关于肿瘤外泌体分布吸收重塑免疫微环境的文章,该文章题名为Tumor microenvironmental cytokines bound to cancer exosomes determine uptake by cytokine receptor-expressing cells and biodistribution(IF=14.9),发表在Nature Communications期刊。
肿瘤微环境细胞因子影响器官特异性外泌体积累并促进转移
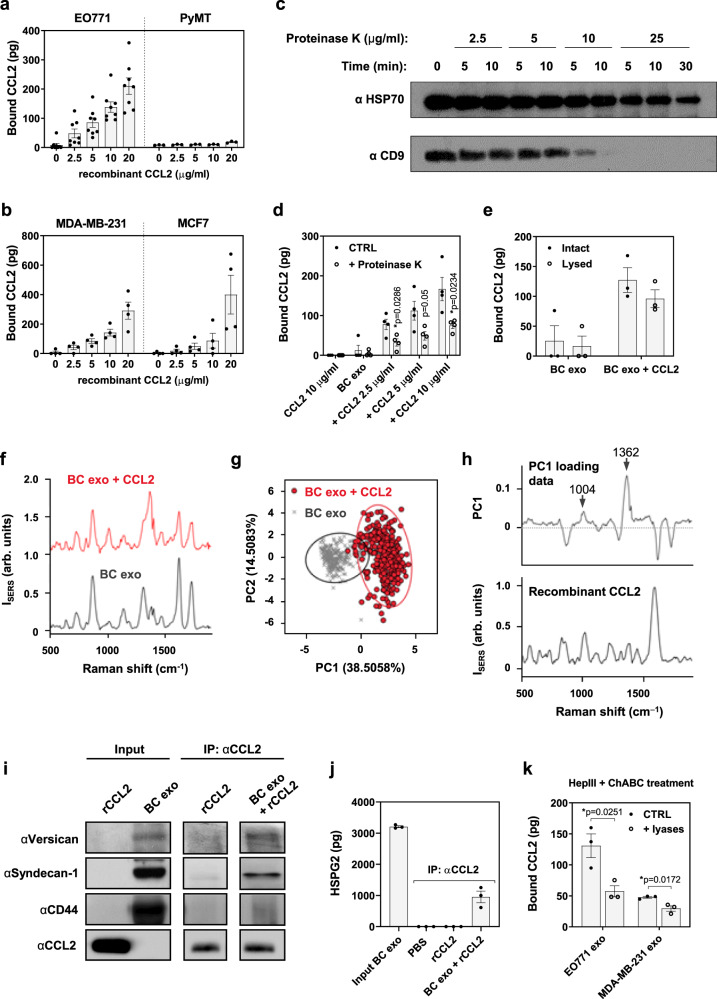
通过分析从健康受试者和乳腺癌(BC)患者的血浆中分离出的外显体,确定了许多与外泌体共同分离的细胞因子和生长因子,在BC患者来源的外泌体上发现了更丰富和多样性。特别是,当通过 ELISA 评估时,证实在来自 BC 患者的外泌体样品中更高水平的CCL2和IL-6表达。形成鲜明对比的是,从体外培养的 EO771 BC 细胞中分离出的纯外泌体在很大程度上缺乏细胞因子和生长因子。为了评估外泌体在细胞因子环境中的行为,从同基因、原位 EO771 癌肿块中获得了外泌体耗尽的肿瘤间质液 (TIF),其显示了一系列细胞因子和生长因子,包括CCL2和IL-6。将EO771细胞衍生的外泌体添加到这种外泌体耗尽的TIF中,随后重新分离外泌体以去除游离的未结合的可溶性因子,显示出特定外泌体/细胞因子关联的富集。例如,CCL2、IL-6 和 CXCL1 很容易共同分离,而 GM-CSF 则无法检测到。评估小鼠中与TIF衍生细胞因子缀合的EO771外泌体的行为,我们发现 TIF 缀合的外泌体以显着高于对照外泌体的丰度保留在各个器官中并导致白细胞摄取增加。几种免疫细胞谱系,包括 NK 细胞、巨噬细胞和单核细胞和粒细胞髓源性抑制细胞 (mMDSCs; gMDSCs )在肝脏、脾脏和肺中,与未结合的外泌体相比,TIF 外泌体的外泌体摄取量更高。
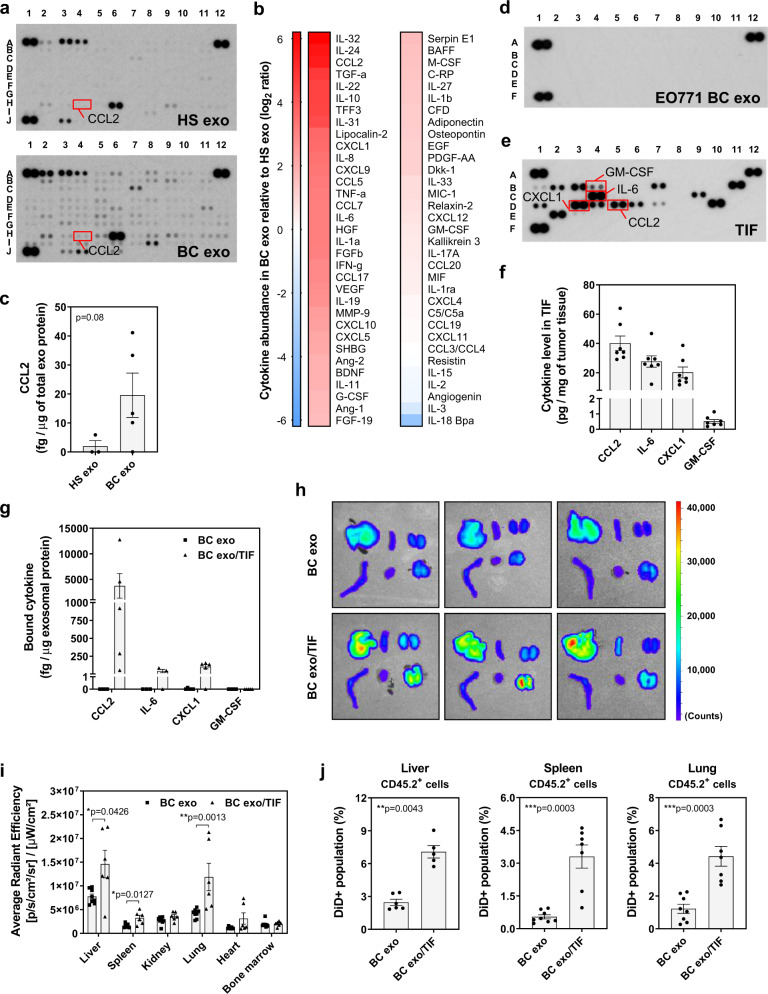
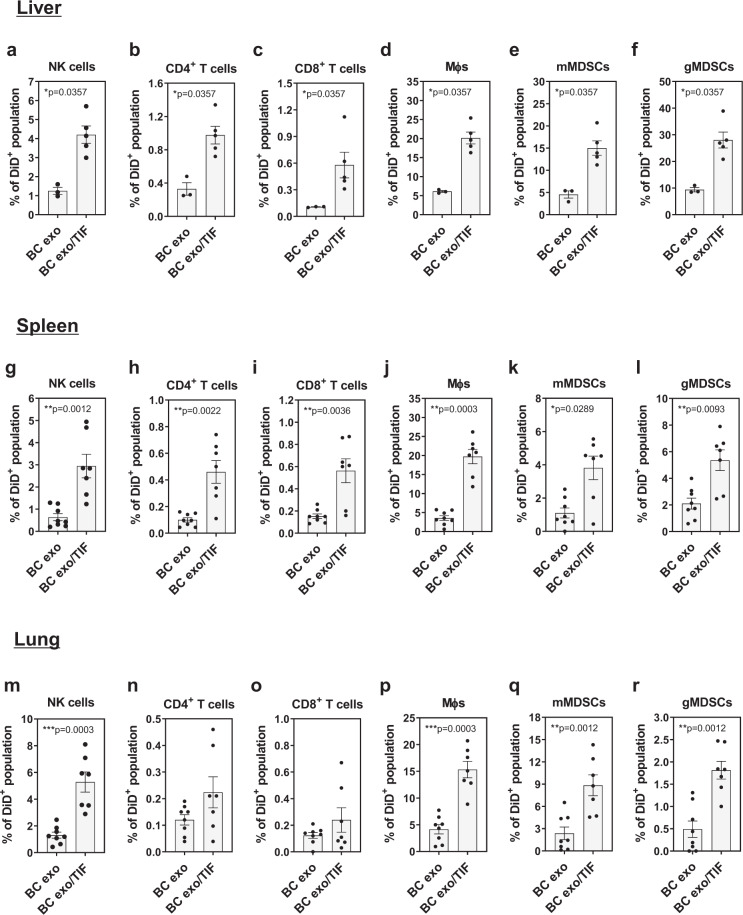
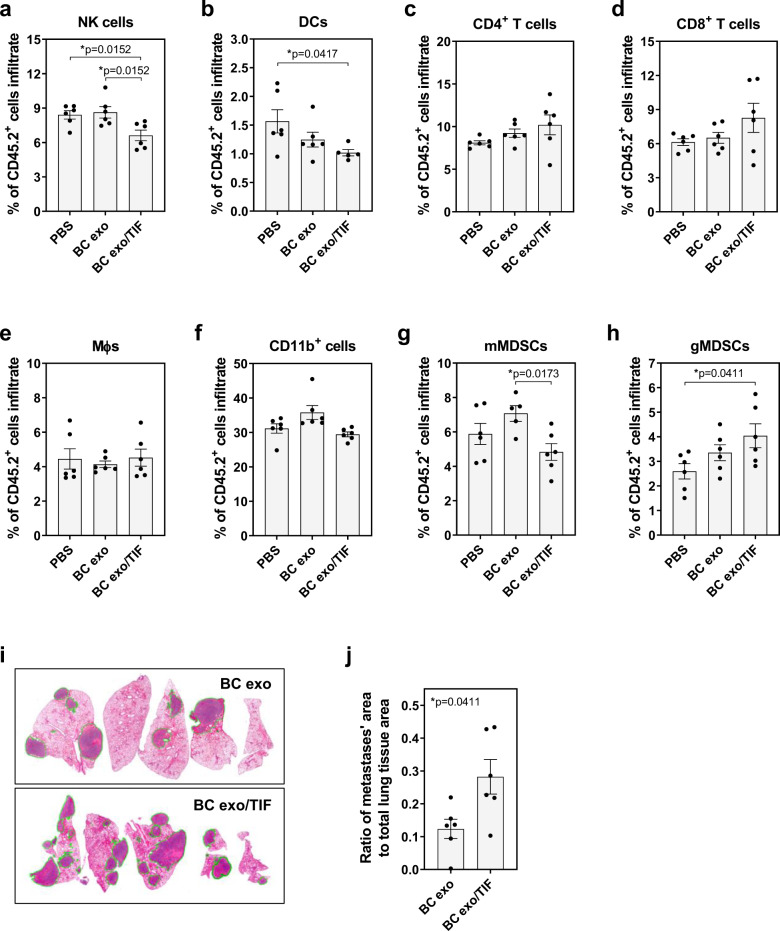
有趣的是,重复注射 TIF-外泌体改变了肺的免疫细胞组成有趣的是,重复注射 TIF-外泌体改变了肺的免疫细胞组成、脾和肝脏。这些改变包括:双肺 NK 细胞减少和脾脏;肺中 gMDSCs 的增加; 肝脏中树突状细胞(DC)的频率降低;和的Ly6C的更高的频率-巨噬细胞,将其报道与免疫应答相关的和肝。
转移前生态位被认为是循环癌细胞粘附和生长的允许环境,因此通过重复注射先前与 TIF 孵育的外泌体,然后注射同基因癌细胞来诱导转移前生态位形成。 与未结合的外泌体相比,用 TIF 结合的外泌体对小鼠进行调理后显着(p < 0.05)增加了肺中的转移形成。总而言之,这些数据表明肿瘤微环境中的细胞因子能够与癌症衍生的外泌体相关联,从而引起远端器官免疫景观的变化,并随后增加转移负担。
细胞因子通过蛋白聚糖的 GAG 侧链与癌症衍生的外泌体的外表面结合
为了评估细胞因子与癌症衍生的外泌体关联背后的机制,评估了细胞因子是位于外泌体内还是与外泌体外膜结合。为了研究它们的亚外泌体定位,我们添加了重组人或小鼠 CCL2 和 IL-6,这两种细胞因子都存在于血浆外泌体分离物和TIF中,用于两种人和两种鼠癌细胞系衍生的外泌体。孵育后,通过重新纯化外泌体去除未结合的细胞因子。我们确实观察到两种 CCL2 的浓度依赖性增加和 IL-6在这些环境中的外泌体分离物中。值得注意的是,CCL2 与鼠 PyMT 细胞衍生的外泌体的结合相对低于所有其他设置。进一步用蛋白酶 K 处理 CCL2 结合的 BC 外泌体,其浓度可导致外膜蛋白(如 CD9)降解,但不会降解囊泡内 HSP70,确认破坏仅限于外泌体表面。用蛋白酶 K 处理 BC 外泌体的表面表示大部分 CCL2 位于外泌体外膜上。此外,在裂解的囊泡和完整的囊泡之间未观察到 CCL2 含量的显着差异,表明在这种情况下,囊内细胞因子对总外泌体 CCL2 水平的贡献很小。我们通过CCL2温育后的外泌体的表面分析进一步证实了这些结果表面增强拉曼光谱(SERS),其检测从膜蛋白上的外来体分子指纹。与没有添加细胞因子的外泌体相比,与 CCL2 预偶联的 BC 外泌体在几个波段显示出不同的光谱强度。然后应用主成分分析 (PCA) 来识别 CCL2 偶联外泌体的主要光谱模式。与 CCL2 结合的外泌体与非结合的外泌体可以清楚地区分,它们的光谱主要绘制在主成分 1 (PC1) 的正侧。SERS 仅在非常靠近贵金属基底的地方检测拉曼光谱,表明大多数可检测的 CCL2 信号来自囊泡表面。此外,通过将 PC1 加载数据与单独重组 CCL2 的特征拉曼信号进行比较,我们观察到 PC1 中有助于 CCL2-外泌体分布的正峰表现出与 CCL2 信号相似的模式,尤其是在 1004 和 1362 cm -1 附近。这些观察结果表明外泌体样品之间的差异确实是由来自 CCL2 的 SERS 信号引起的。
对于我们检测到的与血浆外泌体相关的大多数细胞因子,BC 外泌体的蛋白质组学评估并未识别出同源受体。然而,分析我们的质谱数据,我们发现了大量的硫酸乙酰肝素 (HS) 和硫酸软骨素 (CS) 蛋白聚糖,包括 CD44、HSPG2、glypican-1(GPC -1)、多聚糖(VCAN)和 syndecan-1(SDC1),在 BC 外泌体中。有趣的是,两种鼠 BC 细胞来源的 EO771 和 PyMT 外泌体的蛋白多糖谱非常不同。定量地,ELISA 分析显示 MDA-MB-231 细胞衍生的外泌体表现出与 EO771 相似的蛋白聚糖谱。GAG的存在于蛋白聚糖已显示出结合细胞因子在不同细胞背景。因此,我们评估了这种结合在外泌体环境中是否也可能存在,并表明 versican、syndecan-1 和 CD44,以及 HSPG2,与外泌体结合的 CCL2 共沉淀。此外,添加分别催化蛋白聚糖的 HS 和 CS 链降解的肝素酶 III (HepIII) 和软骨素酶 ABC (ChABC) 裂解酶,减少了 CCL2 与外泌体的结合。总体而言,这些数据表明细胞外细胞因子可以通过蛋白聚糖的外泌体表面 GAG 侧链与癌细胞分泌的外泌体结合。
细胞因子结合改变外泌体的生物分布和细胞谱系特异性摄取
为了确定上述观察到的 TIF 偶联外泌体分布改变的机制,将 CCL2 偶联、荧光标记的 EO771 BC 细胞衍生的外泌体静脉注射到同基因小鼠中。各种器官(包括肝、脾、肾、肺、心脏和骨髓)的离体成像证明 CCL2 偶联的外泌体在肺中的积累显着增加,这通过肺组织切片的荧光显微镜证实。CCL2 优先与其受体 CCR2 结合,肺白细胞通常为 CCR2 +。相反,据报道也作为 CCL2 受体发挥作用的 CCR4,在肺白细胞中无法检测到。与未结合的外泌体相比,CCL2 结合的外泌体被肺 CD45.2 + CCR2 +白细胞更有效地吸收,而 CD45.2 + CCR2 -白细胞没有表现出不同的吸收。特别是在显示不同 CCR2 +和 CCR2 -群体的mMDSC 中,我们发现与 CCR2 -细胞相比,CCL2 +细胞中CCL2 偶联的外泌体更丰富,而未偶联的外泌体摄取相似。还观察到CCR2 + NK 细胞特异性摄取 CCL2 缀合的外泌体增加的趋势,尽管没有统计学意义。与 WT 小鼠中改变的生物和细胞谱系分布相反, CCL2 结合的 BC 外泌体对器官分布没有影响,肺积聚或肺 CD45.2 +细胞摄取在 CCR2 -/-小鼠中。最后,与未结合的外泌体相比,用 CCL2 结合的外泌体调理 WT 小鼠,然后注射同系癌细胞,导致 肺转移形成显着增加(p < 0.05),而对 BC 转移没有影响。 CCR2 -/-小鼠的肺。有趣的是,与仅注射 PBS 的对照组相比,单独重复注射重组 CCL2 不影响 BC 转移。更有趣的是,先前与 TIF 孵育的外泌体不影响 CCR2 -/-小鼠肺中 BC 细胞的转移性生长,表明外泌体结合的 CCL2 在 BC 转移性传播中的关键作用。
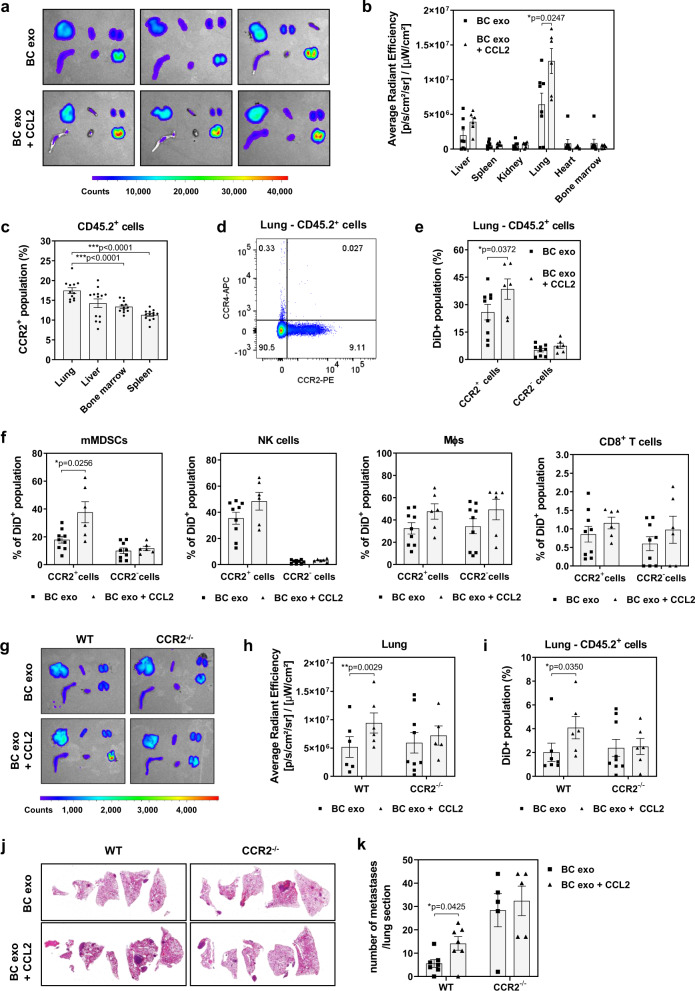
总之,这些数据表明 CCL2 与 BC 外泌体的结合改变了它们的全身生物分布以及细胞谱系特异性的囊泡摄取,并且可能有助于由 TIF 偶联的 BC 外泌体在远端器官中诱导的促转移变化,从而促进BC转移。