缺氧肿瘤来源的外泌体miR-31-5p促进肺腺癌转移
外泌体已经成为细胞间通讯的重要媒介。缺氧被广泛认为是肿瘤侵袭性的关键调节因子,并显著影响肿瘤细胞的外泌体释放。然而,人们对来自低氧肺腺癌(LUAD)细胞的外泌体的作用知之甚少。2021年6月发表于Journal of Experimental & Clinical Cancer Research(IF=11.161)的文章“Hypoxic tumor-derived exosomal miR-31-5p promotes lung adenocarcinoma metastasis by negatively regulating SATB2-reversed EMT and activating MEK/ERK signaling”对此展开了研究。我们发现低氧LUAD细胞来源的外泌体(HExo)能显著增强常氧LUAD细胞的迁移和侵袭。MiRNA测序结果显示miR-31-5p在HExo内大量内化,可被常氧LUAD细胞摄取。研究发现,外泌体miR-31-5p可直接靶向SATB2诱导的上皮间质转化,并显著增加MEK/ERK信号的激活,从而促进体外和体内肿瘤进展。此外,在LUAD患者,特别是转移性疾病患者中检测到较高水平的循环外泌体miR-31-5p。我们的研究结果表明,外泌体miR-31-5p在LUAD进展中发挥了关键作用,可以作为LUAD的诊断生物标志物。

技术路线
结果:
1)来自LUAD细胞条件培养基的外泌体的鉴定
将LUAD细胞在缺氧(1% O2)或常氧(20% O2)条件下培养48小时。我们发现缺氧条件下HIF-1α的表达水平显著升高(图1a),这表明我们已经成功建立了一个供后续实验使用的缺氧模型。然后,用超离心法从LUAD条件培养基中分离外泌体。透射电镜观察纯化后的外泌体形态,具有典型的外泌体形态,粒径分布为50-150 nm(图1b)。NTA数据进一步证实,大多数颗粒直径约为100 nm(图1c),缺氧条件下释放的外泌体浓度远高于常氧条件下释放的外泌体浓度(图1d)。此外,我们试图通过western blot验证纯化的外泌体上是否存在外泌体标记物,结果显示CD63、TSG101和Flotillin在外泌体中高表达 (图1e)。这些结果表明,我们能够分离纯化的外泌体,缺氧促进外泌体的分泌。

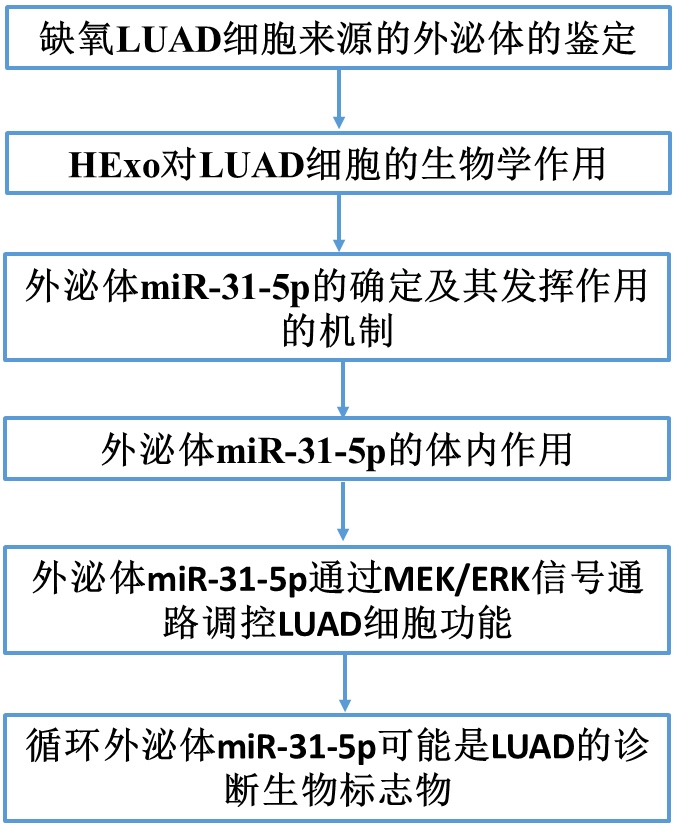
2)HExo增强了常氧细胞的迁移和侵袭能力
为了探究HExo对LUAD细胞的生物学作用,我们用HExo处理A549和H1299细胞,观察其表型变化。用荧光PKH67标记HExo,这将使我们能够通过荧光显微镜检测到它们被LUAD细胞内化(图2a)。我们检测了EMT相关标记物的变化,发现HExo显著降低了E-cadherin的表达,而增加了Vimentin的表达(图2b)。与NExo和PBS对照组相比,划痕试验显示,经HExo处理的肿瘤细胞显著减少了开放空间(图2c)。相似的是,在transwell实验中,HExo处理促进了LUAD细胞的迁移(图2d)。除了迁移实验结果外,与HExo共培养的LUAD细胞显示出显著增加的侵袭能力(图2e)。这些数据表明,HExo可促进体外常氧细胞的迁移和侵袭。
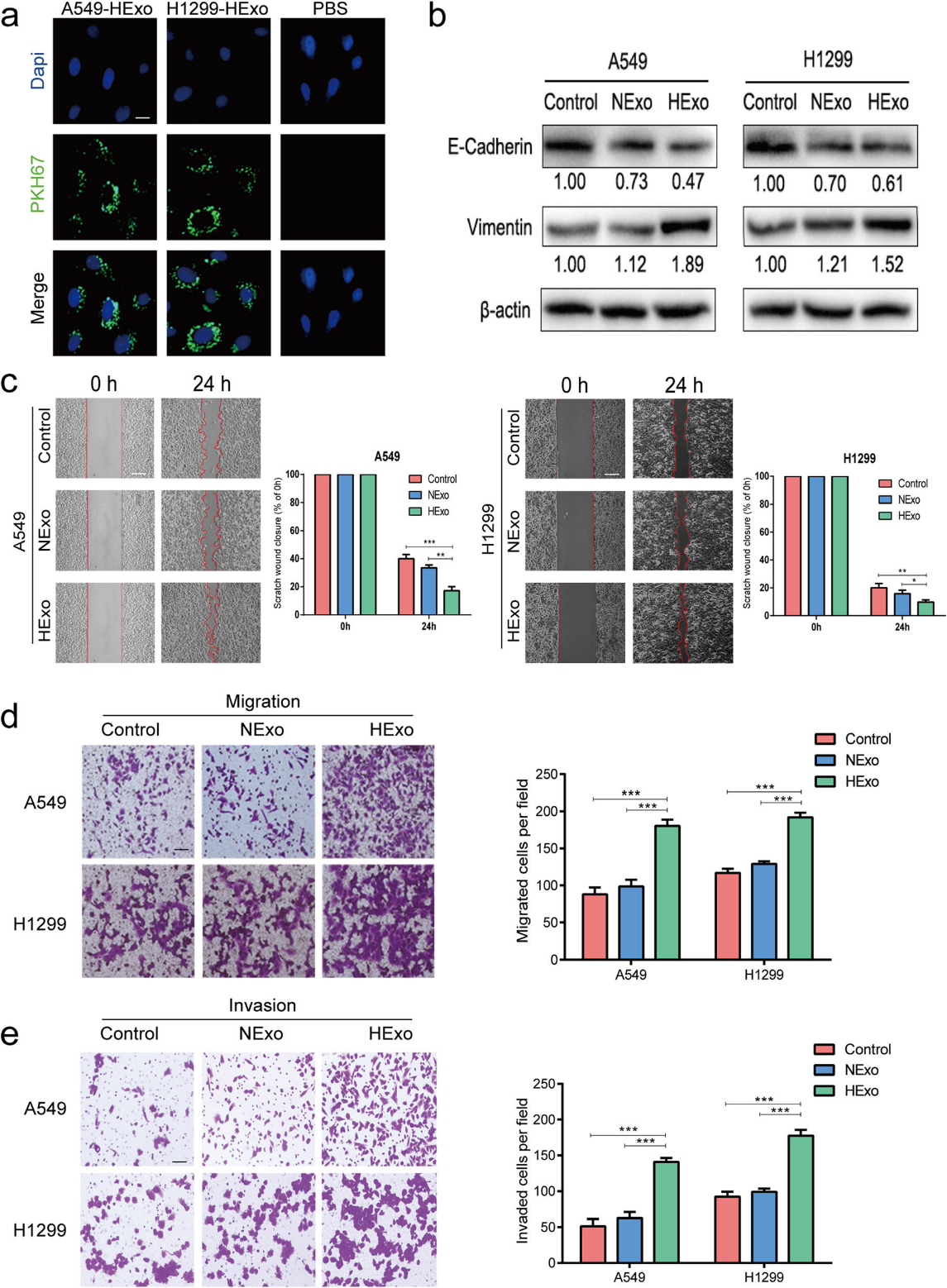
3)HExo介导的miR-31-5p向常氧细胞的转移
先前的一项研究证实,含有miRNA的外泌体可以转移到受体细胞并影响细胞功能。为了研究这种转移是否会发生在LUAD细胞中,我们提取HExo和NExo的总RNA,使用Illumina HiSeq平台进行miRNA-seq分析。我们发现miR-31-5p表达水平最高,并且在LUAD细胞系中稳定上调(图3a)。因此我们选择miR-31-5p进行进一步研究。为了确认miR-31-5p是否被外泌体包裹,我们添加了可以降解游离RNA的RNase A和增加细胞膜通透性的Triton X-100。不出所料,RNase A处理组的miR-31-5p表达水平与对照组一致。然而,在RNase A和Triton X-100组中,miR-31-5p水平均显著降低(图3b)。这些结果表明,miR-31-5p通过LUAD细胞来源的外泌体传递到其他细胞,并通过被双层脂质双层膜包裹而免受降解。此外,我们还发现,缺氧条件下,miR-31-5p在HExo中的表达水平高于在NExo中的表达水平,但这些水平在GW4869处理下被逆转(图3c),这进一步表明缺氧条件促进了外泌体的分泌和miR-31-5p向受体细胞的运输。
4)外泌体miR-31-5p直接靶向SATB2促进LUAD细胞迁移和侵袭
为了确定miR-31-5p可能的细胞靶点,我们使用三个在线数据库:Targetscan、miRTarbase和miRDB进行重叠分析。分析表明SATB2是miR-31-5p的靶点。接下来,进行荧光素酶测定以验证数据库分析的预测准确性。我们发现转染了miR-31-5p模拟物的A549细胞的荧光素酶活性与NC组的荧光素酶活性相比显著降低(图4a)。此外,在HExo治疗组中也观察到类似的结果(图4b)。此外,在常氧或缺氧条件下转染miR-31-5p模拟物的细胞显示SATB2表达水平显著降低(图4c),而使用HExo处理也降低SATB2表达(图4d)。因此,我们证实SATB2是miR-31-5p的直接靶点。接下来,我们用si-SATB2和/或miR-31-5p抑制剂处理LUAD细胞,以评估外泌体miR31-5p是否可能通过靶向SATB2促进更具侵袭性的表型。与对照组相比,miR-31-5p抑制剂组在愈合试验和Transwell侵袭试验中表现出强烈的活性水平下降,而si-SATB2-2处理组在这些试验中表现出相反的趋势。然而,在A549和H1299细胞系中,si-SATB2-2组细胞的迁移和侵袭能力可以通过miR31-5p抑制剂的作用而减弱(图4e-f)。

5)外泌体miR-31-5p促进体内转移
我们假设来自HExo的外泌体miR-31-5p可以增加异种移植模型中LUAD细胞的转移能力。在静脉尾注射后的8周观察期内,我们取小鼠肺组织标本,用HE染色(图5a)。通过统计染色组织中转移性结节的数量,我们发现HExo组小鼠肺转移性结节比PBS组小鼠肺转移性结节多,转染miR-31-5p抑制剂可以消除这种作用。相反,与miR-31-5p抑制剂组相比,HExo联合miR-31-5p抑制剂治疗增加了转移结节的数量(图5b)。我们还评估了接受不同外泌体治疗的小鼠的总体生存时间。令人惊讶的是,HExo组的小鼠总生存时间比其他三组的小鼠短(图5c)。此外,我们采用免疫化学方法检测肺组织中EMT相关标志物和SATB2的表达。在HExo组中检测到Vimentin表达水平升高,E-cadherin和SATB2表达水平下降,这些表达变化被miR-31-5p抑制剂减弱(图5d)。

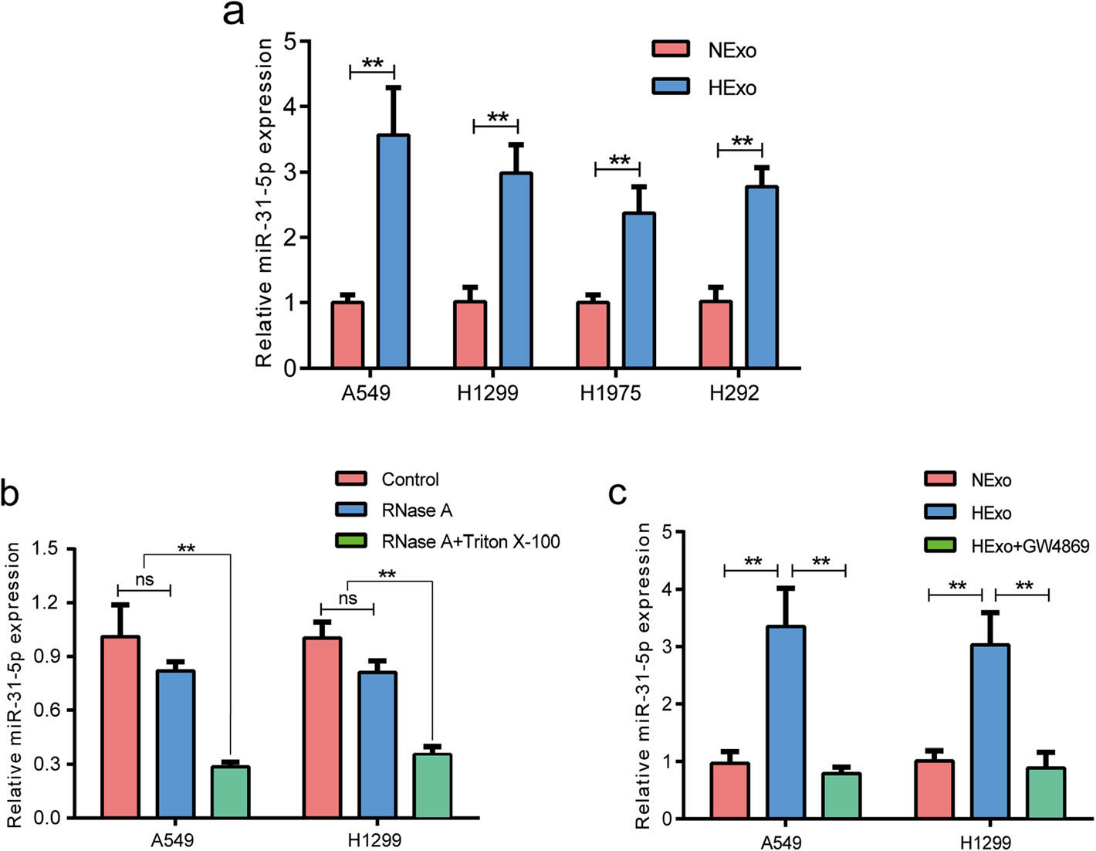
6)miR-31-5p抑制剂可逆转MEK/ERK信号通路中HExo诱导的进展
MEK/ERK信号通路已被证明参与了侵袭性肺癌表型的发展和EMT过程。因此,为了研究来自HExo的外泌体miR-31-5p对MEK/ERK信号通路的影响,我们评估了MEK和ERK的磷酸化水平。如图6a所示,与NExo和PBS组相比,HExo组MEK和ERK的磷酸化水平明显增强。然而,转染miR-31-5p抑制剂可消除MEK/ERK信号活性升高和EMT的影响,而同时加入HExo和miR-31-5p抑制剂可逆转这些影响(图6b)。我们也观察到外泌体miR-31-5p在功能实验中发挥类似的作用。转染miR-31-5p抑制剂可抑制LUAD细胞的迁移和侵袭能力,而转染HExo和miR-31-5p抑制剂可逆转这些能力(图6c-d)。这些结果证实了来自HExo的外泌体miR-31-5p可以增强EMT过程和MEK/ERK信号通路活性。
7)循环外泌体miR-31-5p可能是LUAD的诊断生物标志物
为了探讨循环外泌体miR-31-5p是否可能对LUAD具有诊断价值,我们收集了82例LUAD患者和39例健康人的血浆样本,然后分离出外泌体。透射电镜照片显示,样本含有完整的膜状颗粒(图7a)。接下来,我们从血浆来源的外泌体中提取miRNA,发现LUAD患者的外泌体中miR-31-5p水平显著高于健康对照组的外泌体(图7b)。此外,我们发现所有转移性疾病患者LUAD血浆来源的外泌体样本中外泌体miR-31-5p的水平远高于非转移性疾病患者的水平(图7c)。外泌体miR-31-5p的ROC分析显示,外泌体miR-31-5p在LUAD患者和健康个体之间具有较高的鉴别能力(图7d)。以上数据提示外泌体miR-315p可作为LUAD的诊断生物标志物。
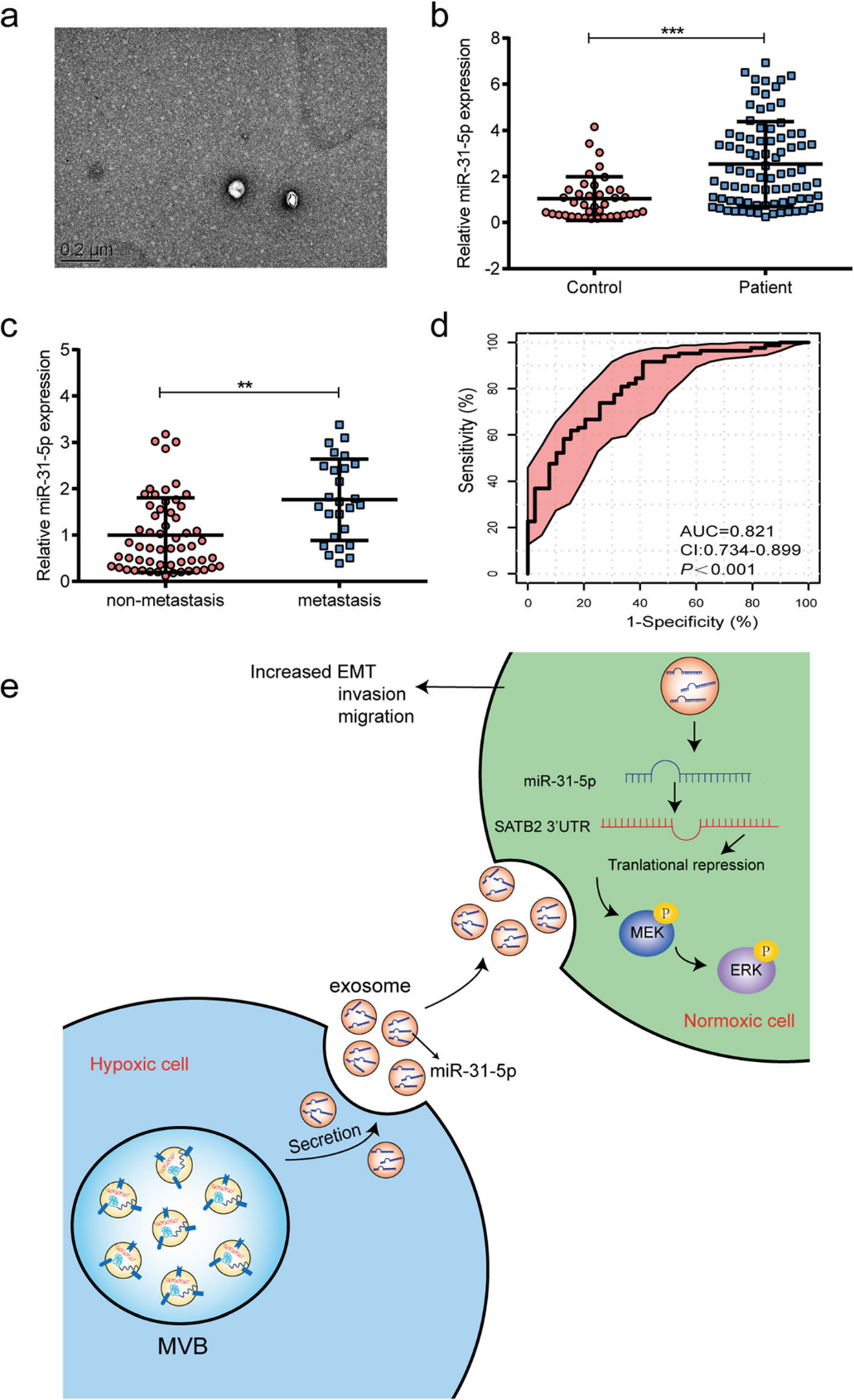
结论: miR-31-5p在低氧LUAD细胞衍生的外泌体中大量富集。外泌体miR-31-5p通过降低SATB2表达和增加MEK/ERK通路的活性在癌症进展中发挥关键作用。外泌体miR-31-5p可能作为LUAD的循环诊断生物标志物。






