不孤单的lncRNA Tug1需要PGC1α一起保护肾脏
在涉及线粒体功能障碍的多种潜在机制中,作者发现lncRNA Tug1(牛磺酸上调基因1)的异常表达在促进DN线粒体功能障碍中起核心作用,但其分子基础尚不清楚。lncRNA Tug1与低表达的足细胞Pgc1α(一种线粒体生物发生的特征明确的主调控因子)之间存在关联,但其在体内的作用机制尚不清楚,并且缺乏关于PGC1α作为Tug1下游效应体在DN动物模型中的作用的确切证据。本文建立了一个三重突变的糖尿病小鼠模型,并结合代谢组学分析数据来研究Tug1与过氧化物酶体增殖物激活受体γ共激活因子1α(PGC1α)的相互作用是否在体内线粒体重构和DN进展中所必需。本文于2021年8月发表在《Cell Reports》IF:9.423期刊上。
技术路线:
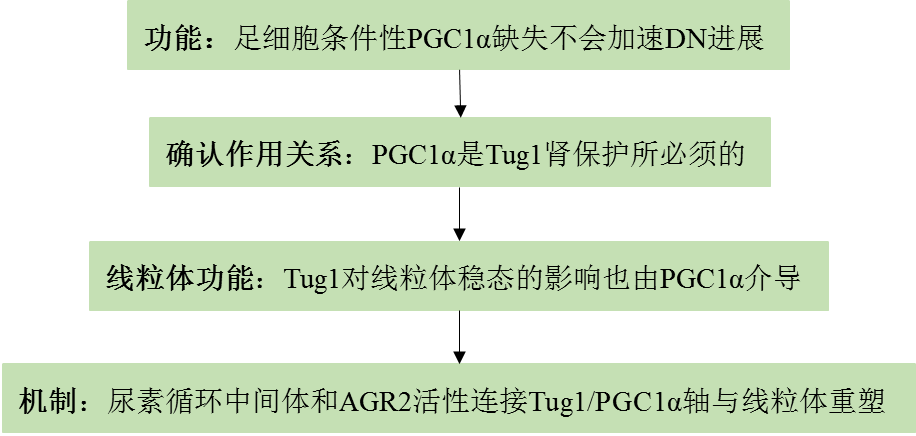
主要结果:
为了确定在Tug1转基因小鼠中观察到的肾保护特征是否归因于PGC1α,检测了Tug1和PGC1α在线粒体重塑和DN进展方面的遗传相互作用的可能性。如图1A-1C所示,作者通过小鼠杂交构建了足细胞中PGC1α特异性敲除的小鼠,命名为Pgc1αf/f小鼠。此前,与非诱导糖尿病对照组相比,三苯氧胺诱导的糖尿病Pgc1αPod-f/f小鼠的蛋白尿量或关键组织学没有显著改变,包括系膜基质扩张和足细胞损失,通过ACR、Wilms肿瘤蛋白1 (WT1)、和PAS染色等测定(图1D-1G)。与这些发现一致的是,在他莫西芬诱导和非诱导的糖尿病Pgc1αPod-f/f小鼠中,线粒体超微结构检查显示了相似的线粒体形态变化,具有相似的长径比(AR)和形状因子(FF)值(图1H-1J)。总之,这些数据表明,在糖尿病环境中,足细胞特异性缺失Pgc1α不会加剧DN的进展或线粒体功能障碍。作者对这些发现的解释是,由于PGC1α在DN中已经下调,进一步下调其表达不会改变糖尿病肾病的进程或线粒体形态。
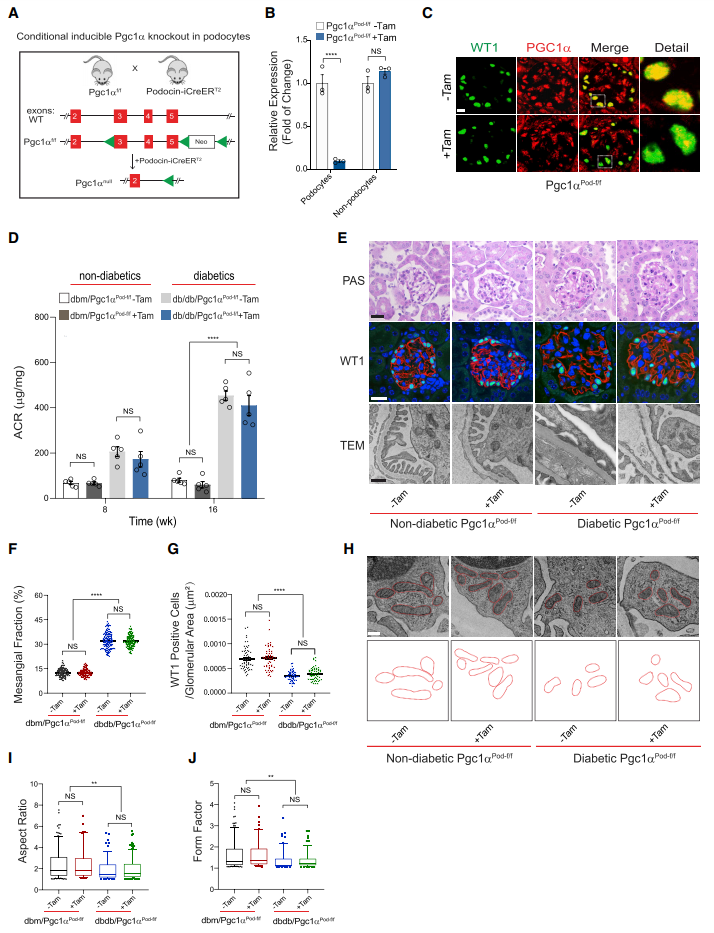
图1足细胞中条件性和诱导性PGC1α的缺失不会加重DN的进展
作者之前已经证明,在几种糖尿病实验模型中,足细胞中Tug1的表达降低,糖尿病小鼠足细胞特异性过表达Tug1改善了与DN相关的生化和组织学特征。体外细胞实验表明在糖尿病环境中PGC1α可以作为Tug1的靶点。因此,接下来作者在体内糖尿病环境中,探讨足细胞特异性lncRNA Tug1过表达的肾保护作用是否需要PGC1α。为了验证这一假设,作者构建了条件诱导性糖尿病db/db模型小鼠:TugPodTg和Pgc1αPod-f/f突变小鼠(图2A)。三重突变的糖尿病小鼠分三组,如下:db/db/Pgc1αPod-f/f,未诱导糖尿病db/db/TugPodTg/Pgc1αPod-f/f,三苯氧胺诱导糖尿病db/db/ TugPodTg/Pgc1αPod-f/f组。如预期的,对糖尿病TugPodTg小鼠足细胞的qPCR分析显示,Tug1在不依赖于PGC1α的足细胞中表达显著增加(图2B)。观察到三组患者的体重和血糖变化无统计学意义(图2C-2D);然而,足细胞中Tug1过表达导致蛋白尿减少和肾小球系膜基质扩张(图2E-2H)。Tug1过表达的这些有益作用在三苯氧胺诱导的三重突变的糖尿病小鼠TugPodTg/Pgc1αPod-f/f老鼠中部分逆转。透射电镜显示,Pgc1α敲除可以减轻Tug1过表达对足细胞足突消除和GBM增厚的影响(图2G-2J)。此外,Tug1过表达小鼠肾小球中足细胞数量的增加在三苯氧胺诱导的糖尿病db/db/ TugPodTg/Pgc1αPod-f/f小鼠中减少约85% (图2G-2I)。
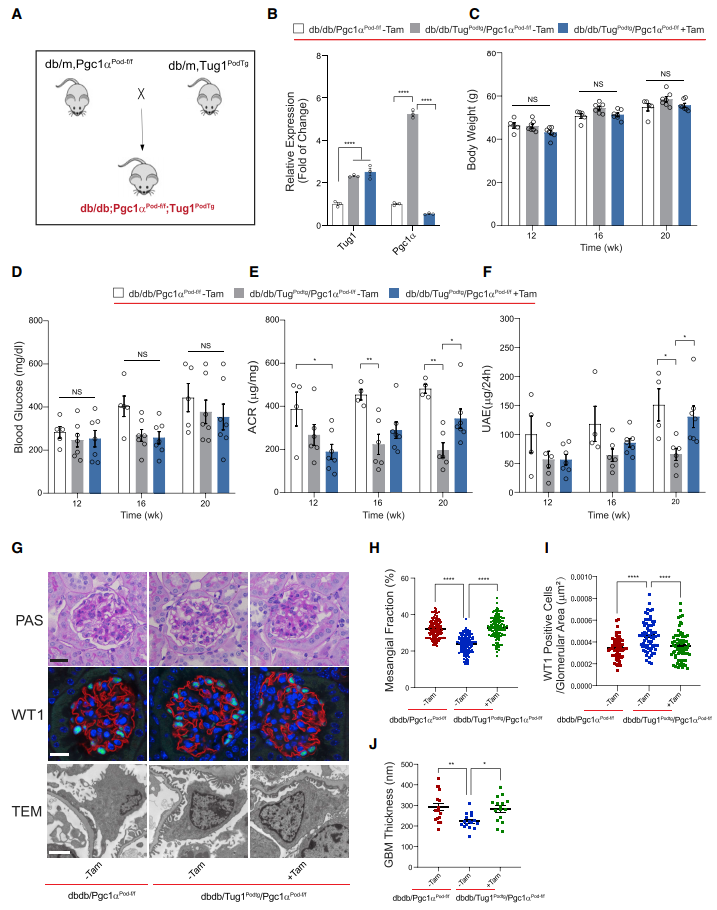
图2 在糖尿病db/db模型中,足细胞特异性PGC1α缺失可减轻足细胞特异性lncRNA Tug1转基因小鼠的肾保护作用
作者接下来探究在体内,Tug1对线粒体稳态的影响是否也由PGC1α介导,主要探究线粒体的4个功能:线粒体生物发生,动力学,氧化还原和生物能。线粒体超微结构显示,与未诱导糖尿病的小鼠相比,三苯氧胺诱导的糖尿病TugPodTg/Pgc1αPod-f/f小鼠足细胞中线粒体碎片增多,AR和FF显著下降(图3A-3D)。鉴于线粒体的形态变化,接下来检测融合和裂变调节蛋白的表达变化。线粒体融合蛋白包括Drp1,Mff,MiD49和MiD51都显著下降,但是线粒体融合关键组分Mfn1和Mfn2上调在Tug1转基因小鼠中(图3E),表明Tug1过表达增强线粒体融合减少片段化;但在诱导的db/db/TugPodTg/Pgc1αPod-f/f小鼠中,Tug1的保护作用在Pgc1α敲除后被消减,提示Pgc1α是Tug1调节线粒体形态所必须的。与此一致,相对于Tug1过表达联合Pgc1α敲低的糖尿病小鼠的足细胞,Tug1过表达对线粒体生物发生的影响发生了逆转,如线粒体拷贝数评估,线粒体ROS和总ATP含量(图3F-3H)。
随后通过检测氧耗率(OCR)和细胞外酸化率(ECAR)评估Tug1/Pgc1α轴对线粒体生物能的影响。与对照未诱导db/db/Pgc1αPod-f/f足细胞相比,基础呼吸和最大OCR在Tug1过表达组都显著升高;在Tug1过表达的糖尿病小鼠足细胞中沉默Pgc1α可以阻止上述改变(图3I-3K)。根据ECAR评估,Tug1过表达的足细胞的基础糖酵解、糖酵解能力和糖酵解储备比对照非诱导的db/db/Pgc1αPod-f/f足细胞显著降低,虽然在基础酸化率和糖酵解储备方面没有发现统计学上的显著差异,但糖酵解能力的下降在Tug1过表达联合Pgc1α敲低的糖尿病小鼠的足细胞中被逆转(图3L-3O)。
总之,这些结果表明Pgc1α是Tug1保护线粒体和减缓DN进展所必须的。
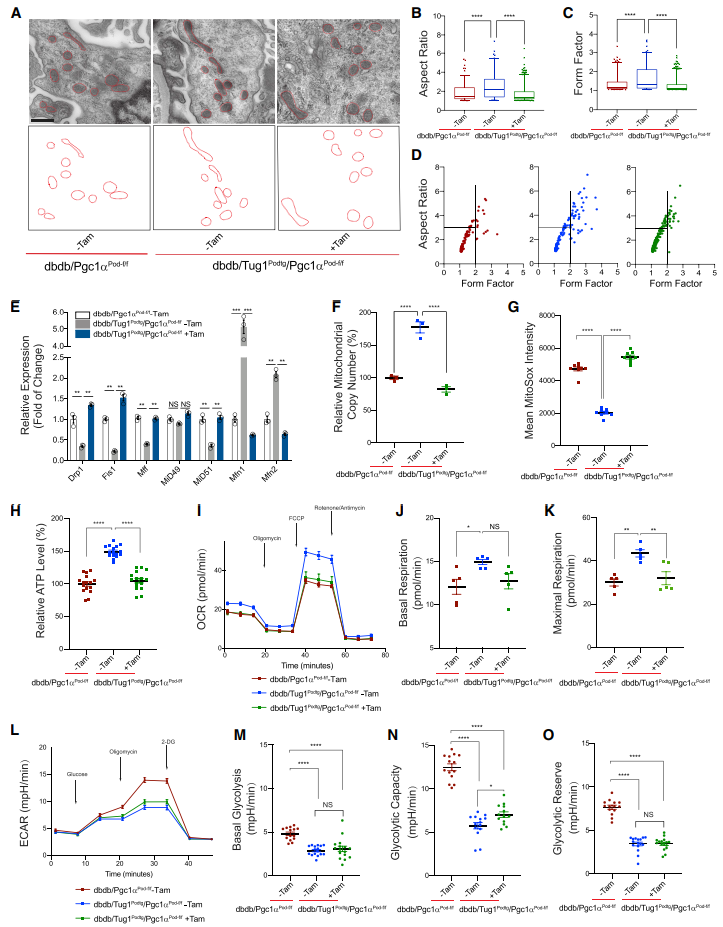
图3 lncRNA Tug1介导的足细胞线粒体适应被PGC1α敲除反转
3、尿素循环中间体连接Tug1/PGC1α轴与线粒体重塑
已知细胞在响应外部代谢信号时表现出代谢重塑,其特征是通过在底物和/或代谢途径之间的转换来适应代谢需求的变化。为了进一步了解Tug1在关键代谢途径中的作用,作者重新分析了他们之前释放的足细胞无偏性比较转录组数据,该数据分为Tug1-knockdown (shTug1)和scramble short hairpin RNA (shRNA) control (shCtrl) 两组,该结果为糖酵解、三羧酸循环和氧化磷酸化(OXPHOS)中酶催化反应的一系列mRNA变化提供了一些早期线索(图4A)。接下来,对全细胞和线粒体代谢物进行代谢组分析。在测定的糖酵解、TCA循环、氨基酸的中间体中,作者发现尿素循环(也被称为精氨酸-瓜氨酸循环)的中间体在最显著被改变的,在Tug1-KD和Tug1-KD/Pgc1-OE细胞中(图4B)。Tug1-KD细胞中,与对照组比,尿素循环的两种中间产物鸟氨酸和瓜氨酸是上调最显著的代谢物,与Tug1-KD细胞比较,它们是Tug1-KD/Pgc1-OE足细胞中下调最显著的代谢物,提示Tug1/PGC1α轴对这两种关键代谢物具有调节作用(图4C-4D)。代谢产物富集分析也表明嘧啶代谢,尿素循环的下游副产物和精氨酸的生物合成是富集最多的途径(图4E和4F)。
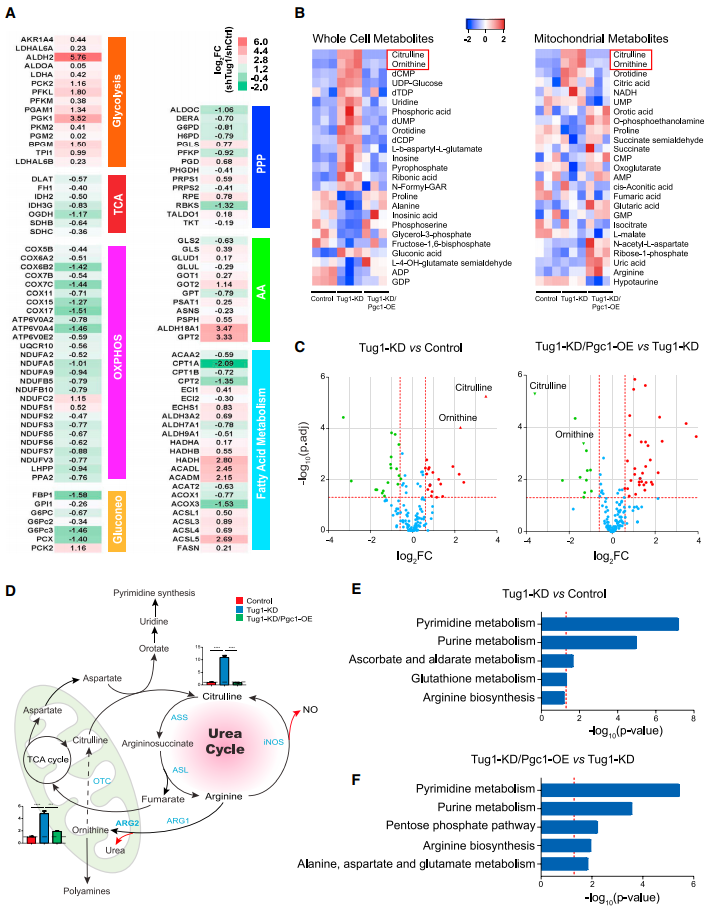
为探究Tug1/PGC1α轴如何调节鸟氨酸和瓜氨酸的代谢,评估了尿素循环中的几个关键酶,包括精氨酸琥珀酸合成酶(ASS1),精氨酸琥珀酸裂解酶(ASL),精氨酸酶1和精氨酸酶2 (ARG1和ARG2),以及一氧化氮合成酶(NOS1, NOS2和NOS3)。在Tug1-KD细胞中,ARG2高表达,ASS1、ASL、ARG1和NOS2低表达,而Pgc1-OE逆转了Tug1-KD对这些酶表达的影响(图5A-5B)。作者着重关注线粒体ARG2酶,认为增强ARG2表达/活性可能将Tug1/PGC1α轴的一些线粒体效应与鸟氨酸和线粒体代谢物的增加联系起来。与对照组相比,Tug1-KD组精氨酸酶活性增加,但是Tug1-KD/Pgc1-OE足细胞中回落(图5C)。在互补实验中,所得结果与此相反,Tug1过表达导致精氨酸酶活性下降,但是足细胞特异性Pgc1α敲除小鼠废除了这种效应(图5D)。在三苯氧胺诱导的db/db/TugPodTg/Pgc1αPod-f/f小鼠足细胞中使用siRNA干扰Arg2基因的表达,结果显示ATP和生物能与siRNA-NC对照组无差别(图5E-5F),但是线粒体生物发生,ROS产生和动力学(图5G-5J)都显著改变。这提示ARG2部分介导Tug1/PGC1α轴的线粒体效应。
总之,以上结果表明Tug1/PGC1α轴依赖于尿素循环代谢和ARG2活性进而影响足细胞线粒体代谢以适应糖尿病环境。

图5线粒体Arg2将Tug1/PGC1α轴与线粒体代谢连接起来
总之,本研究证明在体内lncRNA Tug1对足细胞线粒体功能和糖尿病肾病进展的保护作用需要PGC1α。研究发现,改变尿素循环代谢物和线粒体精氨酸酶2 (Arg2)在Tug1/PGC1α诱导的线粒体重塑中发挥重要作用。

图形摘要
参考文献:
Li Li., Long Jianyin., Mise Koki., Galvan Daniel L., Overbeek Paul A., Tan Lin., Kumar Shwetha V., Chan Wai Kin., Lorenzi Phillip L., Chang Benny H., Danesh Farhad R.(2021). PGC1α is required for the renoprotective effect of lncRNA Tug1 in vivo and links Tug1 with urea cycle metabolites. Cell Rep, 36(6), 109510. doi:10.1016/j.celrep.2021.109510






