乳腺癌衍生的外泌体 miR-138-5p 通过抑制 KDM6B 调节肿瘤相关巨噬细胞的极化
乳腺癌是女性肿瘤中最普遍的恶性肿瘤,近些年乳腺癌发病率和死亡率逐年增加。乳腺癌微环境不仅包括肿瘤细胞,还包括基质细胞和不同的免疫细胞亚群。其中肿瘤相关巨噬细胞 (TAM) 是肿瘤微环境的关键组成部分,广泛参与调节肿瘤进展。今天我们来讲一篇关于乳腺癌外泌体miRNA介导TAM极化的文章,文章题名为:Cancer-derived exosomal miR-138-5p modulates polarization of tumor-associated macrophages through inhibition of KDM6B,发表于Theranostics期刊(IF=11.55)。
miR-138-5p抑制巨噬细胞表达KDM6B
首先检查了 MB-MDA-231 乳腺癌细胞对巨噬细胞样细胞系 THP-1 中KDM6B表达的影响。与 MDA-MB-231 悬浮共培养 48 小时后,THP-1 细胞中的 KDM6B 水平显着降低,源自 MDA-MB-231 的条件培养基 (CM) 抑制了 THP-1 细胞中KDM6B 的表达,表明乳腺癌细胞分泌的一种因子是造成这种效应的原因。
miRNA 参与填充肿瘤微环境的不同细胞类型之间的信号转导。因此,试图确定 miRNA 是否有助于KDM6B表达的调节。为此进行了生物信息学分析和文献综述,确定靶向KDM6B 3'-UTR的miRNA。确定了miR-138-5p、miR-146a和miR-20a-3p作为候选miRNA。当我们分析与MDA-MB-231细胞共培养后 THP-1 细胞中 miRNA 水平的变化时,发现miR-138-5p和miR-146a显着增加,而miR-20a-3p减少。考虑到 miRNA 水平通常与靶基因的水平呈负相关,接下来确认了miR-138-5p或miR-146a是否抑制了KDM6B表达。结果发现是miR-138-5p而非miR-146a的异位表达抑制了THP-1细胞KDM6B的表达。序列分析表明,miR-138-5p 在KDM6B mRNA的 3-'UTR 中含有两个潜在的靶位点。此外,KDM6B mRNA 3-'UTR 中 miR-138-5p 的靶结合序列在众多不同物种中高度保守。荧光素酶报告基因检测表明,miR-138-5p 的过表达抑制了KDM6B mRNA的 3'-UTR 驱动的荧光素酶活性,但不会抑制突变的同源 3'-UTR。这些数据表明 miR-138-5p通过与其3'-UTR 结合来抑制KDM6B表达。
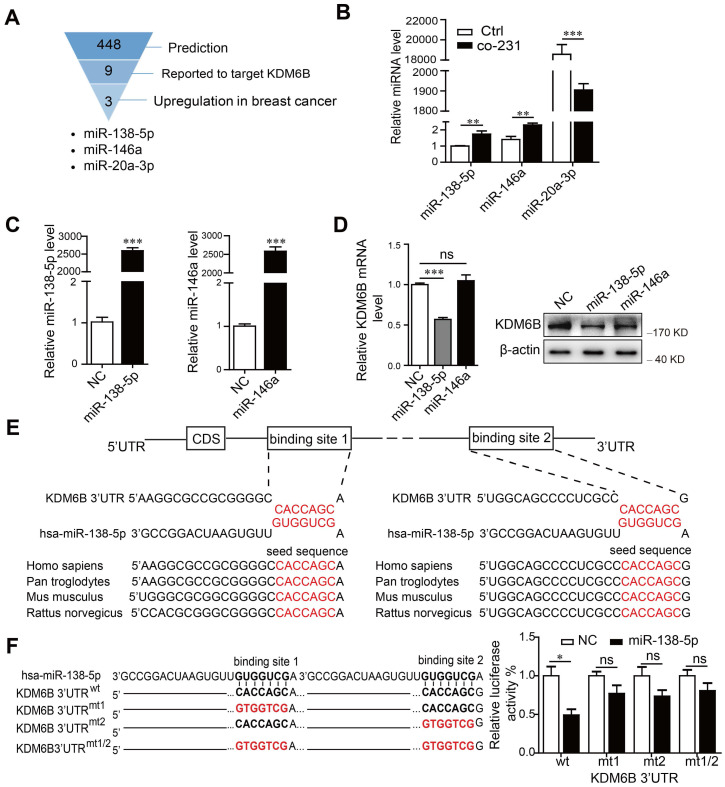
miR-138-5p介导癌细胞诱导的巨噬细胞KDM6B表达抑制
首先测量了表型不同的乳腺癌细胞系以及非致瘤细胞系中的 miR-138-5p 水平。当miR-138-5p mimics转染 MCF7 和 T47D 细胞过表达 miR-138-5p 时,发现用MDA-MB-231细胞的 CM 处理或与过表达 miR-138-5p的MCF7和 T47D细胞共培养增加了 THP-1 细胞表达的 miR-138-5p 水平。此外,与过表达 miR-138-5p的MCF7和T47D细胞共培养抑制了THP-1细胞中KDM6B mRNA 和蛋白质的表达。因此,得出结论,miR-138-5p 介导了THP-1 细胞与癌细胞共培养诱导的KDM6B表达抑制。
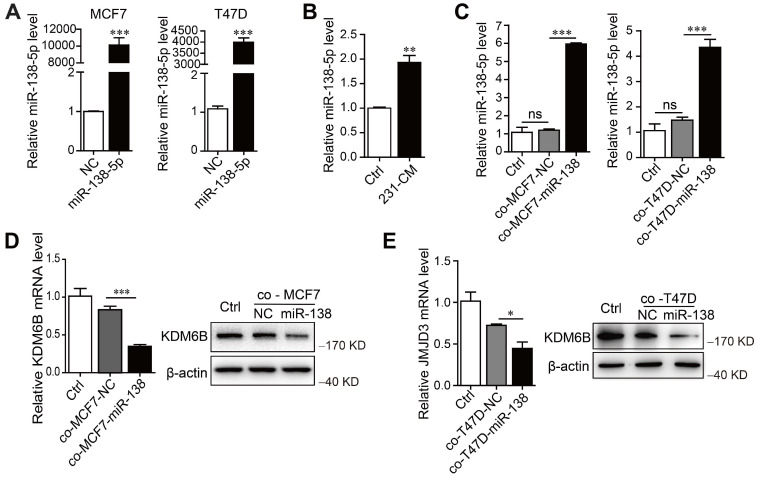
癌细胞产生的外泌体miR-138-5p下调巨噬细胞中KDM6B的表达
接下来探索miR-138-5p的水平如何增加。为此测量了巨噬细胞中初级 (pri-) 和前体 (pre-) miR-138 的水平。发现处理后THP-1细胞中pri-或pre-miR-138没有增加,表明miR-138-5p是外源供应的。此外,与用 RNase A 加 Triton X-100 处理相比,当我们用 RNase A 处理 MDA-MB-23 的 CM 时,miR-138-5p的水平没有变化。这些发现支持细胞外miR-138-5p被包裹在膜结构中的结论。通过观察到与未处理的CM相比,GW4869 处理的CM或外泌体耗尽的 CM 中miR-138-5p的水平显着降低,获得了进一步的证据,表明外泌体miR-138-5p参与了KDM6B表达的调节。这些结果表明 miR-138-5p 被包裹在乳腺癌细胞释放的外泌体中。
接下来研究了来自乳腺癌细胞的外泌体miR-138-5p是否介导了THP-1细胞中miR-138-5p水平的增加。发现外泌体抑制剂GW4869阻断了由MDA-MB-231 细胞的CM处理引起的miR-138-5p水平的增加。此外,在THP-1细胞中检测到 Cy3标记的miR-138-5p,并与Dio标记的外泌体膜共定位。总之,数据表明癌细胞分泌外泌体miR-138-5p被转移到巨噬细胞。
当测量外泌体miR-138-5p对巨噬细胞中KDM6B表达的影响时,发现外泌体的抑制阻断了通过用 CM 处理细胞诱导的KDM6B抑制。MDA-MB-231衍生的外泌体的处理增加了THP-1细胞miR-138-5p的水平并抑制KDM6B的表达,这种作用在用miR-138-5p inhibitor处理的THP-1细胞中被消除。用miR-138-5p mimics转染T47D细胞会增加外泌体miR-138-5p的水平。来自过表达miR-138-5p的T47D细胞的外泌体增加了miR-138-5p水平并抑制了THP-1细胞中KDM6B 的表达。总之,这些结果表明癌细胞分泌的外泌体 miR-138-5p 被递送到巨噬细胞,在其中它抑制KDM6B。

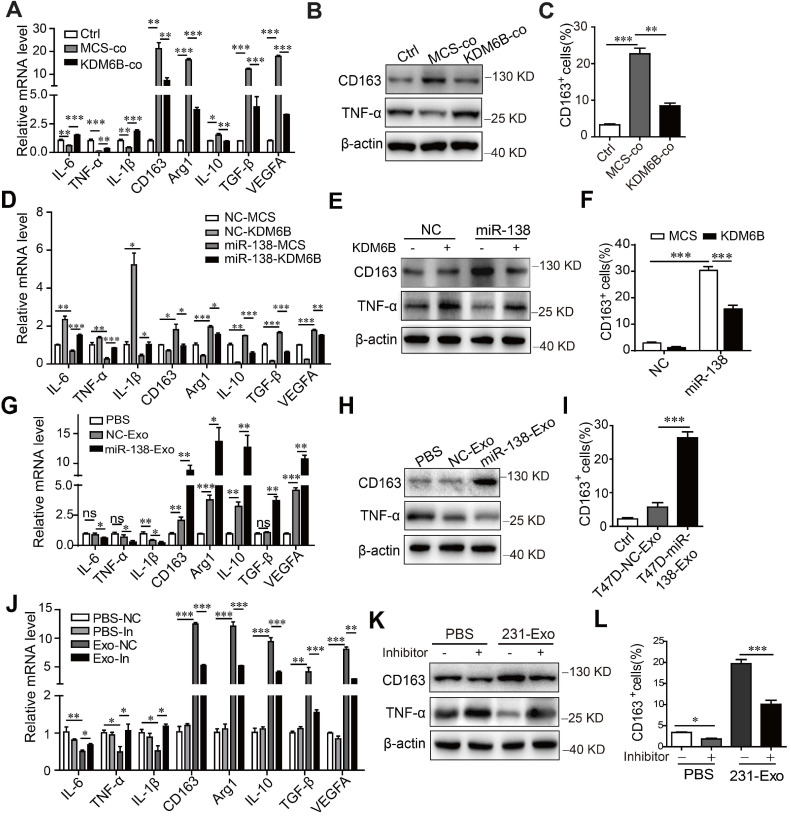
外泌体 miR-138-5p 通过抑制KDM6B表达调节巨噬细胞极化
为了确定miR-138-5p 诱导的KDM6B表达抑制是否影响巨噬细胞极化,在不同条件下培养的THP-1细胞的转录谱。首先,与肿瘤细胞共培养抑制了编码 IL-6、TNF-α和IL-1β的M1相关基因的表达,并增加了编码 CD163、Arg1、IL-10、TGF-β 和M2相关基因的表达。流式细胞术显示,MDA-MB-231细胞与THP-1细胞共培养增加了CD163阳性巨噬细胞的百分比,当这些细胞过表达KDM6B 时,CD163 阳性巨噬细胞的百分比被抑制。类似地,KDM6B 过表达抑制了用 miR-138-5p mimics转染THP-1细胞诱导的 M2 样极化。与对照相比,用从表达 miR-138-5p 的T47D细胞中分离的外泌体处理THP-1细胞降低了M1相关表型。相比之下,巨噬细胞表达的 M2 标志物随着巨噬细胞培养物中 CD163 阳性细胞数量的增加而增加。
用从 MDA-MB-231 细胞中分离的外泌体处理 THP-1 细胞导致 M2 样极化,这通过抑制 miR-138-5p 表达来挽救。此外,用 miR-138-5p mimics转染或与过表达 miR-138-5p的T47D 细胞的 CM 中分离的外泌体孵育增加了THP-1 细胞的增殖。Transwell 分析显示,用来自MDA-MB-231 CM外泌体 miR-138-5p 孵育的巨噬细胞处理后,细胞的迁移增加。总之,数据表明外泌体miR-138-5p 通过抑制巨噬细胞中KDM6B 的表达来促进 M2 样极化。
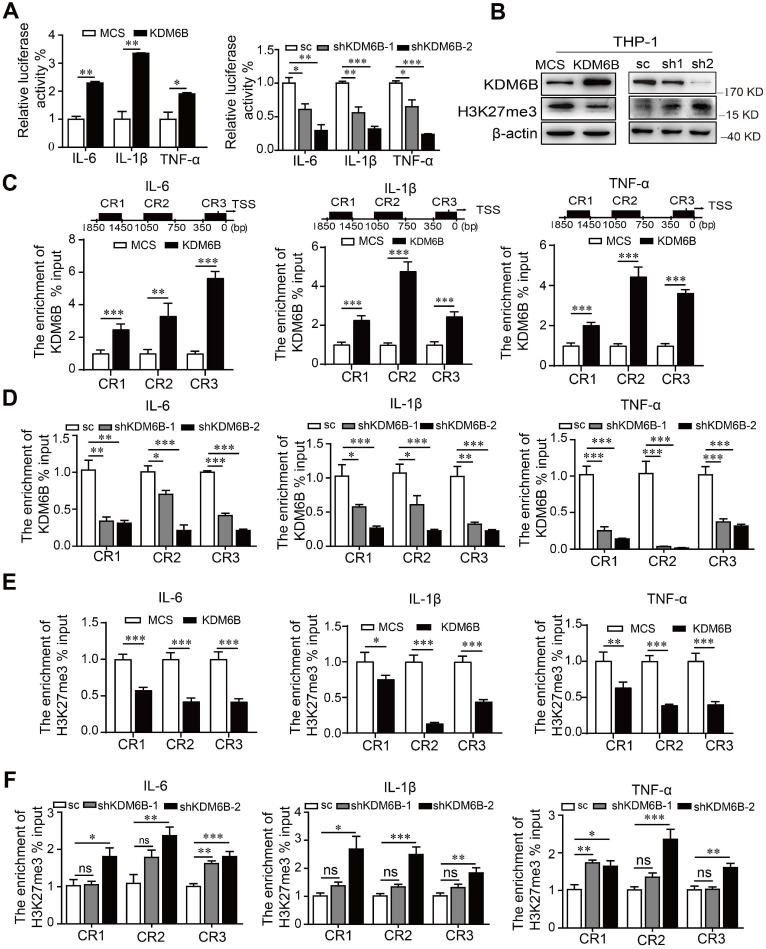
KDM6B 去甲基化酶活性促进 M1 相关基因表达
抑制KDM6B的组蛋白去甲基化酶活性会抑制其靶基因的转录。因此,使用双荧光素酶测定来分析M1靶基因的启动子活性。KDM6B 的过表达特异性刺激了编码促炎因子 IL-6、IL-1β 和 TNF-α 的基因的启动子活性。相反,沉默 KDM6B 导致其启动子活性受到抑制,并且KDM6B在THP-1细胞中的过表达降低了H3K27me3的水平,当KDM6B表达受到抑制时,H3K27me3 的水平会增加。ChIP 分析显示,与对照相比,THP-1 细胞中KDM6B 的过表达或敲低分别显着增加或减少了 KDM6B 在这些启动子的不同区域的占有率。与这些发现一致,当KDM6B在THP-1细胞中过表达或下调时,H3K27me3 向这些启动子的募集减少或增加。因此,KDM6B 的下调增加了 H3K27me3 的水平和编码促炎因子的基因的转录活性,从而抑制了 M1 极化。
外泌体miR-138-5p促进乳腺癌向肺转移
极化巨噬细胞在决定肿瘤细胞的表型方面起着重要作用。因此,用外泌体 miR-138-5p处理的M2巨噬细胞是否有助于乳腺癌小鼠异种移植模型中的肿瘤转移。使用氯膦酸盐去除小鼠的巨噬细胞,然后转移用源自T47D或过表达miR-138-5p 的T47D细胞的外泌体处理的Raw264.7细胞。通过尾静脉静脉注射4T1-荧光素酶细胞建立小鼠模型。使用体内成像系统设施 (IVIS) 系统监测转移并计数肺中的转移性结节。与对照外泌体相比,用T47D-miR-138-5p外泌体处理的巨噬细胞移植小鼠的肺转移发生率显着更高。当确定肿瘤组织中CD206和 Arg1阳性M2巨噬细胞的百分比时,发现使用 T47D-miR-138-5p 外泌体处理的巨噬细胞增加了 M2 细胞的百分比。总之,这些结果表明外泌体miR-138-5p诱导的M2巨噬细胞促进了乳腺癌的肺转移。







