YTHDF1通过控制FZD7的翻译促进胃癌发生
N6-甲基腺苷(m6A)修饰是真核mRNA中最丰富的形式。RNA m6A在植物、脊椎动物中高度保守,并且在病毒以及古细菌、细菌和酵母等单细胞生物中也观察到。m6A相关基因的缺陷会影响不同的生物过程。然而,如何m6A调节致癌作用以及下游途径和机制如何传递这些信号尚未完全了解。今天我们讲一篇胃癌m6A的研究,文章题名为:YTHDF1 Promotes Gastric Carcinogenesis by Controlling Translation of FZD7,该文章刊登在Cancer Research期刊(IF=12.7).
YTHDF1基因在胃癌中的扩增
为了探究参与胃癌发展的m6A相关基因的遗传改变,分析了包含630种原发性胃腺癌的cBioPortal数据库数据。值得注意的是,YTH家族读取器显示出相对较高的突变率。YTHDF1是最普遍的突变基因,发生在约7%的胃癌患者中。通过评估YTHDF1突变的分布,观察到所有突变中有65%是基因扩增,这通常导致基因产物的过度表达。然后探索了TCGA数据集,发现胃癌患者中YTHDF1 的表达确实显着高于正常组织。此外,YTHDF1突变在多种癌症中并不常见,但在大多数肿瘤中观察到YTHDF1的上调,表明YTHDF1在癌症发展中具有普遍的致癌作用。特别是,较高的YTHDF1表达与胃癌进展和较差的总生存期相关。
接下来通过qPCR在113对内部胃癌组织和匹配的癌旁组织中验证,YTHDF1 mRNA在胃癌肿瘤中显着增加。对正常胃组织和胃癌标本的IHC分析证实了肿瘤组织中 YTHDF1 蛋白的上调。此外,胃癌患者中YTHDF1的异常高表达与更严重的临床病理特征显着相关,例如神经周围浸润、侵袭性肿瘤分期和静脉浸润。Kaplan-Meier生存分析还表明,具有高YTHDF1表达的胃癌患者的 4年总生存率较差。这些数据共同表明YTHDF1在胃肿瘤发生中的潜在致癌作用。
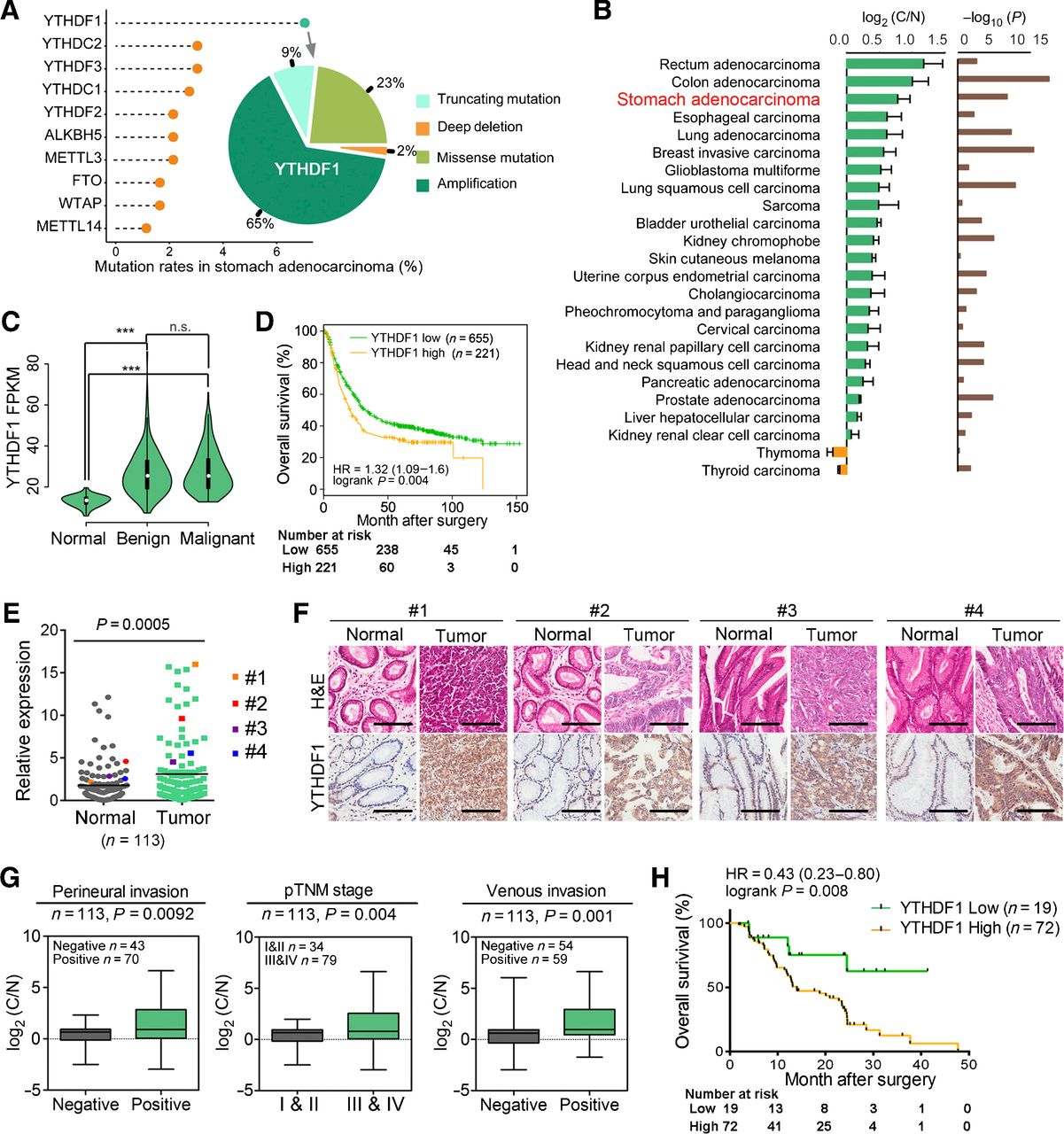
YTHDF1缺陷抑制胃癌进展和转移
测量各种胃癌细胞系中YTHDF1的蛋白质表达水平,其远高于正常胃腺细胞GES-1。为了进一步探索YTHDF1在胃癌中的功能,应用了不同的系统,包括胃癌细胞系、细胞系衍生的异种移植物 (CDX) 和 PDX 模型。首先,通过产生两种稳定的shRNA敲低人胃癌细胞系MGC-803和HGC-27中YTHDF1,它们在所有测试的胃癌细胞系中显示出相对较高的YTHDF1表达。YTHDF1敲低确实降低了胃癌细胞的细胞增殖。此外,MGC-803和HGC-27细胞中的YTHDF1 缺失削弱了它们的迁移和侵袭能力。接下来通过将缺乏YTHDF1的MGC-803细胞皮下注射到裸鼠中,检查了YTHDF1敲低是否会影响体内胃癌的发生。一致地,YTHDF1水平降低导致MGC-803移植肿瘤的肿瘤进展延迟,YTHDF1敲低的肿瘤重量和体积显着降低。因此,在敲低YTHDF1的肿瘤中,增殖标志物Ki-67下调,凋亡标志物cleaved caspase-3上调。
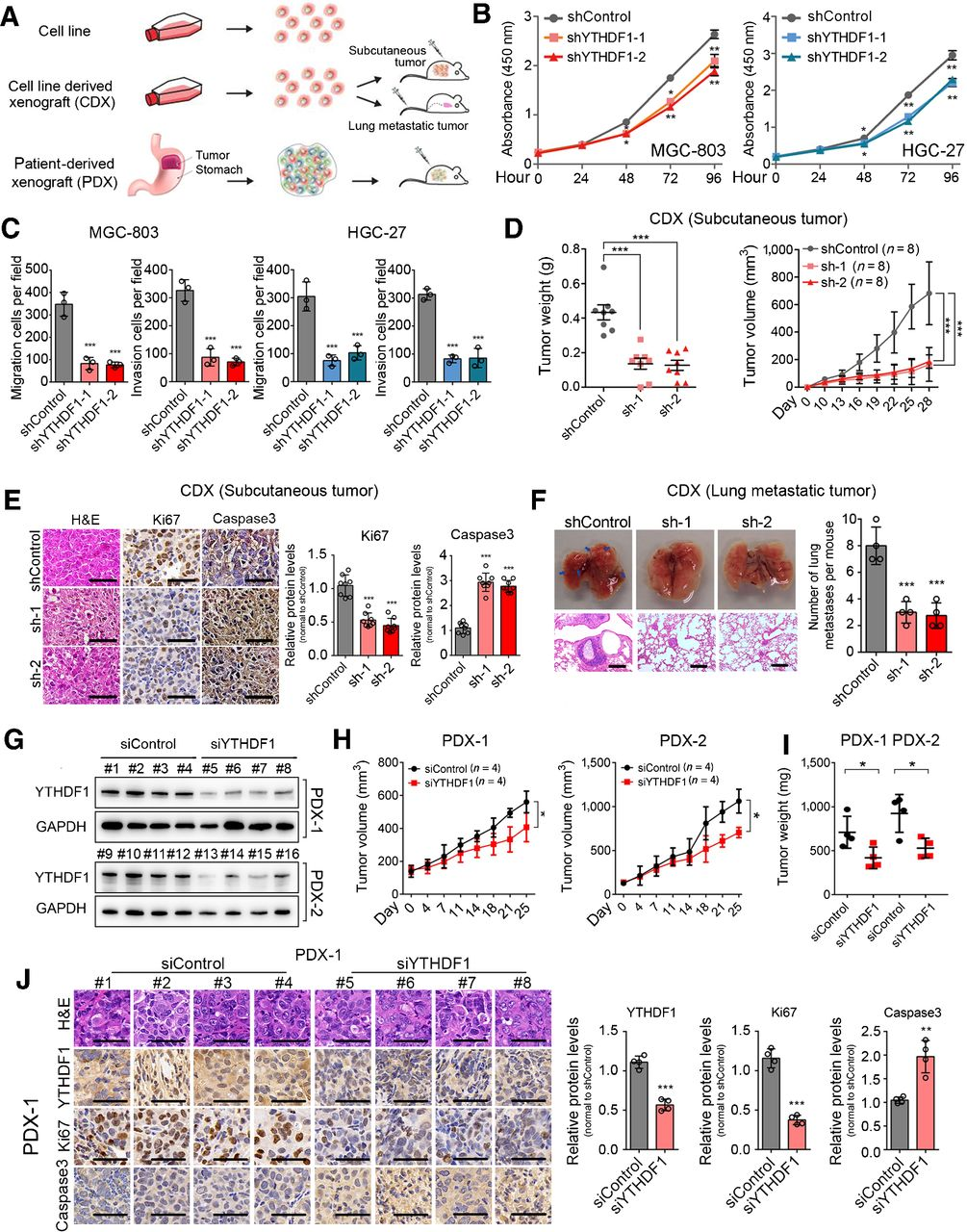
然后,探讨了YTHDF1是否有助于体内胃癌转移。尾静脉注射YTHDF1过表达MGC-803细胞导致肺转移,而YTHDF1的敲低几乎完全消除了转移性淋巴结形成。在腹膜转移性异种移植模型中,注射缺乏YTHDF1的MGC-80 细胞也显着减少了腹腔中的继发性肿瘤形成。所有这些结果都证实了 YTHDF1 通过调节细胞增殖和转移在胃癌发生中的致癌作用。为了进一步证实体内和体外研究得出的结论,建立了PDX模型,结果表明,敲除YTHDF1抑制了肿瘤生长和重量。此外,与siControl肿瘤相比,siYTHDF1治疗的肿瘤中Ki-67表达显着降低,而 siYTHDF1肿瘤中裂解的caspase-3显着增加。这些数据还揭示了YTHDF1在胃癌肿瘤发生中起重要作用。
通过RNA-seq、RIP-seq和MeRIP-seq鉴定YTHDF1调节的转录本
为了全面了解YTHDF1缺陷对胃癌发展的影响,对YTHDF1敲低和对照 MGC-803细胞进行了RNA-seq分析。RNA 分析揭示了在YTHDF1抑制后失调的不同转录本子集。GO分析表明,这些下调的基因富集了血管生成、细胞迁移、粘附和细胞生长;而映射到负调节肿瘤进展的基因被上调,即YTHDF1是胃癌的致癌因子。接下来通过在 MGC-803细胞中使用 RIP-seq 筛选 YTHDF1 结合基因。获得了9082个候选基因。分析了前3000个最显着的功能富集基因,表明它们高度参与了癌症相关通路。然而,累积分布分析表明YTHDF1结合基因和 YTHDF1未结合基因在转录水平上没有显着差异。这与之前YTHDF1主要调节基因翻译的发现一致。
YTHDF1是众所周知的m6A特异性读取蛋白,因此在 MGC-803 细胞内使用MeRIP-seq鉴定受YTHDF1调节的具有m6A修饰的潜在转录物。2365个转录物检测到m6A修饰,主要发生在 mRNA 中,优先聚集在外显子中。与其他N6-甲基腺苷测序结果一致,m6A峰在3'UTR 区域富集,并且仅用典型的 GGAC 基序检测到。
为了搜索YTHDF1的直接目标,将YTHDF1特异性RIP-seq和MeRIP-seq 鉴定的转录本重叠。对这些转录物的富集分析显示Wnt和Hippo信号通路受到显着影响,这两种通路都被证明对肿瘤进展至关重要,并且在各种癌症中经常发生突变,因此假设YTHDF1抑制通过Hippo或Wnt途径抑制肿瘤生长。
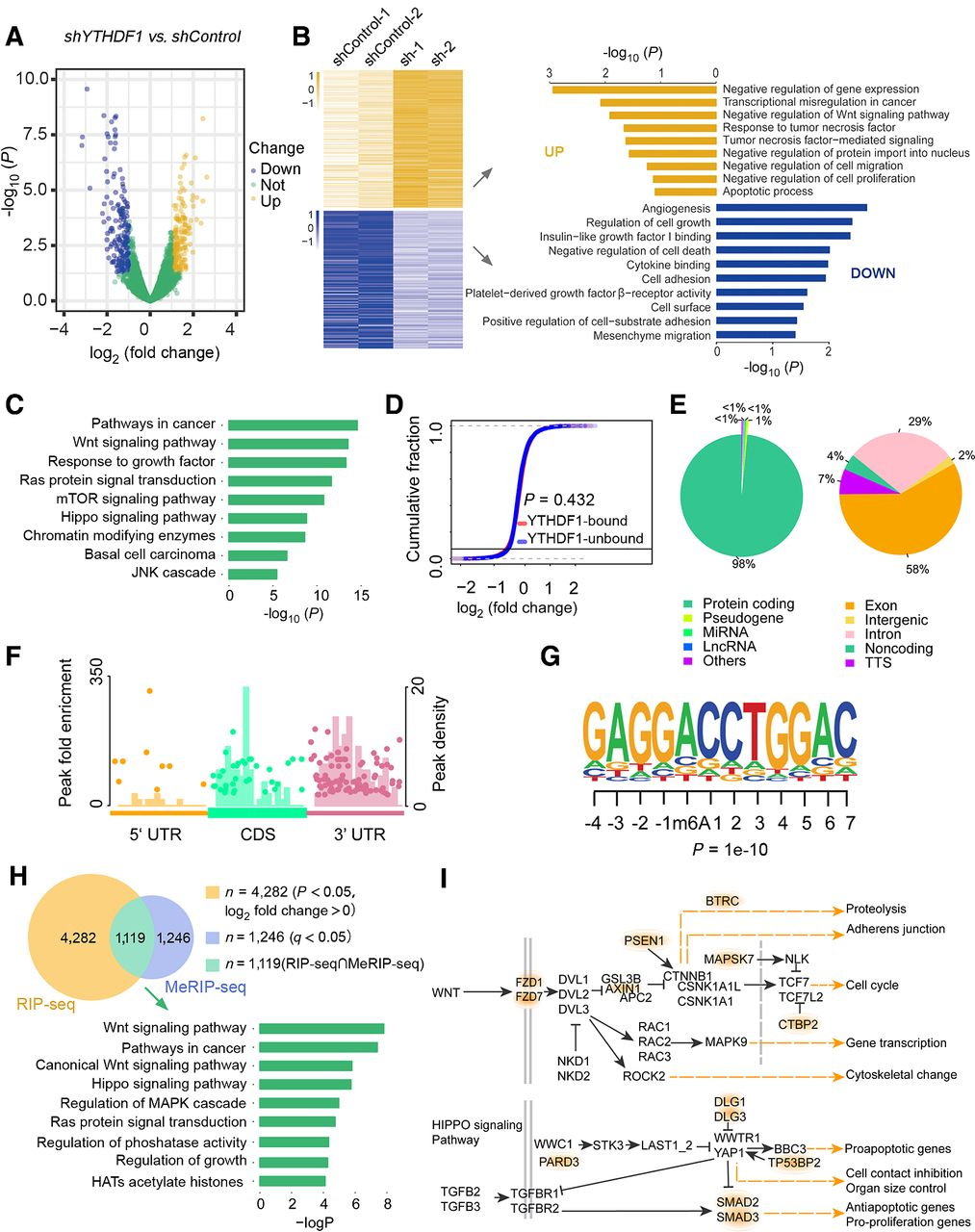
FZD7 是 YTHDF1 真正的 m6A 修饰目标
分配给Hippo或Wnt通路的总共13个转录本。为了验证胃癌中真正的 YTHDF1靶标,采用了多步骤筛选策略。首先,使用RIP结合qPCR验证确定YTHDF1 相互作用的转录本。包括FZD1、FZD7、CTBP2、MAPK9和MAP3K7属于Wnt 通路的转录本,以及属于Hippo通路的TP53BP1、PARD3、SMAD2和SMAD3都被YTHDF1抗体特异性地有效免疫沉淀。鉴于YTHDF1可以在翻译水平调节靶基因表达的概念,随后检测了这些候选基因在YTHDF1缺陷细胞中的表达。YTHDF1 敲低仅显着降低了FZD7、MAPK9、SMAD2、SMAD3 和 PARD3 的蛋白质水平,它们的mRNA 没有受到影响。
此外,m6A 免疫沉淀(m6A-RIP)和YTHDF1增强的交联免疫沉淀(eCLIP)和qPCR证实了m6A修饰的存在FZD、MAPK9、SMAD2、SMAD3和PARD3 mRNA的占用。接下来,进行了polysome分析,这种方法可以监测特定 mRNA 的翻译活性,以验证YTHDF1是否可以调节胃癌细胞中候选物的翻译。正如预期的那样,YTHDF1敲低显示出普遍的翻译抑制,因为YTHDF1缺陷的MGC-803细胞中的多核糖体关联逐渐减少。值得注意的是,FZD7的翻译效率是最显着下调的,而其他基因表现出轻微的翻译抑制。综上所述,这些结果共同表明 FZD7是YTHDF1在胃癌中的真正直接靶点。

YTHDF1以m6A依赖性方式调节FZD7表达
众所周知,FZD7作为一个特征明确的致癌基因,在胃癌患者中被激活以促进上皮间质转化。为了验证之前的发现,除了MGC-803之外,另一种胃癌细胞系HGC-27分别用于基因特异性m6A-qPCR 和YTHDF1 RIP-qPCR 分析。事实上,在FZD7 mRNA中观察到两个m6A峰,并且在MGC-803和HGC-2 细胞中都证实了与YTHDF1的关联。
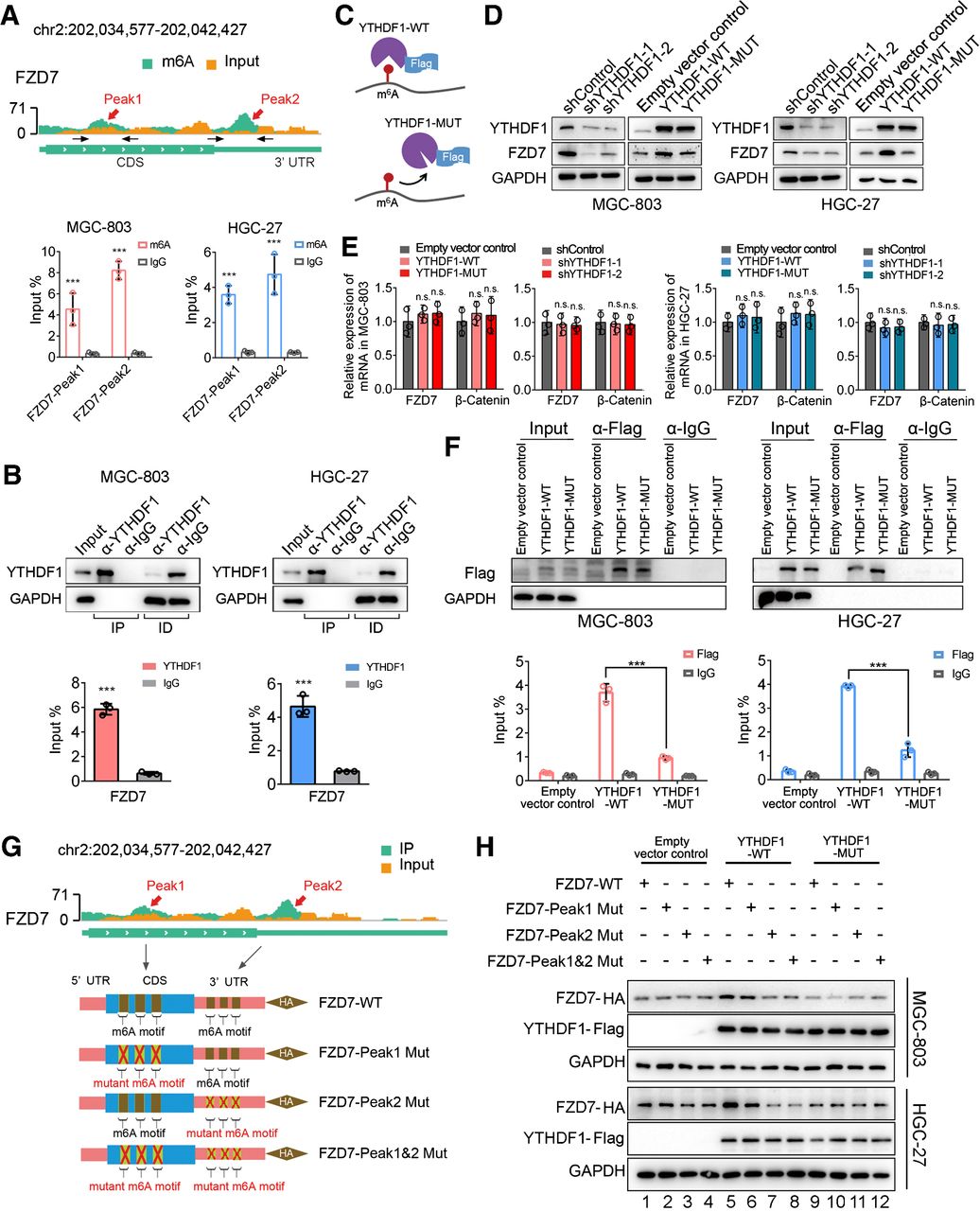
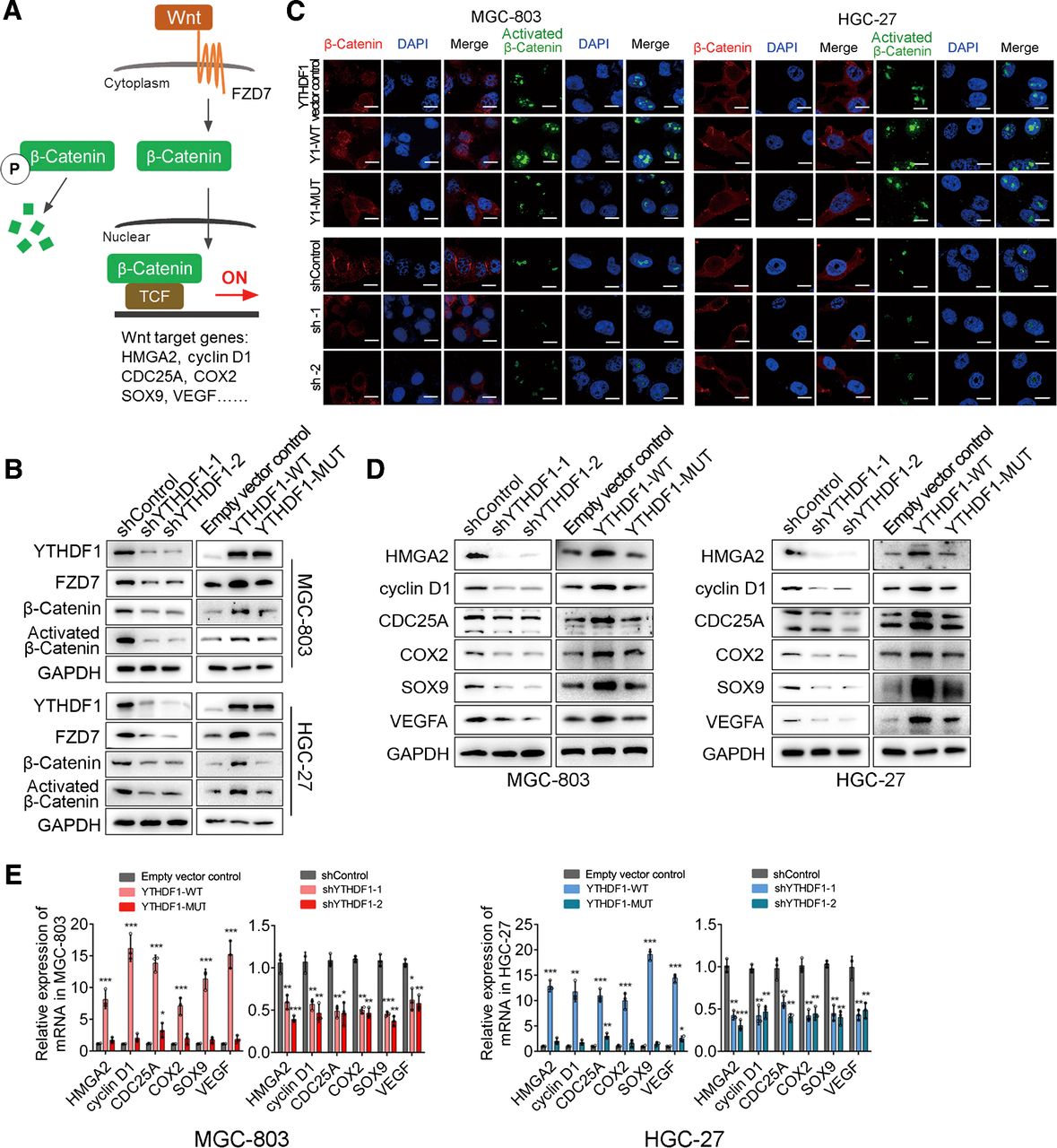
然后YTHDF1调节的FZD7翻译是否依赖于m6A修饰。为了解决这个问题,将带有两个关键氨基酸突变(K395A、Y397A)以消除其m6A结合域的Flag标记突变体YTHDF1构建体(YTHDF1-MUT)转染到MGC-803和HGC-27中细胞。引入这些突变后,由于m6A阅读器活性缺陷,在野生型YTHDF1 (YTHDF1-WT) 转染胃癌细胞中观察到的FZD7表达上调在 YTHDF1-MUT 中被消除(,但mRNA水平在两种细胞系中,YTHDF1-WT和YTHDF1-MUT之间的FZD7 相当。因此,RIP-qPCR分析显示FZD7 mRNA 与突变体YTHDF之间的相互作用明显受损。
为了进一步探索FZD7 mRNA中 m 6 A 修饰的参与,构建了三种类型的FZD7突变体,在第一个 (FZD7-Peak1 Mut) 或第二个 (FZD7-Peak2 Mut) m6A 峰以及双突变体(FZD7-Peak1&2 Mut)。有趣的是,与野生型 FZD7 (FZD7-WT) 相比,第二个m6A峰内的突变和双m6A 峰突变体对野生型YTHDF1没有反应过表达,表明FZD7 中的第二 m6A峰是YTHDF1调控的关键位点。再次,损失 m6A 结合能力完全消除了YTHDF1在促进FZD7 mRNA翻译中的作用。这些结果表明YTHDF1介导的FZD7的翻译控制依赖于m6A修饰。
YTHDF1通过FZD7调节Wnt/β-catenin通路
在Wnt配体与受体结合后,β-catenin被稳定并转移到细胞核中(激活形式),在那里它与其他共激活因子相互作用以激活下游基因转录。因为FZD7可以激活胃癌细胞中的经典Wnt信号传导并且YTHDF1是FZD7表达的正调节因子,假设YTHDF1可以直接调节Wnt通路。为了检验这一假设,分别检查了总β-catenin和活化β-catenin。正如预期的那样,当敲除YTHDF1后FZD7表达被抑制时,还观察到MGC-803和HGC-27细胞中总和活化的β-catenin的表达降低。此外,只有野生型YTHDF1,而不是突变型,在胃癌细胞中增加FZD7并激活β-catenin表达,表明YTHDF1以m6A依赖性方式激活β-catenin。使用 IF 染色,观察到过表达野生型YTHDF1而不是突变形式的胃癌细胞显示出更强烈和累积的 β-catenin染色。相反,与对照细胞相比,YTHDF1 敲低细胞显示出较少的 β-catenin积累。一致地,Wnt/β-catenin 途径的其他六个已知下游参与者,包括HMGA2、CNCD1、CDC25A、COX2、SOX9和 VEGFA在转录和翻译水平上以与β-catenin 相似的方式进行调节,即在野生型而非突变型YTHDF 过表达细胞中上调,而在 YTHDF1 敲低细胞中下调。此外,在来自基因表达综合数据库的胃癌数据集中,YTHDF1水平与这些β-catenin靶标的表达之间也存在很强的相关性。综上所述,这些结果表明YTHDF1可以激活胃癌细胞中的Wnt/β-catenin 通路,该通路由 FZD7的翻译控制介导,FZD7 是Wnt/β-catenin信号传导的关键受体。
YTHDF1-FZD7-β-catenin轴有助于胃肿瘤发生
在YTHDF1刺激FZD7-β-catenin通路激活的发现的推动下,β-catenin激活是否可以挽救在YTHDF1缺陷型胃癌细胞中观察到的延迟肿瘤进展表型。因此,使用了两种不同的方法,通过过表达FZD7或通过用特定激动剂 SKL2001(刺激β-catenin,这可以破坏降解复合物并稳定β- catenin。与之前的发现类似,FZD7 的过表达或激活β-catenin都增加了细胞增殖、迁移和侵袭在YTHDF1感受态的 MGC803和HGC-27细胞中。此外,在YTHDF1敲低细胞中FZD7过表达或 SLK2001处理可以将受损的恶性表型重建到与YTHDF1感受态细胞相当的水平。。总之,β-catenin 通路的遗传或药理学激活可以挽救YTHDF1缺陷引起的增殖、迁移和侵袭减少。
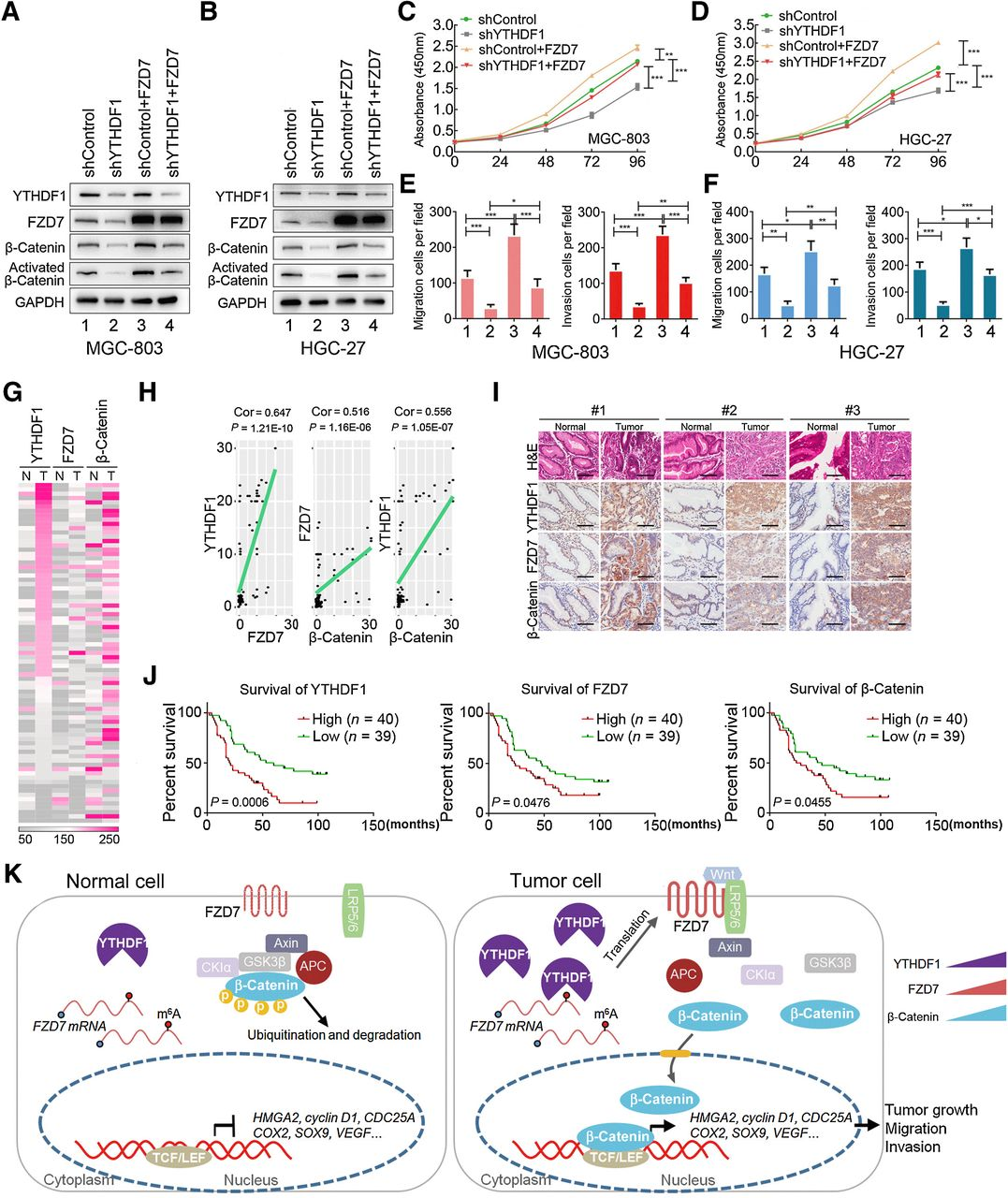
为了进一步研究患者的胃肿瘤组织中是否发生蛋白质表达的变化,对79对内部人胃癌样本进行了IHC芯片分析,并对18对胃癌组织及其邻近正常组织进行了蛋白质印迹分析。正如预期的那样,YTHDF1,FZD7和活化的β-catenin在人胃肿瘤显示出相似的上调时与相邻的正常组织,这在PDX 数据集中证实,抑制YTHDF1也抑制了FZD7和β-catenin的活性。此外,Kaplan-Meier生存分析还表明,具有高YTHDF1、FZD7、β-catenin表达的胃癌患者的总生存期较差,表明胃肿瘤中YTHDF1、FZD7 和活化β-catenin的同步变化代表了可靠的预后指标。β-catenin在正常胃粘膜中由蛋白质降解系统严格维持。然而,在胃癌细胞中,升高的YTHDF1激活FZD7的翻译和表达,从而刺激β-catenin并易位至细胞核以激活下游靶基因的转录。因此,数据揭示了一种新的 YTHDF1-FZD7-β-catenin轴,该轴对于调节胃癌发展中的细胞增殖和转移至关重要。






