高分SCI标准思路借鉴文献——circRNF13通过SUMO2抑制肿瘤进展
虽然目前circRNA在人类癌症发展中的功能已有广泛的研究,但是医学界对其在鼻咽癌(NPC)中作用仍然知之甚少。该文发现circRNF13通过SUMO2的泛素化可抑制鼻咽癌的增殖和转移。本文于2021年8月发表在《Molecular Cancer》IF: 27.401期刊上。
技术路线:

主要实验结果:
1、CircRNF13在鼻咽癌临床样本中低表达
作者对NPC细胞进行高通量测序获得cicRNA表达谱,总计鉴定到6153个circRNAs,并包括了5种类型的circRNA(图1A)。其中丰度较高的circRNF13相对于非肿瘤的鼻炎上皮细胞(NPE),在NPC中显著下调。circRNF13是有外显子8和外显子2反向剪切形成,在细胞核和细胞质中均有分布,并且可在RNase R处理下稳定存在。以上结果表明circRNF13可能影响NPC的进展。

图1 CircRNF13在NPC中低表达
2、CircRNF13抑制NPC细胞的增殖迁移和侵袭
如图2所示,在NPC细胞系HNE2和CNE2中,过表达circRNF13都会显著抑制NPC细胞的增殖,减少G2/M的细胞比例,以及侵袭和迁移。但是干扰circRNF13的表达则有完全相反的结果。提示circRNF13抑制NPC的生物学功能。

图2 CircRNF13抑制NPC的增殖、迁移和侵袭
3、在体内circRNF13抑制NPC的生长和转移
如图3所示,和体外实验类似,过表达circRNF13会抑制NPC的肿瘤生长和肺转移,而干扰circRNF13则逆转这些结果。表明circRNF13在体内也可发挥抑制NPC生长的作用。
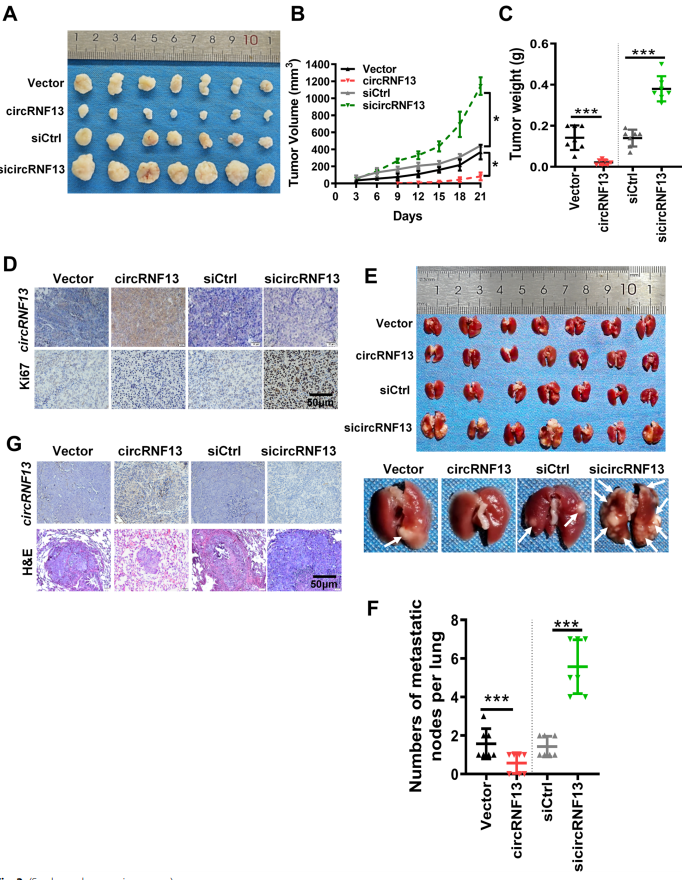
图3 CircRNF13在体内抑制NPC生长和转移
4、CircRNF13可能通过抑制糖酵解抑制NPC的迁移和侵袭
为了探究circRNF13的作用机制,作者对si-circRNF13细胞系进行了LC-MS/MS检测,结果鉴定到294个差异表达蛋白,他们的IPA分析结果显示主要富集与糖酵解途径。这些结果暗示circRNF13可能在NPC中参与调节糖酵解途径。
生化分析结果显示,过表达circRNF13会抑制NPC细胞的葡萄糖摄取和乳酸生成(图4A)。海马实验也表明过表达增加细胞的糖酵解能力,干扰则相反(图4B)。通过检测细胞内AMPK的水平监测糖酵解通路。研究表明当糖酵解被抑制,细胞内AMPK水平被磷酸化激活,激活的AMPK通过抑制mTOR会抑制蛋白合成和转录,进而抑制肿瘤生长和转移。结果显示,过表达circRNF13显著增加了NOC细胞中AMPKα的磷酸化并下调mTOR水平,并进一步下调下游靶基因mTOR,pS6K和4EBP1的表达;而敲除circRNF13则有相反的效果(图4C)。当加入糖酵解抑制剂2-DG后,敲除circRNF13不能下调AMPKα的磷酸化(图4D)。此外,敲除circRNF13造成的NPC的增殖和迁移会被2-DG所废除(图4E-F)。以上结果表明circRNF13通过抑制糖酵解抑制NPC的迁移和侵袭。

图4 CircRNF13抑制NPC细胞的糖酵解
5、CircRNF13通过促进GLUT1的泛素化抑制NPC细胞的糖酵解
为了探究circRNF13调控糖酵解机制,作者检测了糖酵解通路上的代表性分子GLUT1,LDHA和HK2,结果发现只有GLUT1的蛋白水平在过表达circRNF13后显著下调,而mRNA水平没有改变(图5A,B)。于是进一步研究GLUT1。作者推测circRNF13可能是通过影响GLUT1蛋白稳定性来调节糖酵解通路的,因此使用环己酰亚胺(CHX)处理NPC细胞在circRNF13过表达或敲除后。结果发现GLUT1的稳定性下降,且泛素化水平下降,以响应circRNF13的过表达,而敲除circRNF13后其稳定性增强且泛素化增加。因此,以上结果说明circRNF13可能通过介导GLUT1的降解来调节糖酵解通路的。
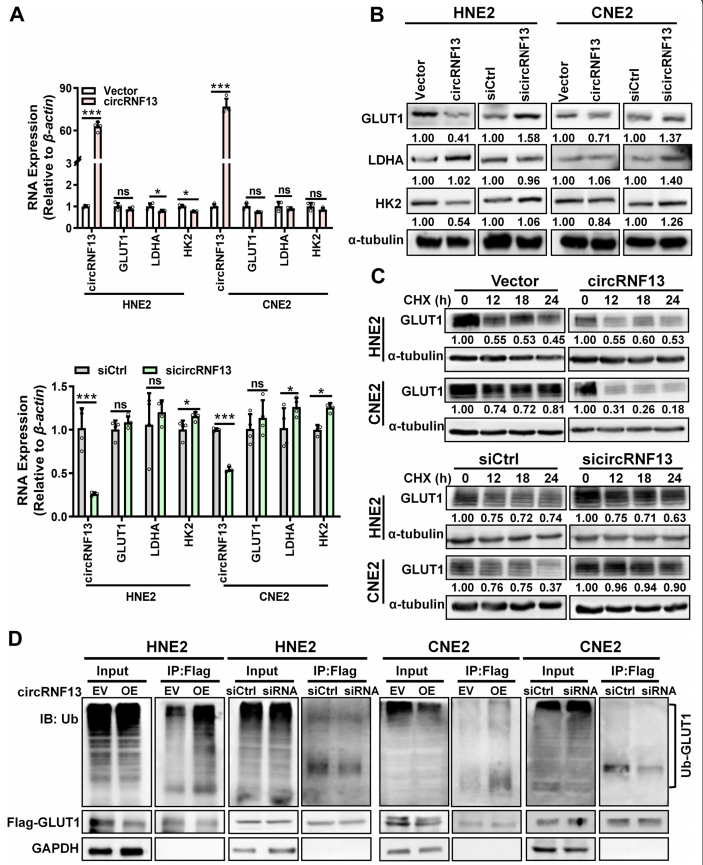
图5 CircRNF13通过促进GLUT1泛素化抑制NPC细胞的糖酵解
6、CircRNF13直接结合SUMO2 mRNA的3’UTR稳定SUMO2
为了探究circRNF13调节GLUT1泛素化的机制,作者进行了LC-MS/MS,其中SUMO2引起了作者的注意。SUMO2类泛素化修饰(SUMOylation)是泛素化样蛋白修饰成员可以调节蛋白降解通过泛素化途径。并且研究表明SUMO2在NOC中是抑制糖酵解的。
于是探究circRNF13与SUMO2的结合关系。与预期一致,过表达circRNF13会在mRNA和蛋白水平诱导SUMO2的表达上调,干扰circRNF13则效果相反(图6A-B)。生信分析揭示circRNF13和SUMO2的非编码区存在结合位点。RNA pull-down显示生物素标记的circRNF13可以下拉SUMO2的mRNA在NPC细胞中。上荧光素酶实验表明过表达circRNF13会提高SUMO2的荧光素酶活性。以上数据表明circRNF13通过与SUMO2结合调节其表达。

图6 CircRNF13直接结合并稳定SUMO2 mRNA,上调其表达
7、CircRNF13通过SUMO2促进SLUT1的泛素化
接下来探究circRNF13是否是通过SUMO2来促进SLUT1的泛素化的。利用anti-Flag-GLUT1抗体进行共免疫沉淀(Co-IP)实验,验证GLUT1与SUMO2蛋白之间的相互作用。在SUMOylation期间,UBC9是唯一可以直接识别底物并催化SUMO蛋白c端羧基与底物蛋白结合进行修饰的连接酶。Co-IP实验揭示了GLUT1和UBC9之间的相互作用(图7A-B)。免疫荧光也显示SUMO2和GLUT1蛋白有共定位。WB显示过表达circRNF13促进GLUT1的SUMOylation,敲低circRNF13抑制GLUT1的SUMOylation(图7D)。此外,泛素化实验表明,过表达SUMO2可加速GLUT1的泛素化,而当共转染si-circRNF13和SUMO2过表达载体时,si-circRNF13可减弱SUMO2诱导的GLUT1泛素化水平(图7E-F)。这些结果提示,circRNF13通过与SUMO2结合调控GLUT1泛素化。总之,circRNF13促进GLUT1的泛素化,抑制GLUT1的表达,从而抑制NPC细胞的糖酵解过程。
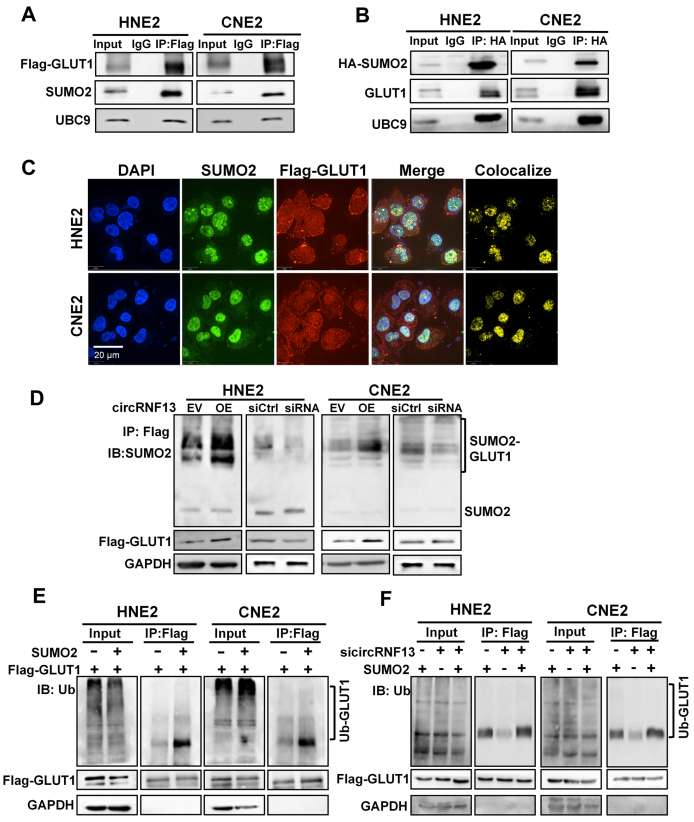
图7 CircRNF13通过SUMO2促进GLUT1的泛素化
最后,作者进行了拯救实验,如图8A-D所示,抑制circRNF13会促进NPC的生物学功能,包括增殖,迁移和侵袭,但是过表达SUMO2会显著挽救circRNF13敲除带给NPC细胞的表型改变。免疫组化显示,SUMO2在circRNF13过表达裸鼠肿瘤切片中低表达,而GLUT1则显著高表达。以上证实circRNF13通过SUMO2抑制NPC的增殖和转移。

图8 CircRNF13通过SUMO2抑制NPC的增殖和转移
总之,这些结果强调了circRNF13在鼻咽癌增殖和转移中的重要意义。CircRNF13作为抑癌因子直接与SUMO2的3 -UTR结合,延长了SUMO2 mRNA的半衰期。上调SUMO2通过GLUT1的泛素化来促进GLUT1降解,这些通过抑制糖酵解调控AMPK-mTOR通路,最终导致鼻咽癌的增殖和转移。
参考文献:
Mo Yongzhen., Wang Yumin., Zhang Shuai., Xiong Fang., Yan Qijia., Jiang Xianjie., Deng Xiangying., Wang Yian., Fan Chunmei., Tang Le., Zhang Shanshan., Gong Zhaojian., Wang Fuyan., Liao Qianjin., Guo Can., Li Yong., Li Xiaoling., Li Guiyuan., Zeng Zhaoyang., Xiong Wei.(2021). Circular RNA circRNF13 inhibits proliferation and metastasis of nasopharyngeal carcinoma via SUMO2. Mol Cancer, 20(1), 112. doi:10.1186/s12943-021-01409-4






