5'-tRF-GlyGCC: 一种tRNA衍生的小RNA,作为结直肠癌诊断的新生物标志物

tRNA衍生的小RNA (tDRs)广泛分布于血液和尿液等人体组织中,在癌症的进展中发挥着重要作用。然而,tDRs在结直肠癌(CRC)血浆中的表达及其潜在的诊断价值尚未得到系统的探讨。目前有作者发现血浆中5'-tRF-GlyGCC的表达水平是一种很有前景的CRC诊断生物标志物,该研究于2021年2月发布在《Genome Medicine》,IF:10.675。
技术路线:
主要研究结果:
1. 大肠癌CRC和健康志愿者HC血浆中tDRs的表达谱
为了研究tDRs在CRC和HC血浆中的表达谱,作者使用小RNA高通量测序分析了3名CRC和3名HC受试者血浆样本(表S1)中10 - 50 bp范围内的小RNA (smRNA)。分析表明,在HCs和CRC血浆中,tDRs的丰度按5’-tRF>5’-half/i-tRF>3’-tRF>3’-half的顺序降低(图1a)。此外,大肠癌血浆中5-tRF的比例显著高于HCs(图1a),表明5’-tRF可能参与大肠癌的发生和进展。进一步分析单个tDR谱的表达。分层聚类显示HCs和HCs之间血浆中tDR表达存在系统性差异(图1b),分别在CRC和HCs中获得628和745个tDR。进一步分析CRC和HC血浆中5 -tRFs的差异。结果显示,CRC血浆中的5' -tRF谱与HC血浆中的5 ’-tRF谱有较大差异(图1c)。例如,HC和CRC血浆中5’ -tRF丰度最高的分别是5’ -tRF- HISGTG和5’ -tRF- GLYGCC。5’-tRF- GLYGCC在HC血浆中占5’ -tRF的7.44%,而在CRC血浆中占5’ -tRF的52.24%。此外,5’-tRF-GlyCCC在CRC血浆中的比例明显升高;而5’-tRF-HisGTG和5’-tRF-AlaTGC在CRC血浆中的比例明显降低(图1c)。所有这些数据表明5’-tRFs在CRC血浆中与在HC中有显著差异。
在CRC和HC鉴定的628个和745个tDR中,每组分别有85个和202个tDR(图1d)。此外,CRC患者血浆中81个tDR较HC患者明显增加(图1d)。为了验证小RNA测序结果,对上述3例CRC和3例HC受试者血浆样本中5例上调的候选tDR进行了qRT-PCR检测。如图1e所示,CRC血浆中测量到的tDRs均较HC升高,其中5’-tRF-GlyGCC的升高幅度最大。所有这些数据表明,与HC相比,CRC患者血浆中tDRs的表达谱存在差异;此外,5’-tRF,特别是5’-tRF- glygcc在CRC血浆中显著升高。
表S1小RNA测序样本的背景信息

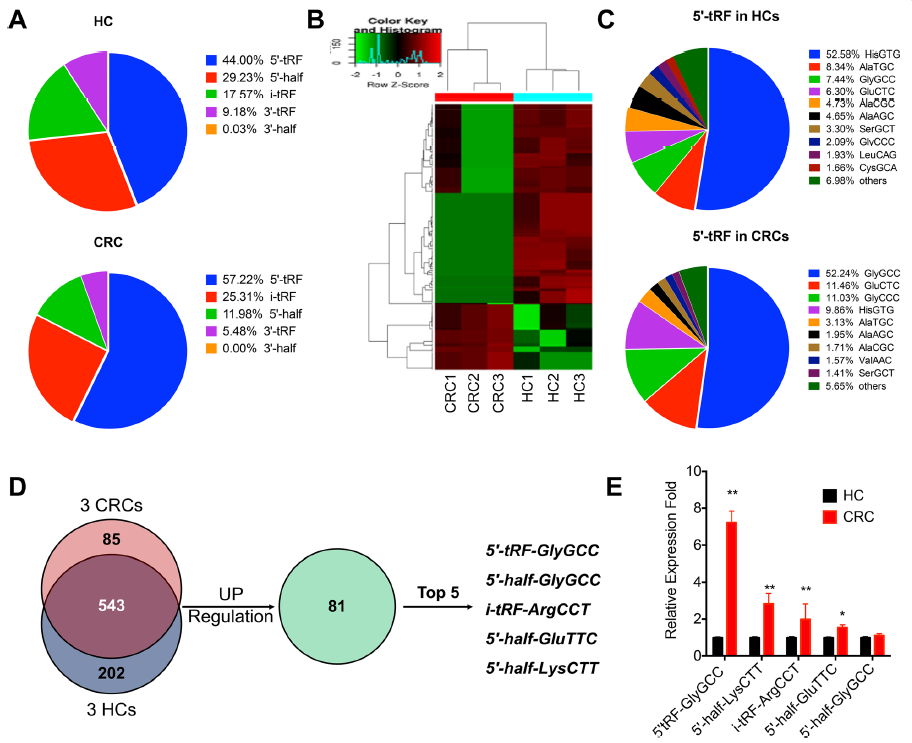
图1 tDR在CRC和HC血浆中的表达谱
2. CRC患者血浆中5'-tRF-GlyGCC水平
5’-tRF-GlyGCC位于第1、2、6、16、17染色体上,转录本长度为31 nt,序列为5’-GCA UGG GUG GUU CAG UGG UAG AAU UCU CGC C-3’ (MINTbase Unique ID: tRF-35- PNR8YP9LON4VN1)。小RNA-seq数据提示5’-tRF-GlyGCC在CRC患者中的升高高于其他tDR。进一步检测了其在CRC (n = 105)和HC (n = 90)患者血浆中的表达。我们的数据显示,5’-tRF-GlyGCC在CRC患者中的丰度明显高于HC (图2)。然后分析了5’-tRF-GlyGCC在CRC患者不同病理阶段(I期,n = 11;阶段II, n = 34;III期,n = 32;IV期,n = 25)。结果表明,CRC各阶段5’-tRF-GlyGCC含量均高于HC (图2 b)。结果表明5’-tRF-GlyGCC可能是一种有前景的诊断CRC患者的生物标志物。
5’-Trf-GlyGCC的表达随着CRC进展而增加(图2b)。此外,5’-tRF-GlyGCC在I/II期CRC患者中的丰度明显低于III/IV期患者(图2c)。转移组患者血浆5’-tRF-GlyGCC水平明显高于无转移组(图2 d)。CEA≥5 ng/ml组的5’-tRF-GlyGCC水平明显高于CEA < 5 ng/ml(图2e)。CRC患者CA199≥37 IU/ml的5’-tRF-GlyGCC水平明显高于CA199 <37 IU/ml(图2f)。结果显示,CRC患者血浆中5’-tRF-GlyGCC水平与CEA(图2g)和CA199(图2h)水平显著正相关。5’-tRF-GlyGCC在结直肠癌患者血浆中上调,并随着结直肠癌的进展和转移而升高。
收集16对肿瘤组织和血浆样本,验证5’-tRF-GlyGCC在CRC组织和相同患者血浆中的表达是否存在相关性。结果显示5’-tRF-GlyGCC在血浆中的表达与配对CRC组织中的表达显著相关(图2i)。提示血浆中5’-tRF-GlyGCC水平较高的患者在结直肠癌组织中5’-tRF-GlyGCC水平也较高。
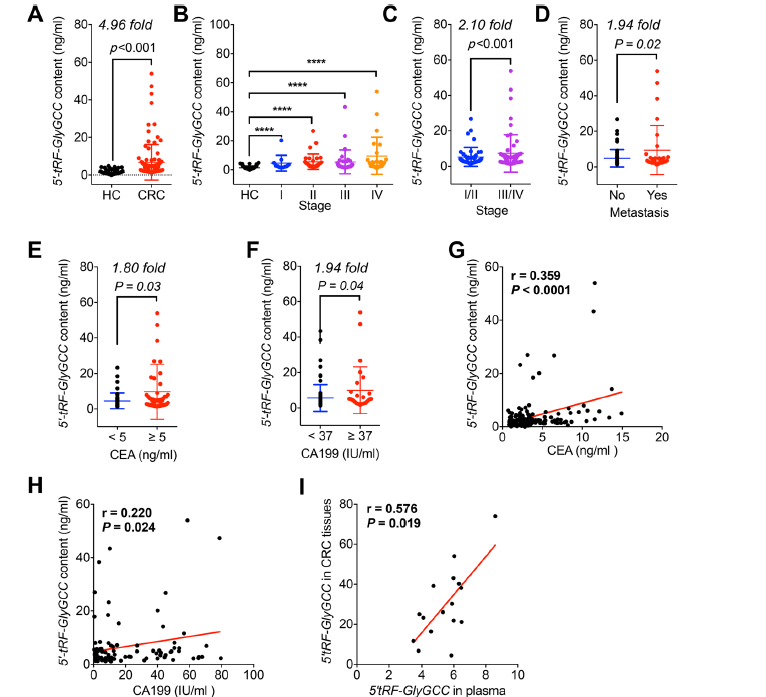
图2 CRC患者血浆5’-tRF-GlyGCC水平
3. 5’-tRF-GlyGCC作为CRC患者的biomarker的诊断价值
为了检测血浆5’-tRF-GlyGCC水平是否对CRC患者具有诊断价值,ROC曲线以确定临界值。从图3a看出,血浆5’-tRF-GlyGCC含量可以区分CRC患者和HC,曲线下面积(AUC)为0.882。5’-tRF-GlyGCC的最佳截断值为1.9725(敏感性86%,特异性72%)(图3b)。结果表明,5’-tRF-GlyGCC的诊断价值远高于CEA (AUC 0.762)和CA199(0.557)。此外,5’-tRF-GlyGCC、CEA和CA199组合的ROC曲线将AUC值提高到0.926 (图3 c)。联合的最佳临界值为3.1273(敏感性86,特异性84%)(图3d)。这说明血浆5’-tRF-GlyGCC水平对CRC患者具有良好的诊断能力。
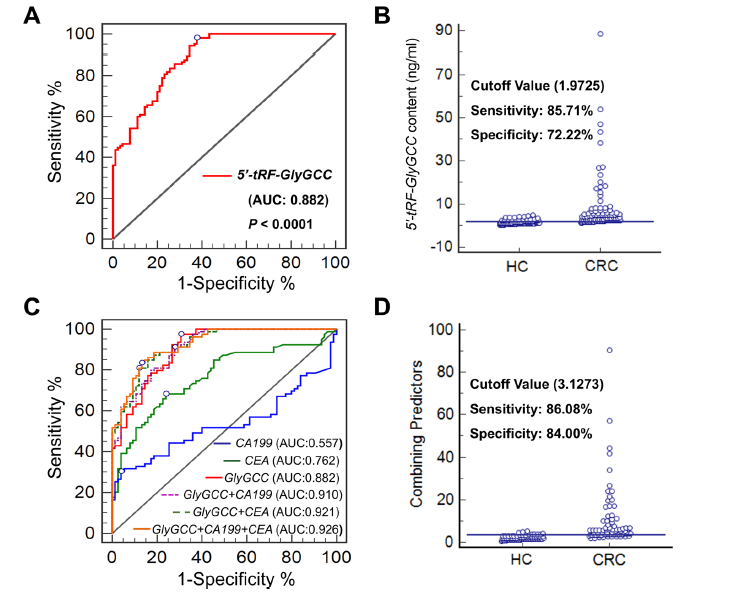
图3 5’-tRF-GlyGCC作为CRC患者的biomarker的诊断价值
4. ALKBH3参与了5’-tRF-GlyGCC的生物发生
LKBH3是一个tRNA去甲基化酶,仅被鉴定为诱导tDRs的生成。为了研究ALKBH3是否参与了5’-tRF-GlyGCC的生物发生。首先,检测5’-tRF-GlyGCC和ALKBH3在9种人CRC细胞系和人结肠黏膜上皮细胞NCM460中的表达。结果显示,在大多数测量的CRC细胞系中,5’-tRF-GlyGCC (图4a)和ALKBH3 mRNA(图4b)均显著高于NCM460细胞。同样,western blot分析证实,在CRC细胞中,ALKBH3蛋白表达上调(图4c)。此外,5’-tRF-GlyGCC的表达与测量的CRC细胞中ALKBH3的mRNA水平显著正相关(图4d)。
过表达ALKBH3可以增加5’-tRF-GlyGCC的表达(图4 E)。ALKBH3沉默降低了SW480、RKO和PENG-EBV细胞中5’-tRF-GlyGCC的水平(图4f)。一致地,在RKO和SW480细胞中过表达ALKBH3可以增加5’-tRF-GlyGCC的表达(图S4 C),而在HCT15和HCT116细胞中,抑制ALKBH3的表达可以降低5’-tRF-GlyGCC的表达(图S4 D)。证明了,tRNA去甲基化酶ALKBH3参与了CRC和血细胞中5’-tRF-GlyGCC的生物发生。
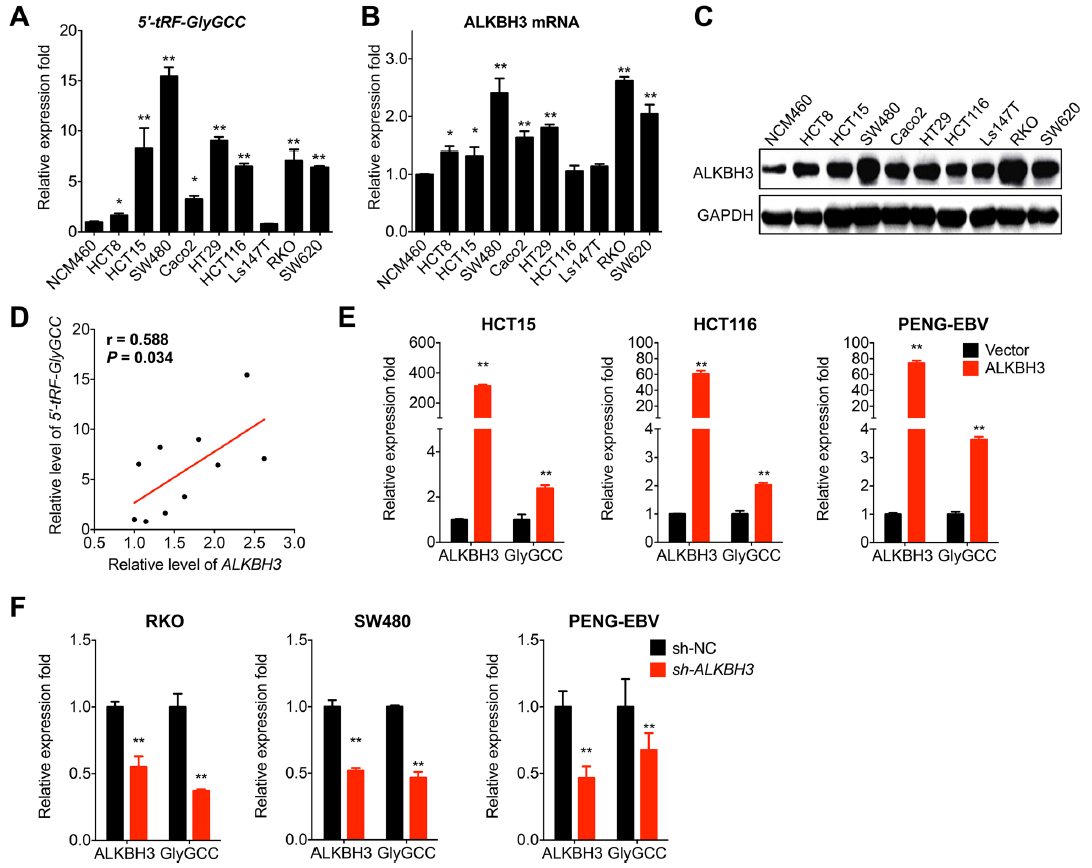
图4 ALKBH3参与了5’-tRF-GlyGCC的生物发生
5. 与CRC细胞共培养可通过ALKBH3增加血细胞5’-tRF-GlyGCC
与所有检测的CRC细胞共培养可显著提高PENG-EBV细胞中的5’-tRF-GlyGCC水平。与CRC细胞共培养可显著提高THP-1细胞中5’-tRF-GlyGCC水平(图5b)。与所有CRC细胞共培养时,PENG-EBV细胞中ALKBH3 mRNA的表达也明显增加(图5c)。western blot分析证实,与CRC细胞共培养提高了PENG-EBV细胞中ALKBH3蛋白的表达(图5d)。
作者进一步研究了ALKBH3是否参与CRC诱导的血细胞5’-tRF-GlyGCC。ALKBH3在PENG-EBV细胞中的表达被下调(图5e)。结果表明,缺失ALKBH3可减弱SW620(图5f)和SW480(图5g)诱导的PENGE- EBV细胞中5’-tRF-GlyGCC的表达。提示CRC细胞可通过上调ALKBH3上调外周血5’-tRF-GlyGCC水平。
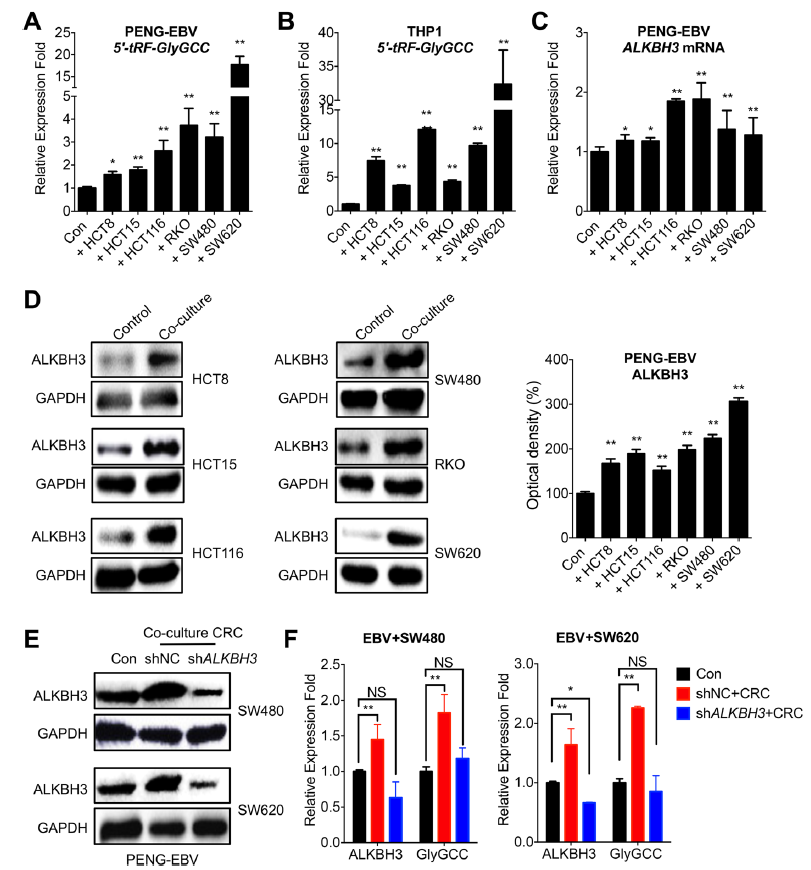
图5与CRC细胞共培养可通过ALKBH3增加血细胞5’-tRF-GlyGCC
6. 异种移植的CRC肿瘤增加了小鼠血浆中5’-tRF-GlyGCC的水平
为了评价体内CRC肿瘤对5’-tRF-GlyGCC表达的影响,使用BALB/c-nu-nu小鼠建立了人CRC HCT116异种移植瘤。与对照组相比,移植裸鼠血浆5’-tRF-GlyGCC水平显著升高(图6)。此外,外周血中ALKBH3 mRNA的表达显著升高(图6 b)。小鼠CRC CT26细胞与BALB/c小鼠建立异种移植,结果显示,外周血中5’-tRF-GlyGCC水平(图6c)和ALKBH3 mRNA表达(图6d)显著。此外,在荷瘤小鼠中5’-tRF-GlyGCC的表达水平与ALKBH3的表达显著正相关(图6e)。这些结果表明,CRC异种移植可促进血浆5’-tRF-GlyGCC水平,并伴有体内ALKBH3的上调。
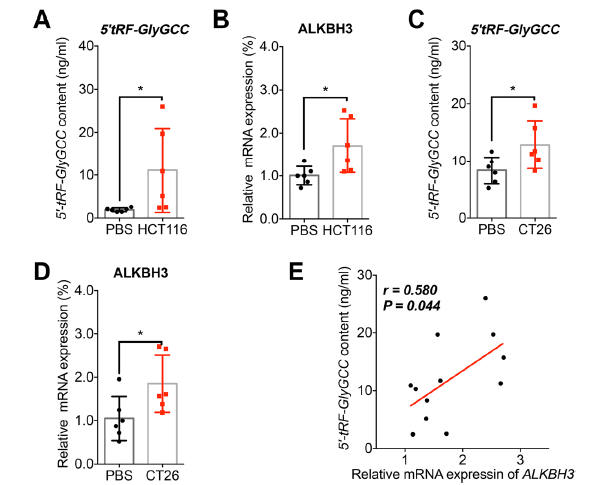
图6异种移植的CRC肿瘤增加小鼠血浆中5’-tRF-GLYGCC的水平
结论:
该研究显示了CRC患者血浆中tDR的分布和丰度,并强调5’-tRF-GLYGCC是一种有前景的CRC诊断生物标志物。此外,通过分析带有细胞的肿瘤小鼠的数据发现,CRC中5’-tRF-GLYGCC的高水平可能是由于tRNA去甲基化酶ALKBH3的上调。需要注意的是,tDRs的组成在不同的肿瘤模型中可能是不同的;5’-tRF-GLYGCC作为生物标志物的作用及其在其他类型癌症中的致癌作用还需要进一步研究。
参考文献:
Wu Y, Yang X, Jiang G, Zhang H, Ge L, Chen F, Li J, Liu H, Wang H. 5'-tRF-GlyGCC: a tRNA-derived small RNA as a novel biomarker for colorectal cancer diagnosis. Genome Med. 2021, 13(1):20. doi: 10.1186/s13073-021-00833-x.






