国自然热点之焦亡
细胞焦亡又称细胞炎性坏死,是一种最新发现的细胞程序性死亡方式。主要通过炎症小体介导包含Caspase-1在内的多种Caspase的激活,造成包括GSDMD在内的多种Gasdermin家族成员发生剪切和多聚化,造成细胞穿孔,进而引起细胞死亡。相比于细胞凋亡,细胞焦亡发生的更快,并会伴随着大量促炎症因子的释放,在形态学上同时具有坏死和凋亡的特征。近年来在国自然基金中标项目中细胞焦亡相关项目日益增多,且增长趋势明显。

乳腺癌 (BrCa) 是最常见的癌症,也是女性癌症相关死亡的第二大原因。随着乳腺筛查的发展,5年相对生存率有所提高,但复发和转移性BrCa的治疗仍然是一个巨大的挑战。今天我们讲一篇关于乳腺癌焦亡的文章,该文章题名为Tumor suppressor DRD2 facilitates M1 macrophages and restricts NF-κB signaling to trigger pyroptosis in breast cancer,2021年3月5日发表于Theranostics期刊。
DRD2通过 BrCa 中的启动子甲基化被转录下调
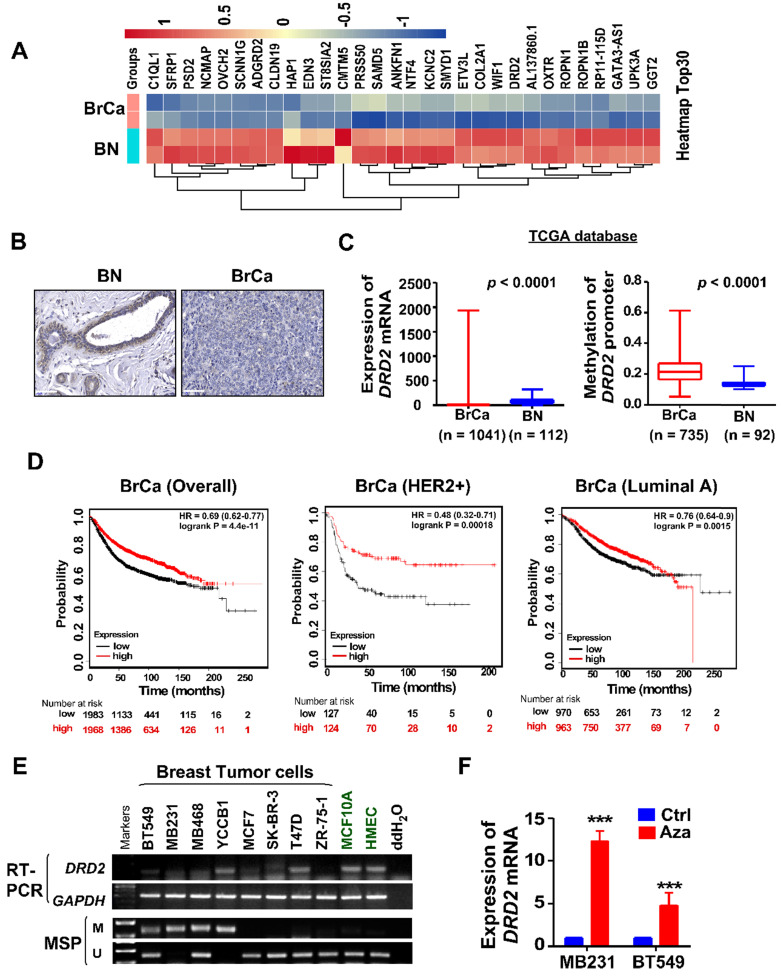
为了研究新的潜在肿瘤抑制基因 (TSG),使用BrCa组织和正常组织进行 测序筛选。发现与正常乳腺组织相比,BrCa组织中DRD2的mRNA表达显着下调。通过IHC染色,与BrCa组织相比,在正常乳腺组织中也发现了更高的DRD2蛋白水平。TCGA数据显示,在BrCa中DRD2 mRNA的下调,并且DRD2的启动子甲基化在BrCa中也更频繁。在另一个数据库MethHC上进一步分析了表达和启动子甲基化状态。与DRD3和DRD4不同,发现DRD2伴随启动子的高甲基化状态被下调。基于TCGA数据库分析BrCa患者DRD2表达与病理特征的关系。DRD2的高表达与患者年龄呈负相关。此外,在HER2 阴性患者中DRD2表达较高。还分析了DRD2启动子甲基化与病理特征之间的关系。结果表明,DRD2甲基化增加在老年人群中更为常见。基于Kmplot,DRD2 的更高表达促进了BrCa患者的更长生存期,这在HER2阳性基因型患者中也可见。但是这种优势在患者中没有看到。根据RT-PCR和MSP结果,与永生化的正常乳腺细胞系相比,几乎所有BrCa细胞系中都可以看到DRD2 mRNA表达的下调以及的启动子甲基化。因此,DRD的高甲基化频率可能有助于其下调BrCa。用 Aza进行药理去甲基化恢复了两个BrCa细胞系MDA-MB231和BT549中DRD2的表达。DRD2 是一种潜在的 TSG,也是预测 BrCa 患者预后的有希望的生物标志物。
DRD2 作为 TSG 起作用并抑制上皮间质转化 (EMT)
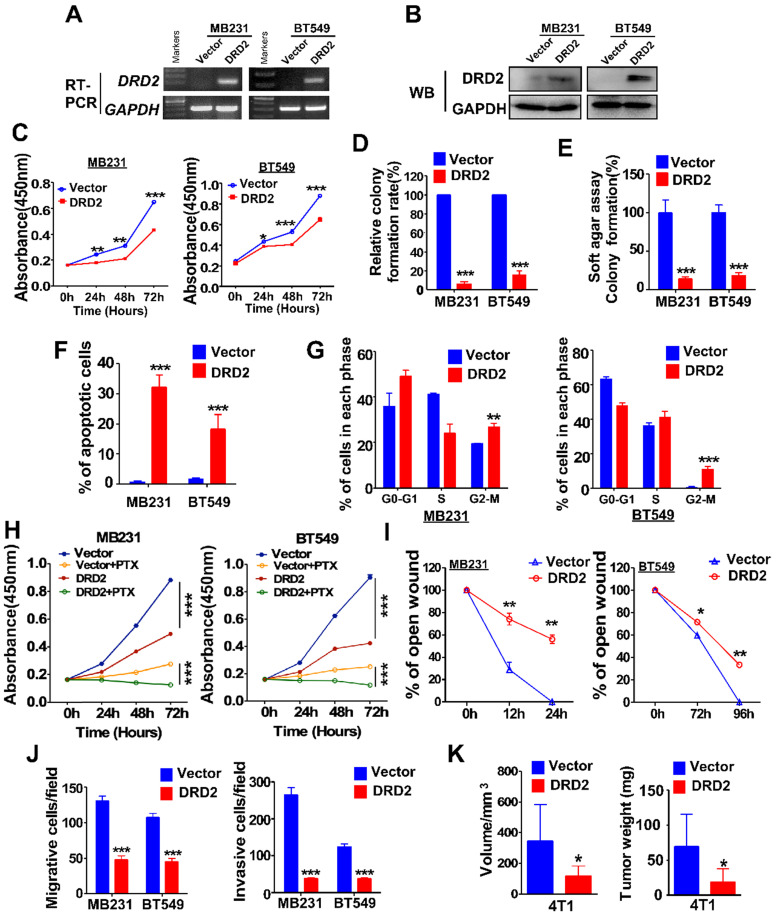
构建稳定过表达DRD2的MDA-MB231和BT549细胞并通过RT-PCR和WB验证。DRD2的过表达抑制了肿瘤细胞的生长,如CCK8 测定所证明的。并且DRD2也损害了生存能力,如克隆形成试验所示和软琼脂形成试验。DRD2表达显着促进BrCa细胞凋亡并在G2/M阶段阻断MDA-MB231和BT549。此外,DRD2的过表达促进了BrCa细胞对PTX的敏感性。在划痕试验中,DRD2 的异位表达表现出比对照组更小迁移能力。DRD2的过表达显着降低了BrCa迁移和侵袭。在体内进一步确定了DRD2的肿瘤抑制作用。皮下肿瘤模型表明源自 DRD2 过表达模型的肿瘤体积和重量均减少。
EMT在癌细胞的迁移和侵袭中很重要。在DRD2过表达后,MDA-MB231 和 BT549 的形态变为上皮样类型。WB结果表明 E-钙粘蛋白的表达增加,波形蛋白以及另一种前 EMT 转录因子 ZEB1 的表达降低。IF染色还表明DRD2的异位表达诱导MDA-MB231失去间充质标志物波形蛋白并获得上皮标志物E-钙粘蛋白。总之,DRD2 能够在体外和体内抑制肿瘤发生,并且 DRD2 还抑制 BrCa 细胞的 EMT。
DRD2 转染的 BrCa 促进巨噬细胞M1 表型
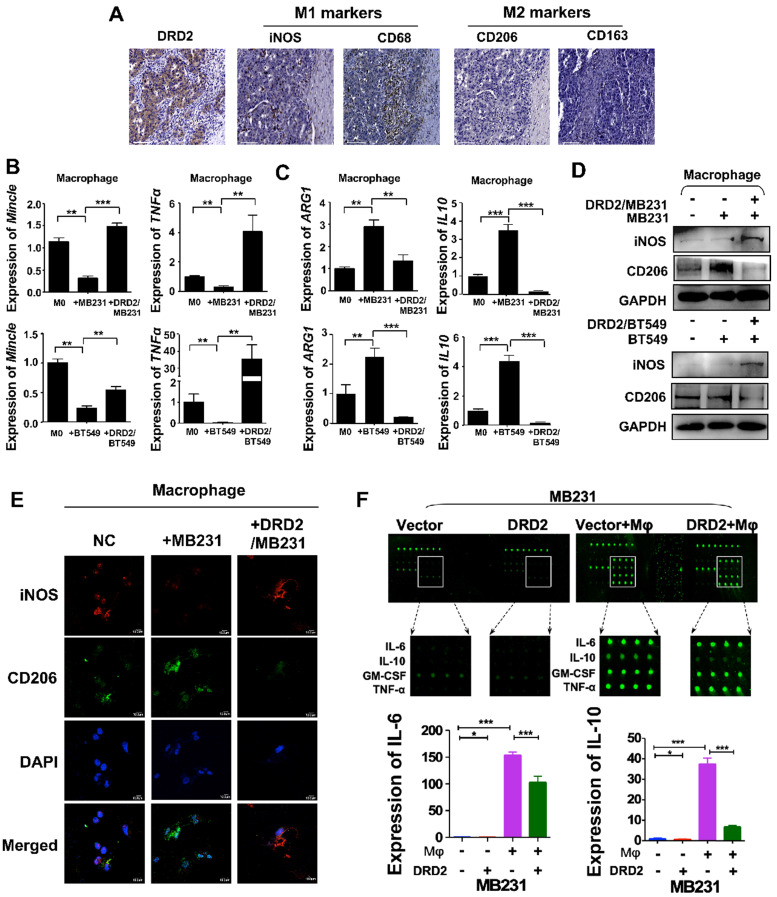
据报道,DRD2以前调节巨噬细胞M的极化。在这项研究中,来自BrCa患者的IHC结果表明,在具有较高 DRD2 表达的 BrCa 组织中,M1巨噬细胞的浸润增加,M2巨噬细胞的滤过减少。为了进一步研究DRD2在调节TAM中的功能,构建了BrCa和巨噬细胞的共培养系统。当巨噬细胞与表达 DRD2的BrCa 细胞共培养时,如qRT-PCR所示,M1 表型的标志物增加,而M2巨噬细胞 标志物下调。qRT-PCR 还证实载体转染的BrCa细胞将巨噬细胞调节为M2型。WB结果确定M1标志物iNOS被过表达DRD2的BrCa细胞上调,而M2标志物CD206 被下调。IF染色显示巨噬细胞在与表达DRD2的肿瘤细胞共培养后表现出M1表型。上述结果表明BrCa中的DRD2具有将巨噬细胞重编程为M1表型的能力。
为了探索将巨噬细胞极化为M1表型的关键调节因子,进行了细胞因子阵列分析。结果表明,诱导M1极化的两种经典细胞因子TNFα和IFN γ没有增加。然而,与巨噬细胞共培养后,DRD2 显着下调IL-6和IL-10。进一步证实IL-6和IL-10的下调。因此,DRD2可以将巨噬细胞重新编程 M1表型,并在串扰期间显着下调IL-6和IL-10。
DRD2 重编程的巨噬细胞诱导肿瘤细胞的焦亡
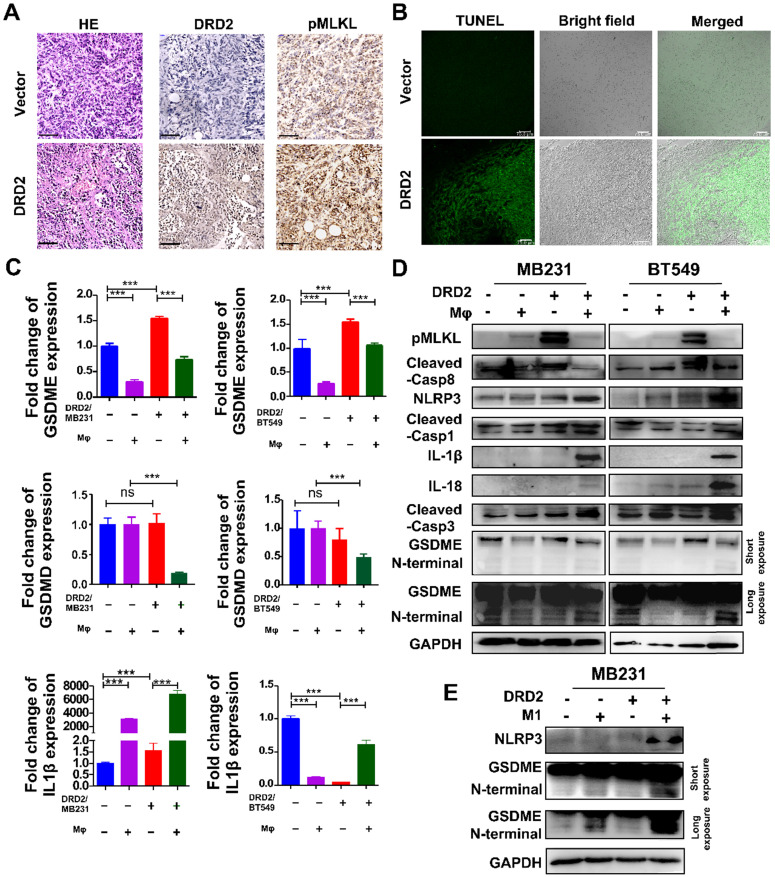
来自小鼠模型的携带 DRD2 的肿瘤表现出增加的肿瘤细胞死亡,如 HE 所示。在IHC染色中,表达 DRD2 的肿瘤样本显示更高的 pMLKL 表达。根据 TUNEL 测定,DRD2 还促进了体内细胞凋亡。GSDM而不是GSDMD被DRD2 上调。巨噬细胞在串扰过程中进一步促进了DRD2转染的BrCa细胞GSDME的表达。在表达DRD2的BrCa细胞中,IL-1β 也被巨噬细胞上调。WB 结果所表明,DRD2诱导MLKL的磷酸化,在共培养过程中被巨噬细胞抑制。此外,DRD2 表达激活了caspase-8。假设,DRD2 可能在与巨噬细胞的串扰期间诱导细胞焦亡。当在BrCa细胞中与巨噬细胞共培养时,NLRP3的组装在表达DRD2的BrCa 细胞中被触发。IL-1β和IL-18的成熟也被激活的caspase-1蛋白水解诱导。Cleaved caspase-3在共培养过程中被上调。切割的caspase-3可以切割GSDME的N端。此外,在共培养过程中,发现GSDME的N端在BrCa细胞中被切割并表达DRD2。为了确定细胞焦亡是否由M巨噬细胞触发,使用LPS诱导的M1巨噬细胞培养基,结果表明巨噬细胞仅触发NLRP3组装并切割具有DRD2表达的BrCa细胞中的GSDME。上述结果表明 DRD2 可以诱导程序性细胞死亡 (PCD),包括细胞凋亡和坏死性凋亡,并且这些事件被巨噬细胞转换为细胞焦亡。并且M1巨噬细胞以 DRD2依赖性方式触发 BrCa 细胞的焦亡。
DRD2 通过中断 TAK1 的磷酸化来限制 NF-κB 信号激活
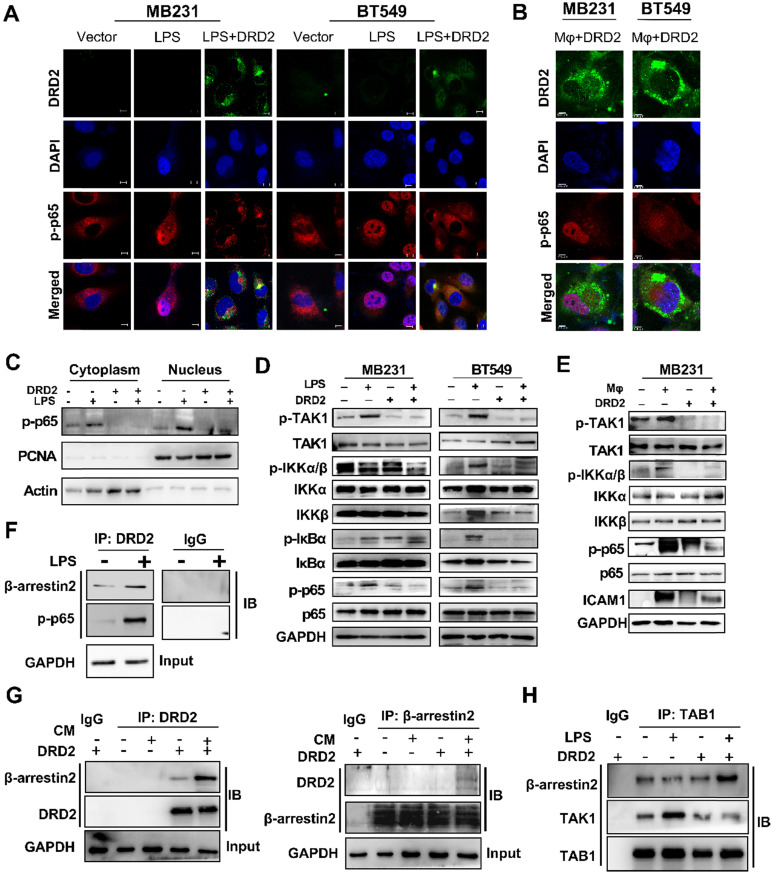
NF-κB信号的激活对于触发炎性体组装和随后的细胞焦亡至关重要。探索DRD2对NF-κB活化的影响。IF染色表明DRD2几乎阻断p-p65的核转位,但是这种抑制被巨噬细胞抵消了。细胞核和细胞质的提取物也表明DRD2抑制p-p65的核易位。如WB结果所示,DRD2通过LPS刺激抑制了IKKα/β、IκBα和p65的磷酸化。异位DRD2表达也显着抑制了巨噬细胞诱导的p65磷酸化和 IKKα/β的上游激活。WB结果显示 DRD2下调 ICAM-1,NF-κB 的下游靶标。然而,这种下调被巨噬细胞抵消。IKKα/β磷酸化的抑制表明DRD2负介导IKK 复合物的上游。TAK1在催化IKKα和IKKβ中起着关键作用。TAK1的磷酸化被异位DRD2表达显着抑制。一般而言,DRD2 通过中断其上游激酶 TAK1 来抑制NF-κB信号激活。
作为典型的G蛋白偶联受体,DRD2的内在化诱导质膜招募其适配器β-arrestin2的的并且增加了其亲和力结合β-arrestin2的。LPS和CM刺激了DRD2和β-arrestin2的蛋白-蛋白结合。IF染色DRD2似乎与LPS处理的细胞质中的p-p65结合,并且结合被Co-IP和IB进一步证实。本研究还证实内化的DRD2可以促进TAB1与β-arrestin2的结合,并削弱TAB1与TAK1的结合最重要的是,DRD2 激活的 β-arrestin2 通过与TAB1 竞争性结合来拮抗TAK1的磷酸化。
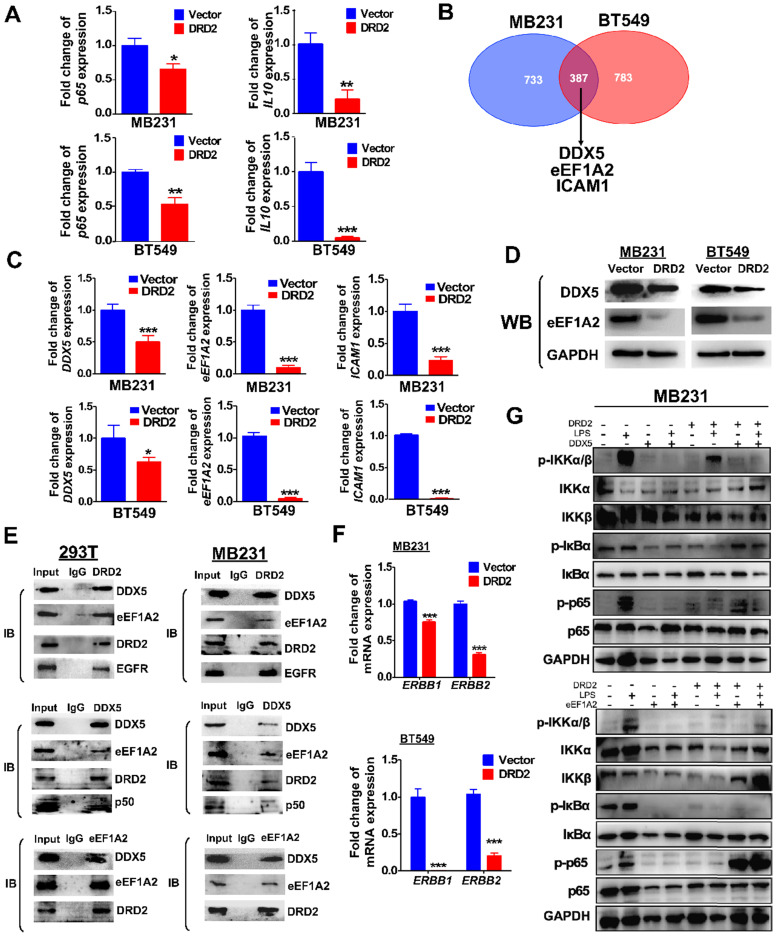
DRD2通过下调DDX5和eEF1A2抑制NF-κB通路激活和肿瘤发生
异位 DRD2表达显着抑制p65和 NF-κB 靶基因IL-10的mRNA表达,表明在没有配体激活的情况下,DRD2是NF-κB通路的负调节因子。除了结合激活 β-arrestin2,DRD2 还可能以其他方式抑制 NF-κB 信号。为了研究机制,通过 Co-IP 结合MS分析来鉴定结合蛋白质。在MDA-MB231和BT549细胞的所有结合蛋白中,DDX5、eEF1A2和ICAM-1都被证实被异位DRD2表达下调。DDX5和EEF1A2有几种癌症型号的癌基因。WB也证实了DDX5和eEF1A2 的下调蛋白水平。在293T和MDA-MB231中,通过 Co-IP 和 IB 测定证实了DRD2、DDX5和eEF1A2 的结合,表明这三种蛋白质形成了复合物。还揭示了293T和 MDA-MB231中 DDX5和p50之间的结合。此外,据报道,DRD2 与神经系统中的 EGFR 结合。在BrCa细胞中,DRD2和EGFR的结合也在293T和MDA-MB231中得到证实。并且DRD2表达下调ERBB1(EGFR)和ERBB2(HER2)表达,它们也是 NF-κB 的靶基因。而在DRD2过表达的BrCa细胞中,发现 DDX5促进 IκBα和p65的磷酸化。eEF1A2被证明可以直接强烈增加p-p65而不影响IKKα/β或IκBα,并且 eEF1A2在表达 DRD2 的 MDA-MB231 中甚至在没有 LPS 的情况下上调p-p65 的蛋白质水平。上述结果表明,DRD2过表达抑制了 DDX5 和 eEF1A2 对促进 NF-κB 信号激活影响显着。上述结果进一步证实 DRD2 抑制 NF-κB 信号激活并通过下调 BrCa 细胞中的 DDX5 和 eEF1A2 发挥肿瘤抑制作用。