肿瘤治疗新技术——miR-101-3p纳米药物促进肿瘤铁死亡
miR-101-3p可用于治疗多种肿瘤的治疗,但是它的抗肿瘤机制仍然未知,并且其用于体内肿瘤治疗的确切策略也尚不可知。本研究探究了miR-101-3p对肿瘤细胞的抑制机制,并开发了相应的体内治疗纳米药物。本文于2021年6月发表在《Redox Biology》IF:11.799期刊上。
技术路线:

主要的实验结果:
1、miR-101-3p的表达在肿瘤细胞系和肿瘤组织中下降
作者检测了6株肺癌细胞系A549,L78,NCI–H460,GLC-82,SPC-A1,PC9和一株人上皮细胞系BEAS-2B中miR-101-3p的表达,结果显示与BEAS-2B相比,miR-101-3p的表达在肺癌细胞系中显著低表达。随后检测了32个肺癌组织(LC)样本和同源相邻正常组织(ANT)样本中的表达,结果显示与ANT相比,在LC中显著低表达。随后将32例LC样本根据肿瘤大小分为两组,结果发现miR-101-3p在肿瘤体积大的样本中的表达要显著低于肿瘤体积小的。这些结果表明miR-101-3p的表达在肿瘤细胞系和肿瘤组织中下调。
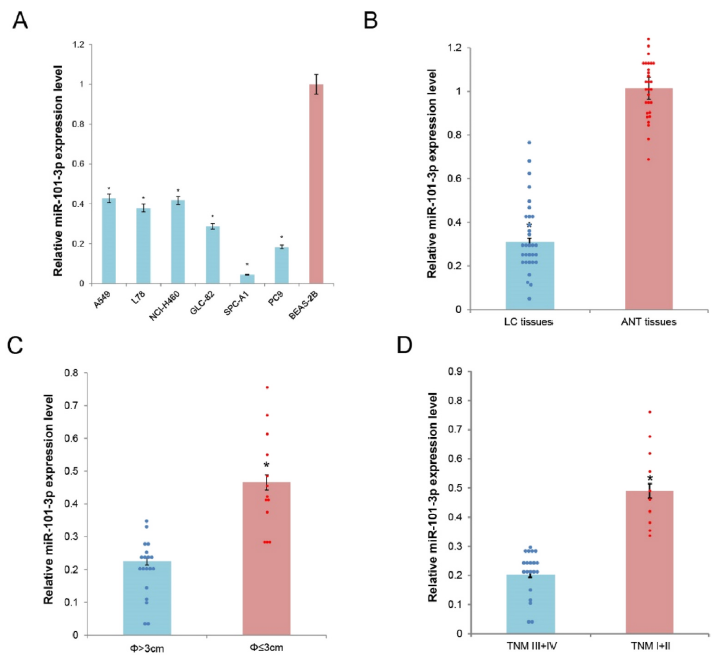
图1 miR-101-3p的表达在肿瘤细胞系和肿瘤组织中降低
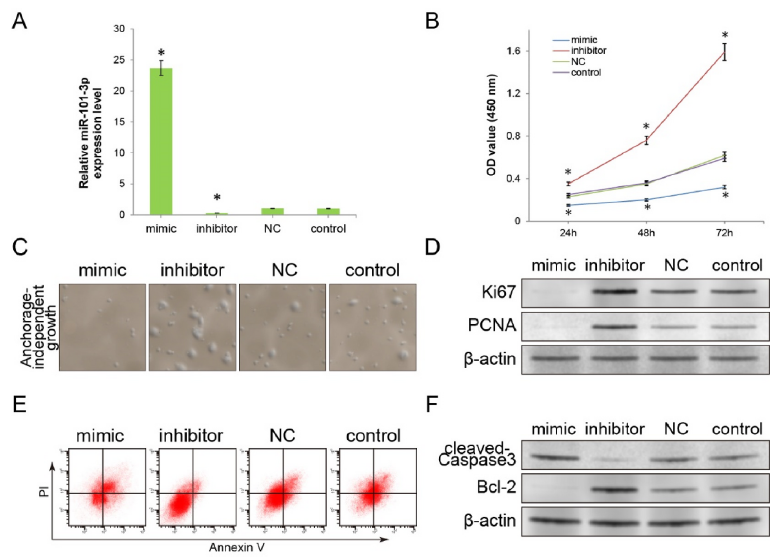
2、促进miR-101-3p的表达抑制肿瘤细胞的生长并增强凋亡
为了进一步探头miR-101-3p对肿瘤细胞生物学功能的影响,构建了miR-101-3p过表达和miR-101-3p表达抑制的细胞系,如图2A所示。随后,CCK8,流式和WB等实验证实,过表达miR-101-3p会抑制细胞的增殖和生长,并抑制Ki67和PCNA的表达,但会增强细胞的凋亡比例,以及增加cleaved-Caspase3的表达减少Bcl-2的表达。相反地,抑制miR-101-3p的表达会促进肿瘤细胞的增殖并减少细胞凋亡。以上结果表明miR-101-3p在肿瘤增殖和凋亡中发挥了重要作用。
3、miR-101-3p抑制肿瘤细胞通过靶向TBLR1
生物信息学预测分析显示miR-101-3p在TBLR1的3’UTR区域存在3个结合位点(图3A)。作者此前的研究结果表明TBLR1是一个肝癌和宫颈癌的原癌基因,也有证据显示其也是肺癌中的原癌基因。因此,探讨了miR-101-3p和TBLR1的表达相关性,结果显示在32例LC样本中它们的表达负相关。荧光素酶实验结果显示miR-101-3p mimics和TBLR1野生型共转染时荧光素酶活性显著下降,而和TBLR1突变型共转染时没有显著改变,表明miR-101-3p和TBLR1之间存在结合关系。进一步地,WB结果显示,过表达miR-101-3p后TBLR1的表达显著下降,抑制miR-101-3p的表达则促进TBLR1的表达。这些结果表明,miR-101-3p可能通过结合TBLR1的3'UTR区域直接控制TBLR1的表达水平。
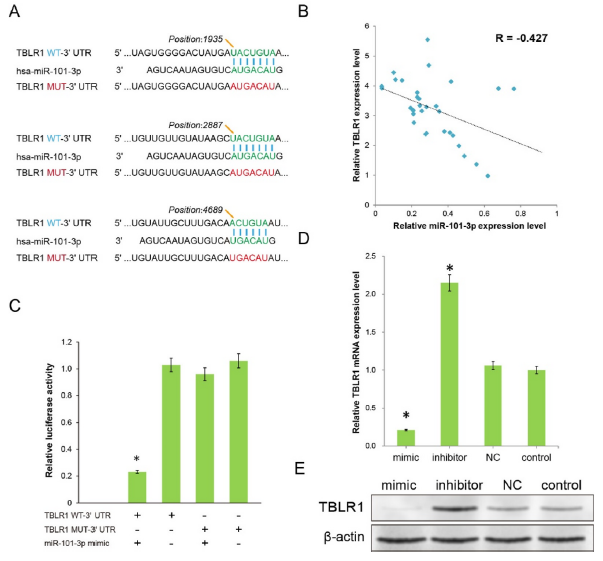
图3 初步探索miR-101-3p产生治疗作用的靶点
为了进一步探究miR-101-3p作用于肿瘤细胞生长和凋亡的作用是否是通过调节TBLR1的表达,作者进行了回复实验。如图4所示,单独转染TBRL1过表达载体,会显著上调TBLR1的蛋白表达,减少肿瘤细胞凋亡,促进肿瘤细胞的增殖和Bcl-2的表达,而同时供转染TBRL1过表达载体和miR-101-3p mimics则会显著抵消上述作用。表明miR-101-3p作用于肿瘤细胞生长和凋亡的作用是通过调节TBLR1的表达。
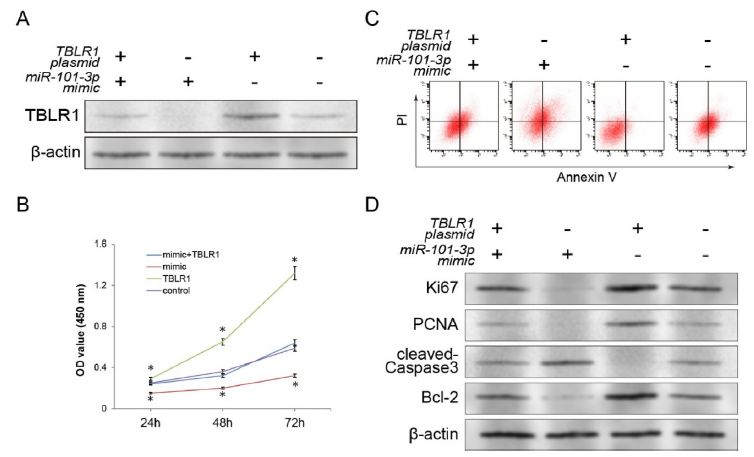
图4 miR-101-3p靶点产生治疗作用的体外功能验证
4、miR-101-3p/TBLR1轴调节铁死亡并可作为肿瘤治疗的潜在靶点
通常,癌细胞的突变会显著阻碍细胞凋亡的激活。因此,探索了miR-101-3p /TBLR1轴激活凋亡进而抑制增殖的分子机制。作者此前的研究表明TBLR1会显著抑制NF-kB通路的活性。据报道,NF-kB通路可以通过GPX4或PTGS2调节肿瘤细胞的铁死亡。因此,作者探究了miR-101-3p/TBLR1轴对铁死亡的影响。共聚焦显微镜显示miR-101-3p过表达后细胞中总体ROS水平显著增加,GPX4的表达显著下降,PTGS2的表达显著增高,脂质ROS水平也显著增加,而GSH水平则显著下降。而抑制miR-101-3p则上述结果相反。因此,这些结果表明miR-101-3p可调节肿瘤细胞铁死亡。
此外,miR-101-3p mimics和TBLR1过表达载体共转染会显著反转上述miR-101-3p mimics单独处理带来的改变,表明miR-101-3p/TBLR1轴可以共同调节肿瘤细胞铁死亡进而贡献肿瘤进展。
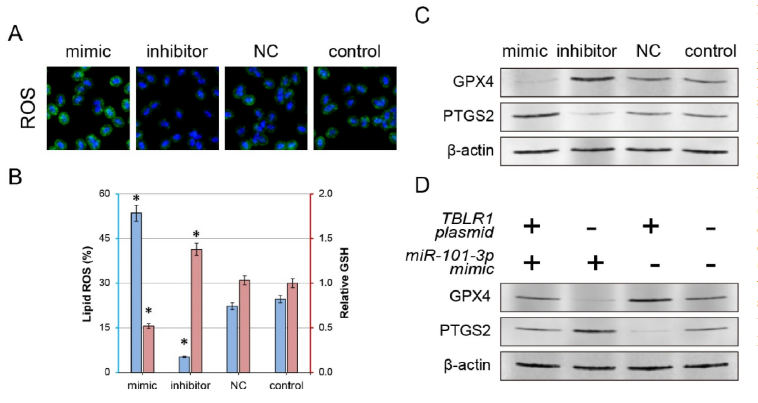
图5 miR-101-3p/TBLR1轴是因铁死亡调节而产生的抗肿瘤作用
纳米基因载体可以形成纳米级药物携带治疗性的核酸,其可保证治疗性核酸在体内治疗时的稳定性,进而通过增强通透性和滞留效应实现肿瘤组织分布。作者尝试构建纳米基因传递和miR-101-3p的基因治疗用于体内肿瘤治疗。作者用红色荧光POPO3标记miR-101-3p,如图6A所示,纳米载体组红色荧光显著增强,而单独荧光质粒组则很难部分至细胞中。使用NIFR,CY7染色纳米载体后,将其通过尾静脉注射至小鼠体内,观察到纳米载体在肿瘤区域的显著聚集分布(图6B)。随后收集这些肿瘤组织进行病理观察,如图6C所示,与对照组相比,纳米载体组的肿瘤细胞中观察到显著的荧光聚集。该体外实验结果直接证明了体内荧光染色观察到的纳米载体在肿瘤区域的聚集。总之,上述研究表明,纳米载体可以有效地将质粒携带到肿瘤区域,从而促进肿瘤细胞的体内转染。
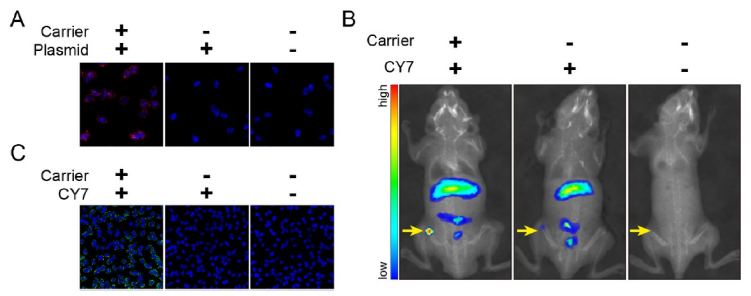
图6分子成像追踪技术研究纳米载体靶向肿瘤铁死亡进行体内治疗的可能性
6、miR-101-3p的纳米载体抑制肿瘤生长
基于上述研究事实,作者专注于利用这种纳米载体来携带miR-101-3p mimics,并在体内肿瘤治疗实验中探究其治疗效果。将肿瘤细胞皮下注射到裸鼠体内,处理4周,然后用含有miR-101-3p mimic、miR- 101-3p inhibitor或NC的纳米载体通过尾静脉注射给裸鼠治疗。如图7A和7B所示,装载miR-101-3p mimic的纳米载体显著抑制了肿瘤的生长和体积,而装载miR-101-3p inhibitor的纳米载体则显著促进了肿瘤的生长和体积。此外,miR-101-3p的表达支持了上述结果,在miR-101-3p mimic的纳米载体组上调,在miR-101-3p inhibitor的纳米载体组下调(图7C)。
此外,还通过染色实验检测了各组小鼠肿瘤细胞的增殖,凋亡,细胞总ROS水平,使用WB检测了增殖,凋亡和铁死亡相关蛋白的表达。如图7D-7F所示,这些结果和体外实验结果一致,miR-101-3p mimic的纳米载体会抑制肿瘤生长指标,促进铁死亡指标。
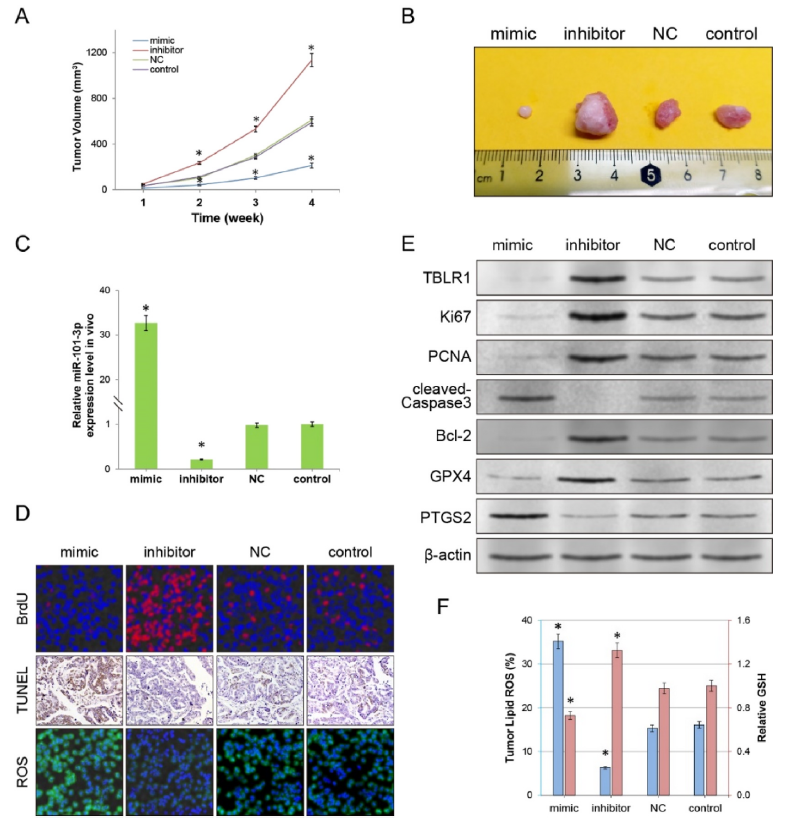
图7 miR-101-3p的有效基因传递通过促进铁死亡在体内对肿瘤产生治疗作用
总之,miR-101-3p通过促进肿瘤细胞铁死亡抑制肿瘤生长,本研究设计的纳米基因载体策略可以恢复肿瘤中miR-101-3p的表达,这可能是一种潜在的治疗多种肿瘤的有效技术。
参考文献:
Luo Yifeng., Niu Gang., Yi Hui., Li Qingling., Wu Zhiqiang., Wang Jing., Yang Juan., Li Bo., Peng Yuan., Liang Ying., Wang Weiwei., Peng Zhenwei., Shuai Xintao., Guo Yu.(2021). Nanomedicine promotes ferroptosis to inhibit tumour proliferation in vivo. Redox Biol, 42(undefined), 101908. doi:10.1016/j.redox.2021.101908






