环状RNA circRNF13通过SUMO2抑制鼻咽癌的增殖和转移

鼻咽癌(鼻咽癌)是鼻咽部上皮性起源的恶性肿瘤,在中国南方和东南亚的发病率高达千分之二。然而,迄今为止,涉及鼻咽癌的发展,特别是转移过程的分子机制仍不清楚。因此,需要进一步了解鼻咽癌的发病机制,以制定更有效的治疗策略。环状RNA (Circular RNAs, circRNAs)在人类细胞中广泛表达,与癌症的发展密切相关。越来越多的研究发现,circRNA在许多生命过程中具有重要作用,参与包括恶性肿瘤在内的许多人类疾病的发生。虽然已经鉴定出了许多环状RNA,但绝大多数环状RNA的功能仍不清楚,尤其是在NPC中。因此有作者报道相关内容,2021年发表在《Molecular Cancer》,IF:27.401。
技术路线:

主要研究结果:
1. CircRNF13在鼻咽癌临床组织中低表达
为了获得环状RNA在NPC中的表达谱,作者对NPC细胞系5-8F(accession number: PRJNA391554)的下一代mRNA测序(RNAseq)数据进行了重新分析。在这些环状RNA中,根据环状区域的不同,分为五种类型:外显子衍生环状RNA、内含子衍生环状RNA、反义链环状RNA、义链环状RNA重叠区和基因间环状RNA(图1A)。其中一种新的潜在环状RNA, circRNF13,在NPC组织中高丰度表达,但circRNF13在NPE组织中的表达高于NPC组织(图1B)。基于circRNF13剪接位点,作者认为circRNF13是由RNF13基因(NM_183381.2)的外显子2-8环状剪接形成的染色体 3q25.1,全长716 bp(图1C)。核质分离检测和RNA荧光原位杂交检测显示,circRNF13分布于细胞核和细胞质中,且更局限于细胞核。而RNase R(图1D-E)处理显示circRNF13在NPC细胞中比RNF13 mRNA更稳定(图1F)。这些数据提示,circRNF13可能影响鼻咽癌的发育。

图1 CircRNF13在鼻咽癌中低表达
为了探索circRNF13在NPC中的功能,构建了circRNF13过表达载体,并基于circRNF13的剪接位点设计了circRNF13-siRNA。MTT和菌落形成实验表明,过表达circRNF13抑制鼻咽癌细胞增殖,敲低circRNF13促进鼻咽癌细胞增殖(图2A, B)。流式细胞术结果也显示,过表达circRNF13的细胞在G1期停滞,而抑制circRNF13的细胞数量在G2/M期增加(图2C)。创面愈合实验结果显示,当circRNF13表达高时,鼻咽癌细胞的迁移能力显著降低,而当circRNF13表达低时,鼻咽癌细胞的迁移能力显著降低(图2D)。Transwell实验表明,过表达circRNF13抑制鼻咽癌细胞的侵袭,而下调circRNF13则促进了侵袭(图2E)。基于这些观察,得出circRNF13抑制鼻咽癌细胞增殖、迁移和侵袭的结论。
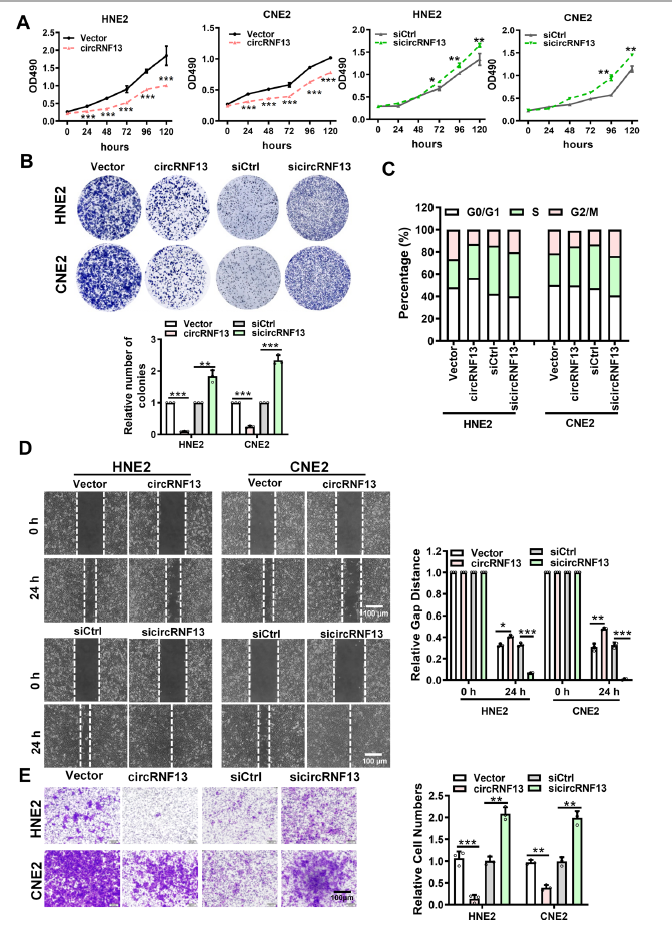
图2 CircRNF13抑制NPC的增殖、迁移和侵袭
3. CircRNF13在体内抑制鼻咽癌生长和转移
接下来,作者研究了circRNF13在体内对鼻咽癌细胞增殖和转移的影响。皮下成瘤实验结果显示,过表达circRNF13的裸鼠皮下肿瘤较小,而circRNF13敲低组皮下肿瘤较大(图3A-C)。石蜡包埋、切片和免疫组化染色显示,circRNF13过表达组Ki-67表达明显低于circRNF13敲低组(图3D)。尾静脉肺转移检测结果显示,circRNF13过表达组中肺结节数量明显低于对照组,而circRNF13敲低组肺结节数量增加(图3E-F)。肺结节的H&E染色也显示,circRNF13过表达组鼻咽癌肺转移的数量明显低于circRNF13敲低组(图3G)。综上所述,circRNF13在体外和体内均有抑制鼻咽癌增殖和转移的作用。
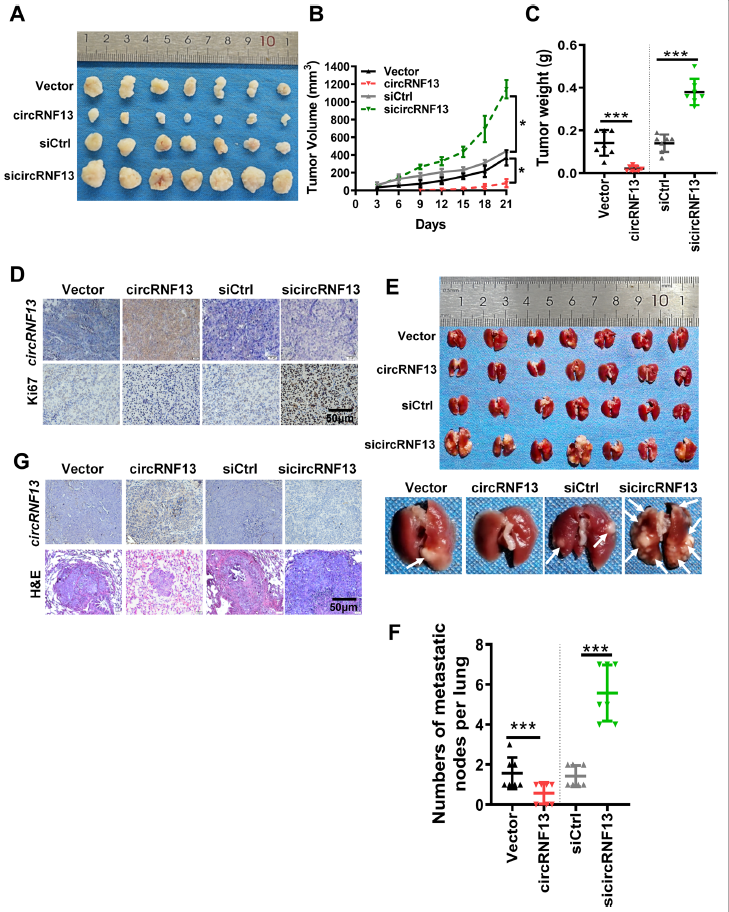
图3 CircRNF13在体内抑制鼻咽癌生长和转移
4. CircRNF13可能通过抑制糖酵解来抑制鼻咽癌的迁移和侵袭
为了研究circRNF13对鼻中癌增殖和转移的分子机制,作者采用液相色谱-串联质谱(LC MS/MS)对转染sicircRNF13或扰乱siRNA的CNE2细胞进行了检测。结果发现过表达circRNF13抑制了鼻咽癌细胞中的葡萄糖摄取和乳酸生成(图4A)。海马实验显示,过表达circRNF13导致CNE2和HNE2细胞的糖酵解能力显著下降,而下调circRNF13则显著增加糖酵解能力(图4B)。Western blotting结果显示,在鼻咽癌细胞中过表达circRNF13显著上调磷酸化AMPKα,下调mTOR,进一步下调mTOR下游靶点pS6K和4EBP1的表达。另一方面,敲低circRNF13则会产生相反的效果(图4C)。用糖酵解抑制剂2-DG阻断糖酵解途径。当添加糖酵解抑制剂2-DG时,抑制circRNF13并没有下调磷酸化AMPKα(图4D)。这一数据表明,敲低circRNF13可促进鼻鼻癌细胞的迁移和侵袭,添加2-DG后这种作用减弱(图4E-F)。这些结果提示circRNF13可能通过抑制糖酵解来抑制鼻咽癌的迁移和侵袭。
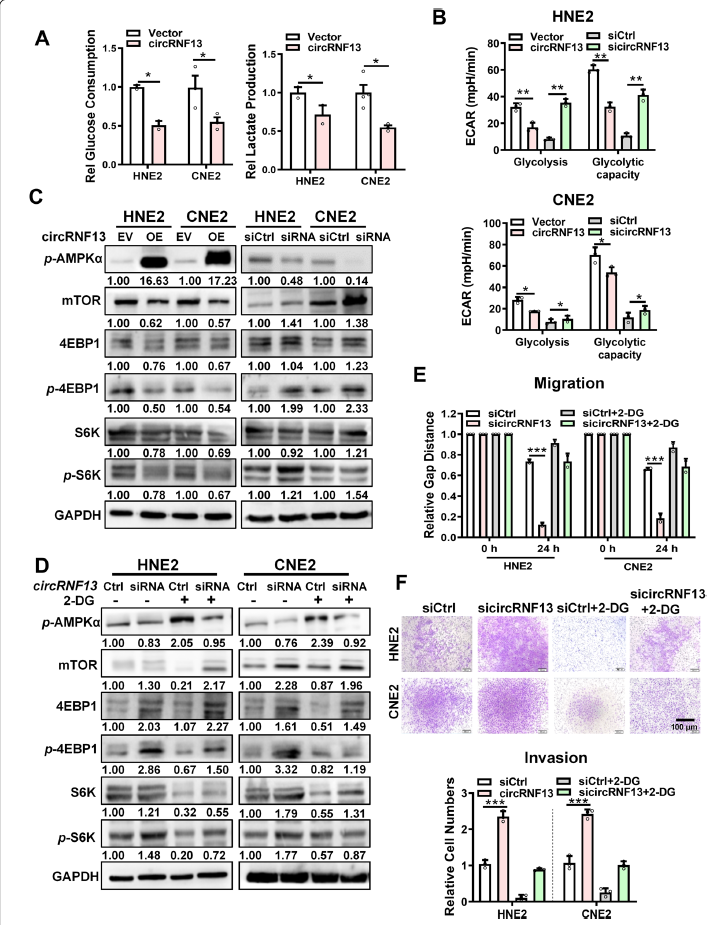
图4 CircRNF13抑制鼻咽癌细胞的糖酵解
5.CircRNF13通过促进鼻咽癌细胞糖酵解GLUT1泛素化
为了研究circRNF13调控鼻咽癌细胞糖酵解过程的分子机制,作者采用RT-PCR和western blotting在HNE2和CNE2细胞中检测糖酵解途径的主要分子GLUT1、LDHA和HK2。数据显示,在circRNF13过表达时GLUT1蛋白水平显著降低,而在circRNF13敲低时GLUT1蛋白水平显著升高,而mRNA表达水平没有显著改变。CircRNF13在mRNA和蛋白水平上对LDHA和HK2的表达均有较弱的影响(图5A, B)。这些数据表明,circRNF13可能主要通过调节GLUT1来调节糖酵解。Western blotting显示,在circRNF13过表达时,GLUT1的稳定性降低,而在circRNF13敲低时,GLUT1的稳定性增加(图5C)。通过抗泛素抗体证实,过表达circRNF13促进GLUT1泛素化,而敲低circRNF13则降低GLUT1的蛋白泛素化水平(图5D)。这些结果表明,circRNF13可能通过调节泛素介导的GLUT1降解来抑制鼻咽癌细胞的糖酵解。
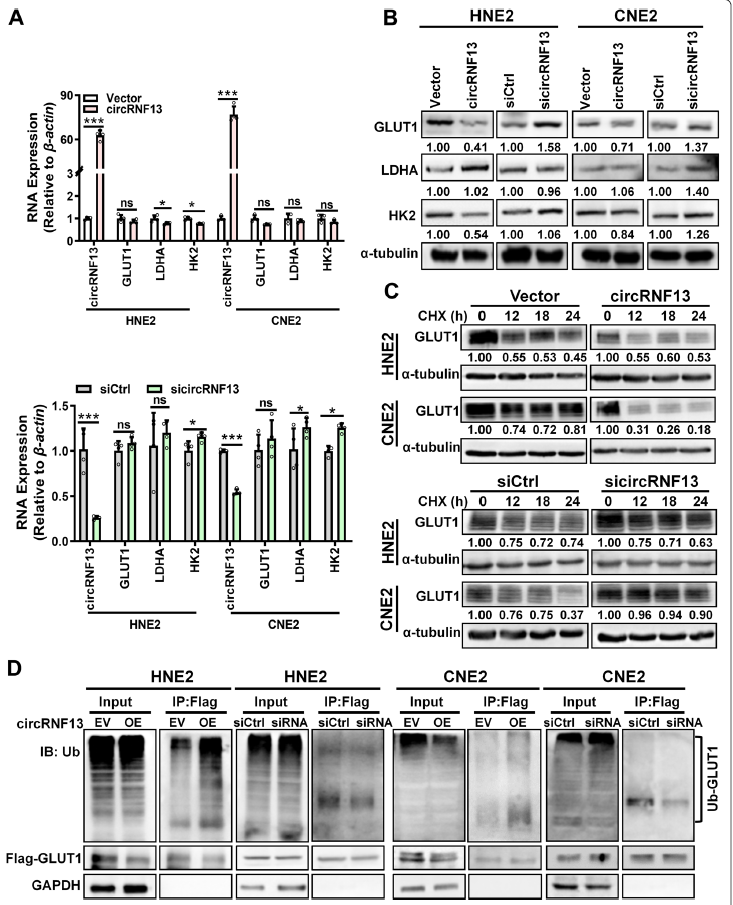
图5 CircRNF13通过促进GLUT1泛素化抑制鼻咽癌细胞的糖酵解
6. CircRNF13通过直接结合SUMO2 mRNA的3’UTR来促进SUMO2的稳定性
为了确定circRNF13是否与SUMO2相互作用调节增殖、迁移和侵袭,作者进行了western blotting和RT-PCR,结果显示,circRNF13过表达显著诱导了SUMO2在RNA和蛋白水平上的表达。通过敲除circRNF13得到了相反的结果(图6A, B)。生物信息学分析显示,在circRNF13和SUMO2的3 -UTR之间存在一个连续的结合基元(图6C)。RNA pull-down、双荧光素酶实验以及放线菌素D (2 μg/mL)检测证明circRNF13通过与SUMO2的3 ’-UTR结合调控其表达。

图6 CircRNF13直接结合并稳定SUMO2 mRNA,上调其表达
7. CircRNF13通过SUMO2促进GLUT1的泛素化
作者通过Co-IP实验揭示了GLUT1和UBC9之间的相互作用(图7A,B)。免疫荧光显示了SUMO2和GLUT1蛋白的共同定位(图7C)。为了了解SUMO2在鼻咽癌中的分子基础,在HNE2和CNE2细胞中检测了GLUT1在过表达或敲低circRNF13时的SUMOylation。Western blotting显示,过表达circRNF13促进GLUT1的SUMOylation,敲低circRNF13抑制GLUT1的SUMOylation(图7D)。为了确定SUMO2是否参与了circRNF13调控的GLUT1的泛素化,紧接着在鼻咽癌细胞中过表达了SUMO2。泛素化实验表明,过表达SUMO2可加速GLUT1的泛素化(图7E)。在sicircRNF13和SUMO2过表达载体共转染的HNE2和CNE2细胞中,敲低circRNF13可减弱SUMO2诱导的GLUT1泛素化水平(图7F)。这些数据表明,circRNF13通过与SUMO2结合调控GLUT1泛素化。

图7 CircRNF13通过SUMO2促进GLUT1的泛素化
8. CircRNF13通过SUMO2抑制鼻咽癌细胞的增殖、迁移和侵袭
MTT法检测circRNF13是否通过SUMO2抑制鼻咽癌细胞增殖、迁移和侵袭,结果显示,过表达SUMO2挽救了circRNF13敲低介导的鼻咽癌细胞增殖能力的改变(图8A)。伤口愈合和Transwell实验显示,SUMO2挽救了circRNF13敲低介导的鼻咽癌细胞迁移和侵袭能力的改变(图8B, C)。海马实验也显示,过表达SUMO2挽救了由circRNF13敲低引起的鼻咽癌细胞糖解应激的改变(图8D)。小鼠组织中也进行了SUMO2和GLUT1的免疫组化,结果显示,在circRNF13过表达组的裸鼠皮下肿瘤切片中,SUMO2低表达,而GLUT1高表达(图8E)。circRNF13 作为肿瘤抑制因子,直接与 SUMO2 的 3’-UTR 结合并延长 SUMO2 mRNA 的半衰期。 SUMO2 的上调通过 GLUT1 的 SUMOylation 和泛素化促进 GLUT1 降解,其通过抑制糖酵解来调节 AMPK-mTOR 通路,最终导致 NPC 的增殖和转移(图 8F)。
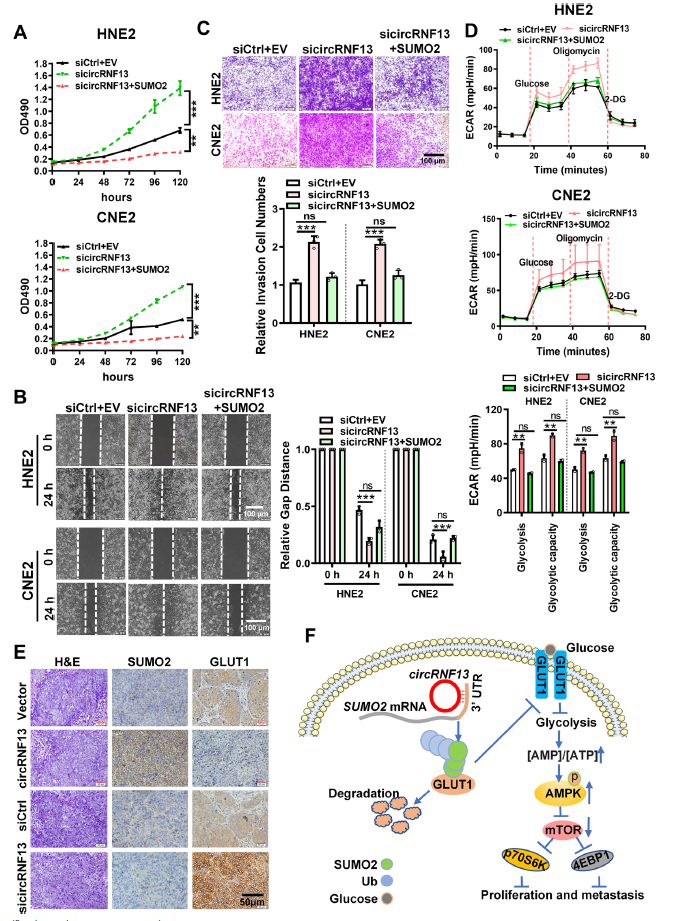
图8 CircRNF13通过SUMO2抑制鼻咽癌的增殖和转移
结论:
新型 circRNF13 通过 circRNF13-SUMO2-GLUT1 轴在 NPC 的发育中发挥重要作用。 该研究表明circRNF13通过与SUMO2结合介导NPC糖酵解,为进一步阐明NPC的发病机制和靶向治疗提供了重要的理论基础。






