LINC00941通过调节Hippo途径促进胰腺癌糖酵解
胰腺导管腺癌(PDAC)是最致命的癌症之一。缺乏有效的治疗和PDAC发病率的增加促使人们对PDAC进展有更深入的了解。2021年7月发表于Molecular Therapy: Nucleic Acids(IF=8.886)的文章“LINC00941 promotes glycolysis in pancreatic cancer by modulating the Hippo pathway”报道了LINC00941通过调节Hippo途径促进胰腺癌糖酵解。通过分析lncRNA数据集,我们发现LINC00941表达增加导致PDAC患者预后不良。此外,体外和体内实验表明LINC00941通过促进有氧糖酵解促进PDAC癌细胞生长。在机理上,LINC00941被发现与MST1相互作用,促进PP2A介导的MST1去磷酸化,导致Hippo途径激活,从而增强PDAC的糖酵解。这些结果表明LINC00941在PDAC肿瘤发生中发挥了关键作用,可能是PDAC治疗的新途径。
技术路线

结果
1)PDAC中LINC00941表达增加与疾病进展和预后不良呈正相关
我们比较了lncRNA在胰腺癌和配对的相邻非肿瘤胰腺组织样本中的表达,发现与非转化胰腺组织相比,有34个lncRNAs显著上调,32个lncRNAs在胰腺癌组织中表达下调(图1A)。接下来,我们分析了前两个上调的lncRNAs-LINC00941和LINC01234与TCGA数据集的临床结果的相关性。Kaplan-Meier分析结果显示,LINC01234对胰腺癌患者的总生存期无预测价值,而LINC00941与胰腺癌患者的不良预后显著相关(图1B)。与GEO的数据集一致,我们发现LINC00941在PDAC TCGA数据集中与正常胰腺GTEx数据集相比高表达(图1C和1D)。为了验证芯片数据,我们采用real-time PCR检测了10例配对胰腺癌及癌旁组织中LINC00941的表达。我们发现LINC00941在PDAC组织中表达显著增加(图1E)。此外,我们通过原位杂交(ISH)验证了LINC00941在石蜡包埋的胰腺癌和癌旁组织中的表达。结果显示,LINC00941主要定位于PDAC细胞质,且LINC00941在胰腺癌组织中的表达高于癌旁组织(图1F)。接下来,我们评估TCGA数据集中LINC00941表达与不同临床病理特征的相关性。我们发现LINC00941的表达与肿瘤大小和肿瘤分期呈正相关(图1G)。与TCGA队列研究结果一致,在PDAC患者中,LINC00941高水平表达与缩短生存时间显著相关。

2)LINC00941体外抑制PDAC癌细胞生长
为了揭示LINC00941在胰腺癌进展中的作用,我们在两个高表达LINC00941的PDAC癌细胞系PANC-1和SW1990中沉默LINC00941的表达(图2A)。LINC00941的shRNA显著抑制了LINC00941在PDAC细胞株中的表达(图2B)。细胞活力测定显示LINC00941的缺失极大地抑制了PANC-1和SW1990细胞的增殖(图2C)。相比之下,LINC00941过表达显著促进了两种LINC00941表达相对较低的PDAC癌细胞BxPC-3和CFPAC-1的生长(图2D)。集落形成实验表明,LINC00941的敲除显著抑制了PDAC癌细胞的集落形成能力(图2E)。为了进一步模拟体内生长条件,采用三维生长实验比较LINC00941沉默的PDAC细胞与对照细胞的生长能力。与2D培养一致,LINC00941的缺失显著抑制了PDAC细胞株的球形生长(图2F)。总的来说,这些数据表明,抑制LINC00941会损害PDAC癌细胞的生长。

3)LINC00941耗尽抑制PDAC细胞的糖酵解
我们旨在阐明LINC00941调控PDAC癌细胞生长的机制。我们观察到当在新鲜培养基中培养12小时至相同的浓度时,对照PDAC细胞培养基中的酚红呈现出由红色逐渐变为黄色的颜色转变,而LINC00941-沉默的肿瘤细胞株则没有这种颜色转变(图3A)。这些结果表明LINC00941抑制了细胞外酸性的产生。通过对细胞外pH值的测量证实,来自对照肿瘤细胞的培养基逐渐变得酸性更强,而来自LINC00941沉默的肿瘤细胞株的培养基并没有像来自对照细胞的培养基那样很快变得酸性(图3B)。LINC00941基因的下调显著抑制了PANC-1和SW1990细胞的糖酵解能力(图3C和3D)。因此,我们测量了糖酵解途径中酶的mRNA表达水平。我们发现,沉默LINC00941后,葡萄糖转运体1(GLUT1)、己糖激酶2 (HK2)、PFKFB3和乳酸脱氢酶A (LDHA) mRNA的表达显著降低(图3E和3F)。此外,我们比较了LINC00941 sh阴性对照(shNC)、sh1和sh2 PDAC细胞的葡萄糖摄取和乳酸生成。正如预期的那样,LINC00941基因的下调显著抑制了PDAC癌细胞的葡萄糖摄取和乳酸生成(图3G和3H)。综上所述,这些数据表明LINC00941的缺失抑制了PDAC细胞中的糖酵解。

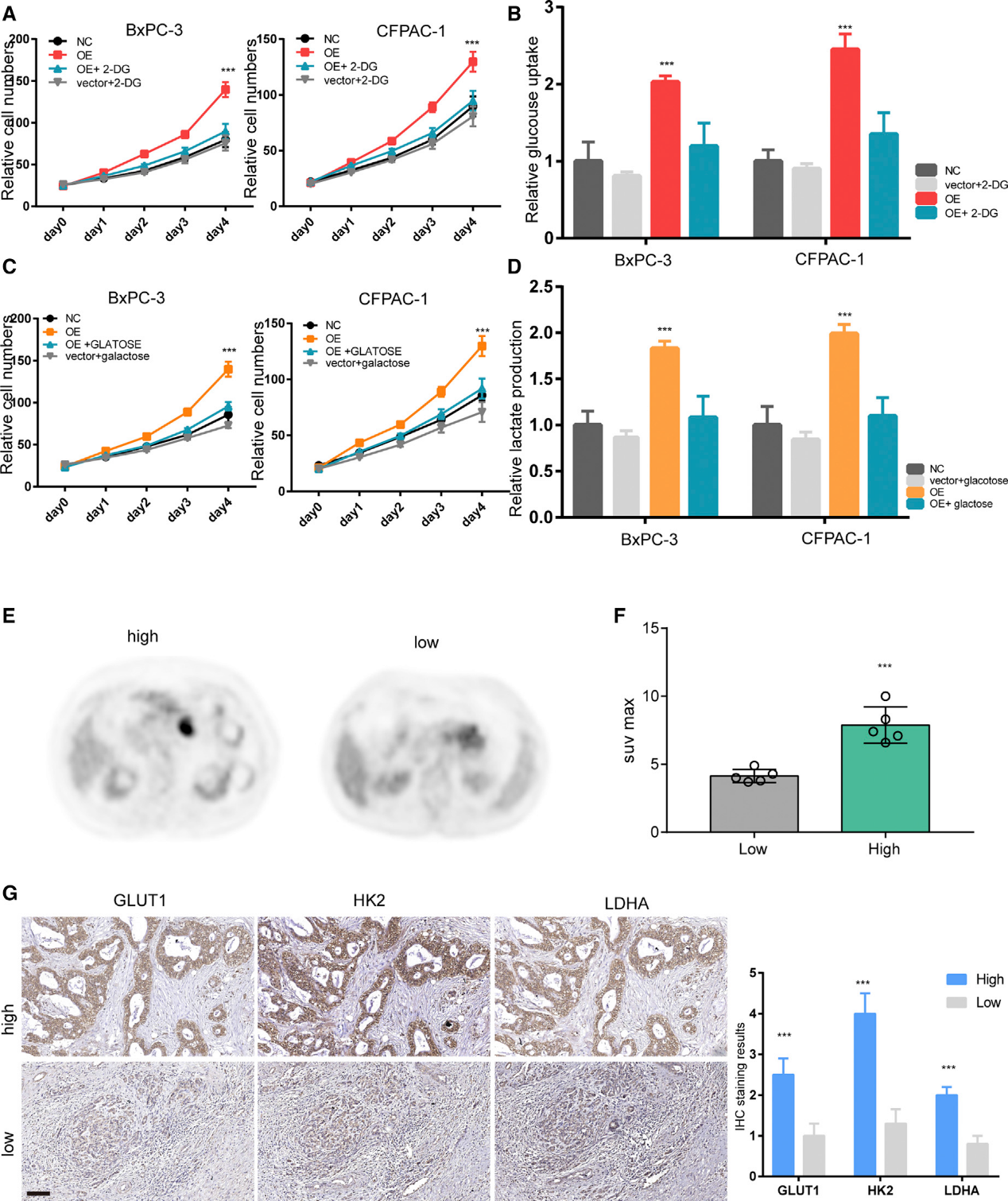
4)糖酵解是LINC00941介导的生长促进所必需的
我们旨在评估增强的糖酵解对于LINC00941介导的PDAC细胞的生长促进作用是否必要。。细胞增殖实验结果显示,2-DG极大地破坏了LINC00941过表达诱导的BxPC-3和CFPAC-1细胞的生长促进作用(图4A和4 B)。为了进一步证实这一点,将培养基中的葡萄糖替换为半乳糖以抑制糖酵解。如预期的那样,在半乳糖替代后乳酸产量显著降低。与此同时,异位表达LINC00941的BxPC-3和CFPAC-1细胞的增殖急剧下降(图4C和4D)。进一步研究发现,LINC00941高表达组比LINC00941低表达组有更高的最大标准化摄取值(SUVmax)值,GLUT1、HK2、PFKFB3、LDHA染色更强(图4E,4G)。总的来说,这些数据表明,糖酵解对于LINC00941介导的生长促进作用是必要的。
5)LINC00941激活Hippo通路,增强PDAC细胞的糖酵解
我们旨在揭示LINC00941增强PDAC细胞糖酵解的信号通路。我们发现转染LINC00941显著提高了PANC-1细胞中TEAD1的转录活性(图5A),提示Hippo途径可能介导了LINC00941对糖酵解的调控。因此,我们检测了Hippo途径下游三个典型基因CTGF、CYR61和ANKRD1的表达。结果显示,LINC00941基因敲除显著降低了这三个靶基因在PANC-1和SW1990 PDAC细胞中的mRNA表达水平(图5B)。为了进一步证实这一点,我们通过免疫荧光染色检测了YAP1在对照和LINC00941沉默的PDAC细胞中的亚细胞位置。我们发现,在LINC00941 sh1和sh2 pan -1细胞中,YAP1核定位的比例远高于对照细胞(图5C和5D)。接下来,用免疫印迹法检测LINC00941沉默的PDAC细胞株中Hippo通路的改变。结果显示,与对照细胞相比,LINC00941敲低细胞中MST1、LATS1和YAP1的磷酸化水平明显上调(图5E)。为了进一步确定LINC00941在PDAC中的致癌作用是否需要YAP1,将两个YAP1突变体引入LINC00941过表达或LINC00941缺失的PDAC细胞中。正如预期的那样,组成型激活的YAP1 (S127A)的异位表达逆转了LINC00941耗尽的PDAC细胞的生长受损(图5F)。同样,Hippo途径的抑制剂verteporfin也会阻碍LINC00941过表达细胞的生长(图5G)。此外,ECAR测量结果显示,YAP1 (S127A)过表达恢复了LINC00941耗尽PDAC细胞中受损的糖酵解,YAP1 (S94A)过表达阻碍了LINC00941过表达介导的糖酵解增强(图5H)。因此,我们假设YAP1可以转化糖酵解酶的表达。实时PCR结果显示,YAP1 S127A突变体在LINC00941敲低PDAC细胞中可以逆转GLUT1、HK2、PFKFB3和LDHA的表达,而YAP1 S94A突变体则不能(图5I)。此外,ChIP-PCR结果显示YAP1可以直接结合GLUT1、HK2、PFKFB3和LDHA基因的启动子。综上所述,这些数据表明Hippo途径是LINC00941诱导糖酵解增强的中介。

6)LINC00941促进PP2A介导的MST1去磷酸化,触发Hippo通路
为了阐明LINC00941激活Hippo通路的机制,我们首先确定了LINC00941在PDAC细胞中的亚细胞定位。ISH染色结果显示LINC00941主要定位于PDAC细胞的胞质(图6A)。此外,通过LINC00941 RNA下拉和质谱分析,筛选与LINC00941相互作用的潜在蛋白(图6B)。结果表明,Hippo途径的关键节点之一MST1可以与LINC00941互作。免疫印迹数据显示LINC00941可与MST1相互作用(图6C)。为了进一步证实这种相互作用,我们对PANC-1细胞株进行了RIP实验。如图6D和6E所示,凝胶电泳和qPCR均能在MST1沉淀中检测到LINC00941,而在免疫球蛋白G (IgG)沉淀中检测不到LINC00941(图6D和6E)。为了明确LINC00941和MST1相互作用的确切区域,我们构建了一系列截断的LINC00941变体。LINC00941的800到1500核苷酸被发现与MST1结合(图6F)。竞争性RNA下拉实验及MST1和LINC00941免疫荧光染色进一步证实LINC00941与MST1相互作用(图6G和6H)。coIP结果显示,在LINC00941沉默的细胞中,MST1和PP2A之间的相互作用比对照细胞弱(图6I)。此外,PP2A沉默抵消了BXPC-3和CFPAC-1细胞中增强的糖酵解和促生长作用(图6J, 6K)。综上所述,这些结果表明LINC00941促进PP2A介导的MST1去磷酸化,从而触发Hippo通路。

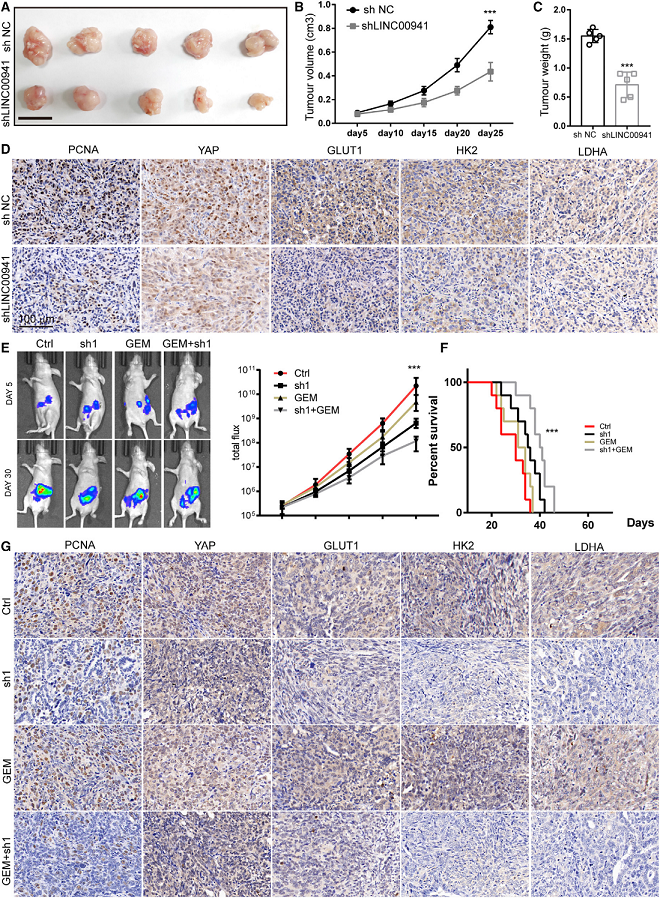
7)靶向LINC00941可阻碍PDAC在体内的进展
我们评估LINC00941缺失是否在体内干扰PDAC的形成。结果显示,注射对照细胞的小鼠比注射LINC00941敲除细胞的小鼠发生了更大的肿瘤(图7A)。肿瘤体积的统计分析(Vs)表明,来自对照细胞的皮下移植瘤比来自shLINC00941细胞的移植瘤发育得更快(图7B)。注射shLINC00941细胞的小鼠的肿瘤负荷低于对照组注射细胞的小鼠(图7C)。免疫组化(IHC)染色分析显示,来自shLINC00941细胞的肿瘤比来自shNC细胞的肿瘤表现出更弱的PCNA、YAP1、GLUT1、HK2和LDHA染色(图7D)。体内成像系统(IVIS)结果显示,LINC00941的缺失降低了PDAC细胞的侵袭性(图7E),延长了异种移植小鼠的总存活率(图7F)。为确定与一线药物的潜在协同作用,给予吉西他滨(50 mg/kg)。结果显示,与单独使用LINC00941缺失或吉西他滨治疗的小鼠相比,使用shLINC00941联合吉西他滨治疗的小鼠肿瘤更小,总生存期更长(图7F)。与LINC00941缺失组或吉西他滨单独处理组相比,shLINC00941 +吉西他滨组小鼠的切片显示出较弱的PCNA, YAP1, GLUT1, HK2和LDHA染色(图7G)。因此,LINC00941的缺失降低了肿瘤负担,并减弱了PDAC在体内的进展。
结论:我们的研究发现,在PDAC中LINC00941高表达与预后不良呈正相关。功能丧失和功能获得实验表明LINC00941促进PDAC癌细胞的生长和糖酵解。机理研究表明LINC00941通过促进MST1去磷酸化促进YAP1核定位和下游糖酵解相关基因表达。此外,体内研究表明LINC00941缺失可抑制PDAC的进展。






