本是同根生:M1-exo工程化以促进M2型TAM向M1转变
M2极化是抗肿瘤巨噬细胞,即与M1极化相比,促肿瘤的肿瘤相关巨噬细胞(TAMs)高表达白细胞介素-4受体(IL4R)。本研究中,作者利用M1巨噬细胞来源的外泌体,通过重编程TAMs为M1型巨噬细胞,从而促进M1极化和靶向IL4R,最终抑制肿瘤生长。本文于2021年9月发表在《Biomaterials》IF:12.479期刊上。
技术路线:

主要实验结果:
1、M1外泌体的特性以促进M1极化和靶向IL4R
如图1A所示,超离心法从M1巨噬细胞培养基分离出每只小鼠20 ~ 30 μg的外泌体。然后为了通过IL4R靶向M2巨噬细胞,使用DOPE-PEG-NHS膜磷脂为基础的锚定物(IL4Rp-1-Exo(si/mi)),用IL4Rp-1对Exo(si/mi)进行表面修饰。NTA分析显示M1外泌体、Exo(si/mi)、IL4R-Exo(si/mi)和IL4Rpep -1标记的M1外泌体(IL4R-Exo)相似(图1B-1E)。此外,M1和M2巨噬细胞外泌体都有相似水平的Alix和CD63表达,但是M1有更高的iNOS表达和更富丰的促炎性因子(IL-6,IL-12,IFN-γ);并且细胞裂解液中含有细胞标记物,如钙联蛋白和组蛋白,但外泌体中不含,这表明外泌体中不含死细胞的细胞碎片(图1F-1G)。
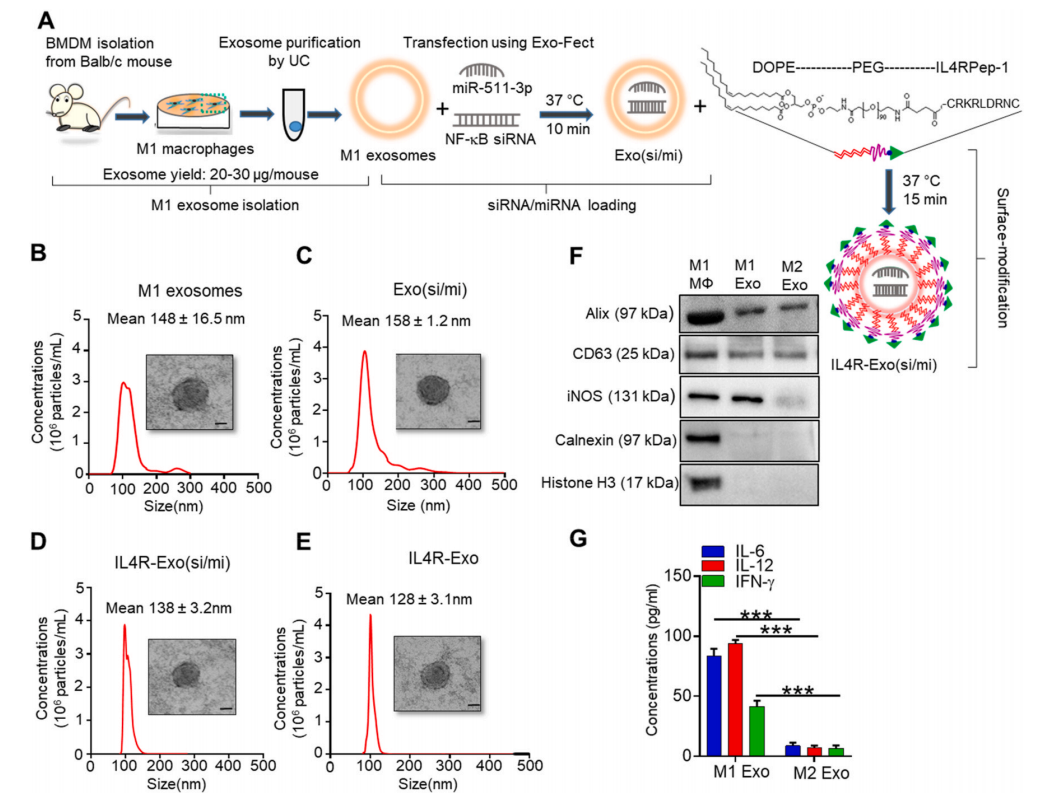
图1 IL4R靶向M1外泌体的制备与表征
随后,为了检测血浆中IL4RPep-1在外泌体膜的保留时间,作者使用CD63抗体捕获外泌体,用流式检测其表达,结果如图2B-2D所示,直至孵育后24小时内外泌体表达都没有显著改变,IL4RPep-1的血浆稳定性也在24小时内稳定不变。表明用DOPE-PEG-NHS锚定的IL4RPep-1外泌体至少可以在血浆中稳定存在24小时。
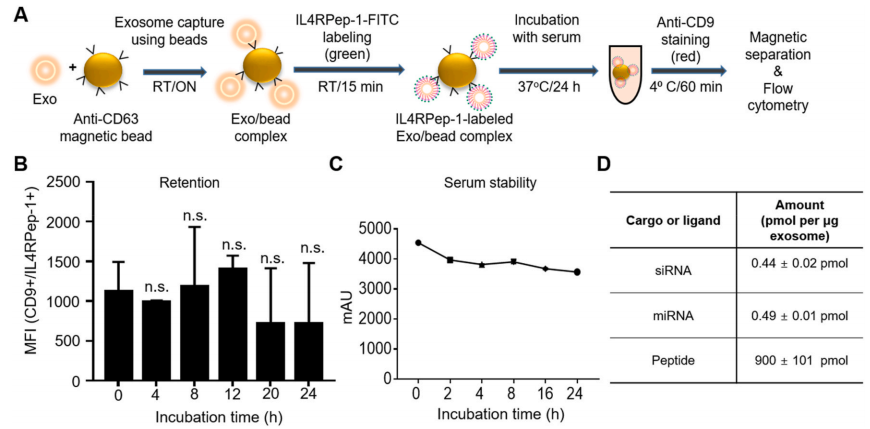
图2 IL4RPep-1的保留和血清稳定性,NF-κB p50 siRNA和miR-511-3p的包封入M1外泌体
2、IL4R-靶向的M1外泌体可有效被内化和传输至M2巨噬细胞并激活M1极化
如图3A和图3C所示,相比于未标记的外泌体,IL4R-Exo和多肽标记的外泌体(Ctrl-Exo)都可以被M1巨噬细胞有效内化,但是,相反的是,与Ctrl-Exo相比,IL4R-Exo可以更为有效的被M2巨噬细胞内化(图3B和图3C)。IL4R-Exo(si)负载红色荧光标记的对照siRNA可以更有效的将siRNA传递入M2巨噬细胞,与untargeted Exo(si)相比,但该过程可以被IL4R阻断性抗体抑制(图3D)。此外,IL4R-Exo(si)装载miR-511–3p运输至M2巨噬细胞的效率也更高,如图3E。
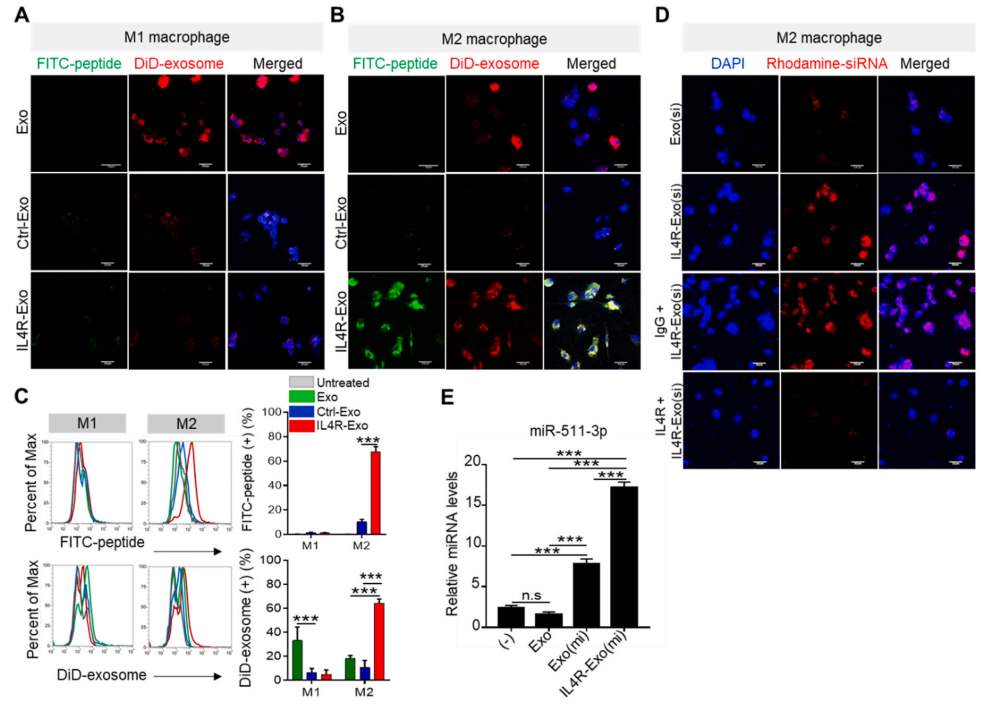
图3通过IL4R靶向的M1-Exo将siRNA和miRNA内化并传递到M2巨噬细胞
随后,检测IL4R-Exo(si/mi)能否有效的下调M2巨噬细胞中靶基因的表达。结果如图4所示,IL4R-Exo(si/mi)降低了NF-κB p50和ROCK2的表达,以及M2标志物Arg1和IL-10表达,同时增加了M1标志物IL12p40和iNOS的表达。这表明靶向M2巨噬细胞的IL4R可以使M1来源外泌体有效的传递siRNA和miRNA进入M2巨噬细胞,随即下调靶基因的表达促进巨噬细胞重编程转变为M1表型。
为了验证M1来源外泌体对于促进M2重编程的效果,作者加入了非免疫性的正常细胞HEK 293来源的外泌体((HEK-Exo),结果显示它不能影响NF-κB p50和ROCK2的表达,以及M1和M2标志物的表达(图4)。再次证实了IL4R-Exo(si/mi)能有效调控M2巨噬细胞重编程。
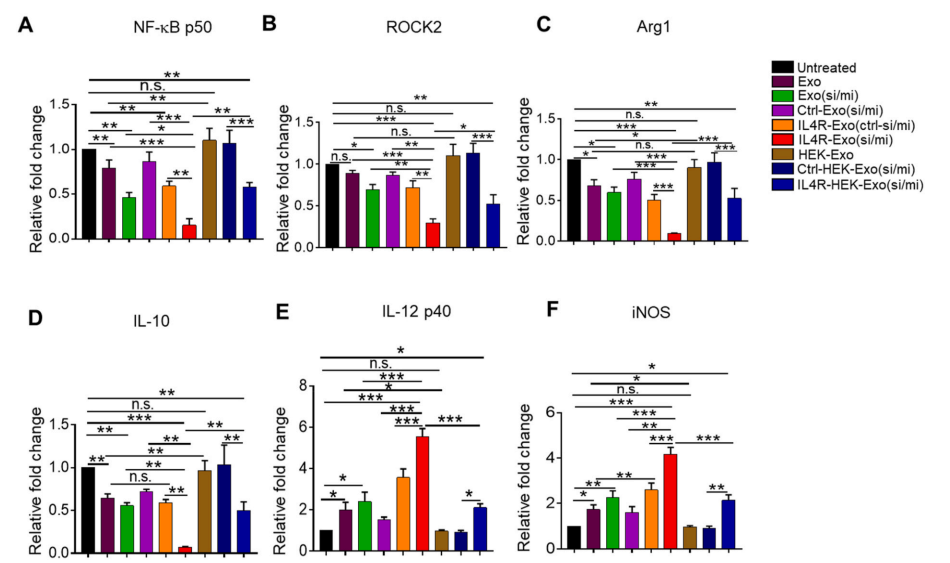
图4 IL4R靶向的M1外泌体对靶基因和巨噬细胞极化标记物的调控
3、IL4R靶向的M1外泌体在小鼠中聚集于肿瘤但很少在肝脏分布
研究表明大量系统管理的外泌体在体内网状内皮系统中积累,特别是在肝脏中。于是,作者检测了是否IL4R靶向的M1外泌体表面修饰可以减少肝脏的系统性外泌体摄取而增强其肿瘤集聚的活性。对于体内追踪,这里使用的是DiD荧光标记外泌体和4T1负荷乳腺癌肿瘤。将表达荧光素酶的4T1-luc肿瘤细胞接种到乳腺脂肪垫中,通过全身生物发光成像监测肿瘤生长(图5A)。外泌体注射2小时后拍摄的全身荧光成像显示,IL4R-Exo(si/mi)归属于肿瘤区域,而M1外泌体和对照肽标记的Ctrl-Exo(si/mi)分布于全身,肿瘤归属较少(图5B)。体外组织成像和定量显示,从IL4R-Exo(si/mi)组分离出的肿瘤具有更高水平荧光信号,而M1外泌体对照组则是在肝,肺,脾中显著聚集,Ctrl-Exo(si/mi)组则分布全身少量聚集于肿瘤(图5C-5D)。此外,与Ctrl-Exo(si/mi)相比,IL4R靶向外泌体显著富集于肿瘤,并且和IL4R和CD206在肿瘤里有明显共定位表达(图5E-5F)。
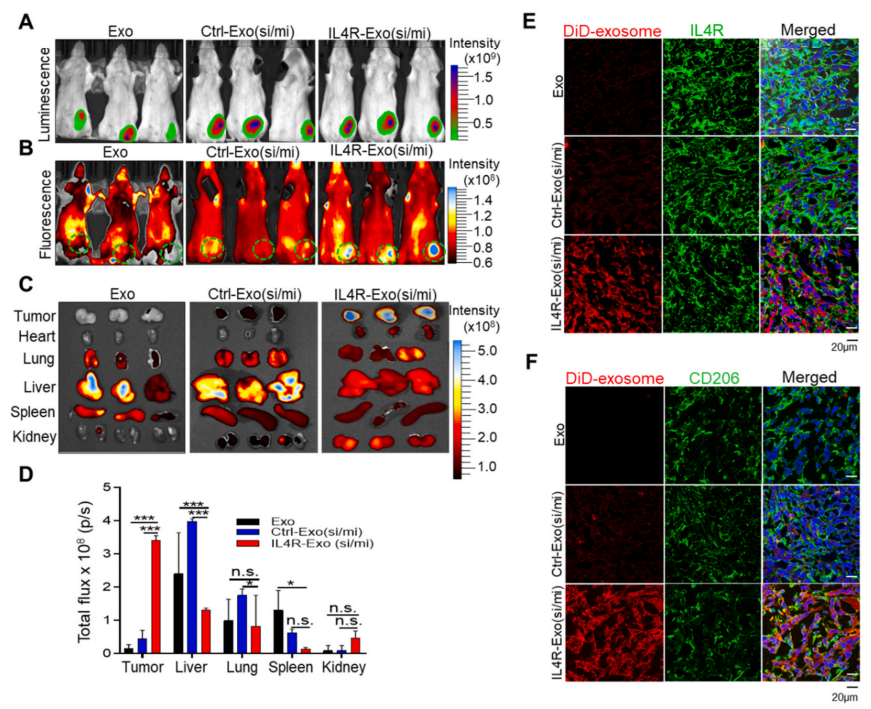
4、IL4R靶向的M1外泌体抑制肿瘤生长,重编程M2型TAM向M1型转变,并增强抗肿瘤免疫
为了检测IL4R-Exo(si/mi)的抗肿瘤生长活性,作者通过尾静脉注射外泌体至4T1负载小鼠中(图6A)。结果显示IL4R-Exo(si/mi)可以显著降低小鼠肿瘤的体积和肿瘤以及小鼠体重,同时下调肿瘤和淋巴结中NF-κB p50和ROCK2的表达。提示, IL4R-Exo(si/mi)具有抗肿瘤活性。
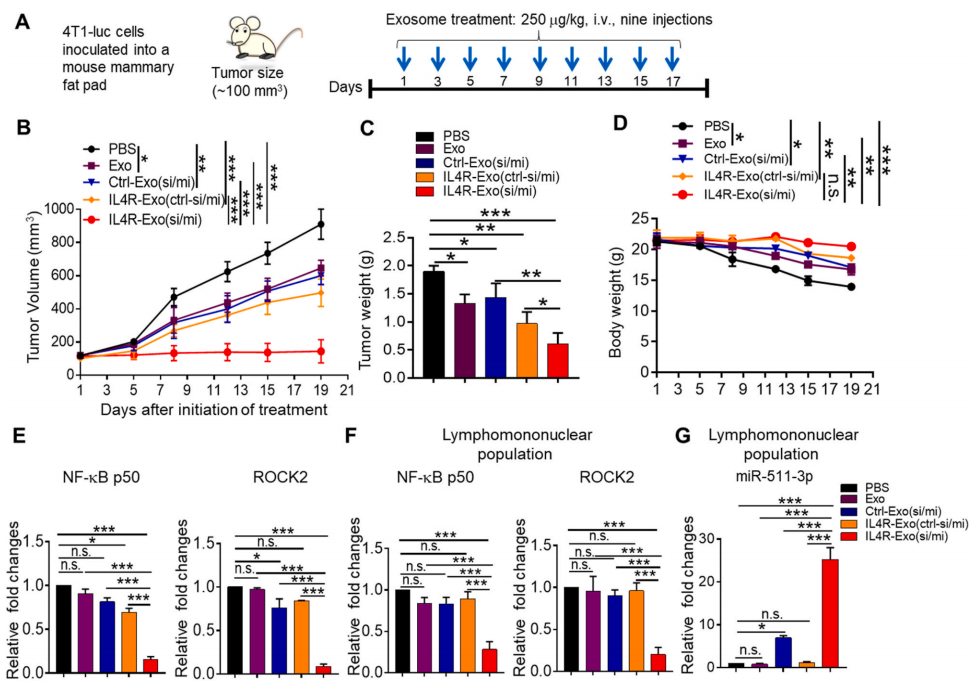
图6 IL4R靶向的M1外泌体对4T1乳腺肿瘤小鼠的抗肿瘤生长活性及靶基因的下调
为了检测IL4R-Exo(si/mi)重编程M2型TAM的能力,作者检测了4T1肿瘤微环境中M2和M1标志物的表达情况,结果如图7A-F所示,IL4R-Exo(si/mi)显著下调了M2型标志物的表达,如Arg1,TFG-β,IL-10和IL-4,显著增高了M1型标志物的表达,如IL-12p40和IFN-γ。
之后,分析了治疗后肿瘤组织中的免疫细胞群,结果发现IL4R-Exo(si/mi)显著减少了免疫抑制的M2巨噬细胞,即含有细胞内IL-10、MDSCs和Tregs的IL-10+巨噬细胞的数量,同时显著增加了M1细胞群和CD8+ T细胞(图7G-7M),但CD4+ T细胞的数量不受影响。
以上表明IL4R靶向的M1外泌体具有对4T1乳腺肿瘤小鼠的抗肿瘤生长活性及将M2巨噬细胞重编程为M1样巨噬细胞并增加抗肿瘤免疫的能力。
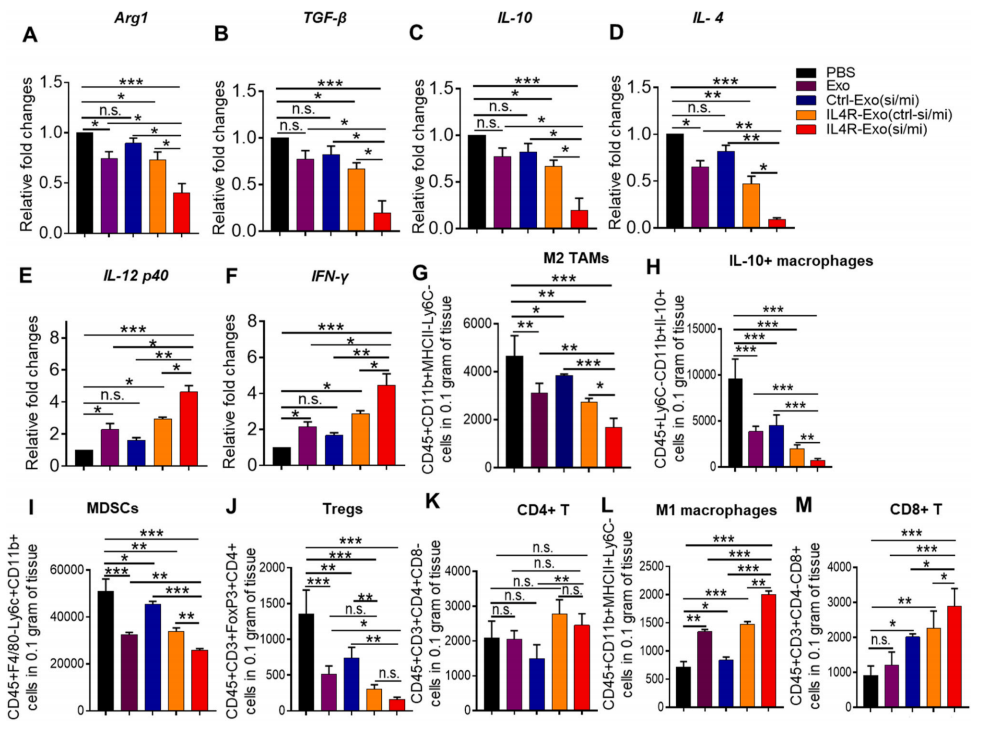
图7在4T1肿瘤微环境中,通过IL4R靶向M1外泌体将M2巨噬细胞重编程为M1样巨噬细胞并增加抗肿瘤免疫
参考文献:
Gunassekaran Gowri Rangaswamy., Poongkavithai Vadevoo Sri Murugan., Baek Moon-Chang., Lee Byungheon.(2021). M1 macrophage exosomes engineered to foster M1 polarization and target the IL-4 receptor inhibit tumor growth by reprogramming tumor-associated macrophages into M1-like macrophages. Biomaterials, 278(undefined), 121137. doi:10.1016/j.biomaterials.2021.121137






