CircCwc27通过抑制Pur –α的活性影响阿尔兹海默症的进程
环状RNA (Circular RNAs, CircRNAs)因参与多种生物的生物进程、涉及多种疾病近年来被广泛关注,虽然阿尔茨海默病(AD)中CircRNA的差异表达谱已经建立,但在基因表达和疾病相关认知中,与AD直接相关的关键CircRNA的特征和功能尚不清楚。本文中,作者筛选并鉴定出AD相关的新CircRNA,CircCwc27,并探索其分子机制。本文于2021年9月发表在《FEBS Journal》上,IF=10.7。

CircCwc27在阿尔兹海默症(AD)患者中上调表达
异常的CircRNA可能直接导致疾病的发生,筛选AD早期相关的CircRNA, 作者对6个月的APP/PS1转基因小鼠和WT对照小鼠的海马进行了深度CircRNA测序,发现131个表达异常的CircRNA ,其中上调,下调最显著的15个CircRNA在热图中显示(Figs. 1A),与野生型小鼠相比,其中有4个显著上调和4个显著下调的CircRNA在APP/PS1转基因小鼠的海马体中表达(Figs. 1B)。接下来对这8种CircRNA在AD患者的血浆和颞叶皮层中的水平进行检测,并比较了其在海马体中的相对丰度。结果显示,在AD患者的颞叶皮层和血浆中可以检测到CircCwc27表达量较高,与在APP/PS1转基因小鼠中观察到的一致(Figs. 1C),而且CircCwc27在海马体区表达上升最显著(Figs. 1D)。但线性Cwc27在皮层和海马体中的表达均未发生变化。因此,将CircCwc27在AD中的功能特性作为研究的重点。
CircCwc27是一种丰富、稳定的环状RNA,主要分布于神经元的细胞质中
为了进一步了解CircCwc27的作用,我们使用原位杂交和qRT-PCR方法来评估CircCwc27在大脑中的表达。结果显示,CircCwc27在AD患者比较脆弱的大脑皮质和海马体中高表达(Figs. 1E)。此外,在两组小鼠中,CircCwc27主要在神经元细胞而非胶质细胞中表达(Fig 1F,G)。还检测到,在每个海马体神经元中,平均有98个CircCwc27拷贝,在每个胶质瘤细胞中,平均有78个CircCwc27的拷贝(Fig 1H)。原位杂交与免疫染色进一步证实APP/PS1小鼠神经元中CircCwc27表达量较高。
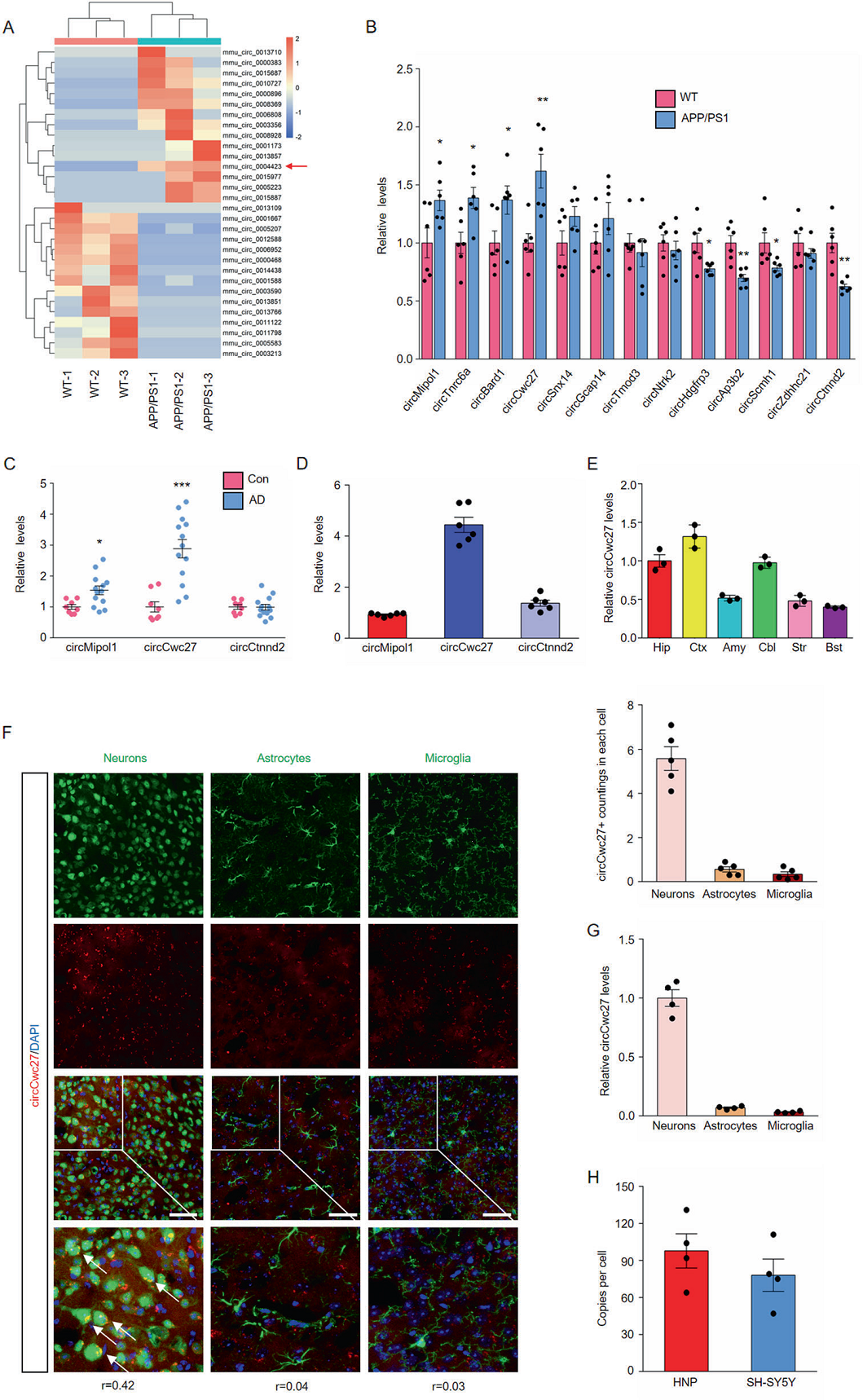
Figure 1 CircCwc27是一个高度丰富和稳定的circRNA,在AD中上调
在APP/PS1小鼠中,CircCwc27基因的敲除可改善认知衰退
为了确定CircCwc27的表达是否影响AD的行为缺陷和病理特征,作者在9个月大的小鼠中通过慢病毒注射进行了CircCwc27干扰处理(LV-sh-CircCwc27),同时设置了对照(LV-shCircCon)(Figs.2A),并在2个月后分析它们的记忆和空间学习能力。绿色荧光蛋白(GFP)信号在整个皮质和海马区广泛分布,并与神经元共定位(Figs.2B,C)。慢病毒转染后,CircCwc27表达显著降低,但Cwc27水平保持不变(Figs.2D)。Y迷宫自发交替行为测试显示注射LV-sh-CircCon的APP/PS1小鼠表现出明显的交替性下降,而进行CircCwc27干扰却明显阻止了交替性下降(Figs.2E),4组描述运动功能均未出现缺陷(Figs.2F)。该研究中还进行了Morris水迷宫任务来评估小鼠的空间学习和记忆。在训练阶段, 注射LV-sh-CircCon的APP/PS1小鼠表现找到隐藏的平台的速度明显缓慢,而注射LV-sh-CircCwc27能改善小鼠学习能力(Figs. 2G,H)。在调查试验中,发现下调CircCwc27的表达可以改善APP/PS1小鼠的空间记忆(Figs. 2I, K)。在实验中,两组小鼠的游泳速度没明显(Figs.2J)。总之,这些数据都表明了CircCwc27基因的抑制在很大程度上改善了AD的认知能力下降。
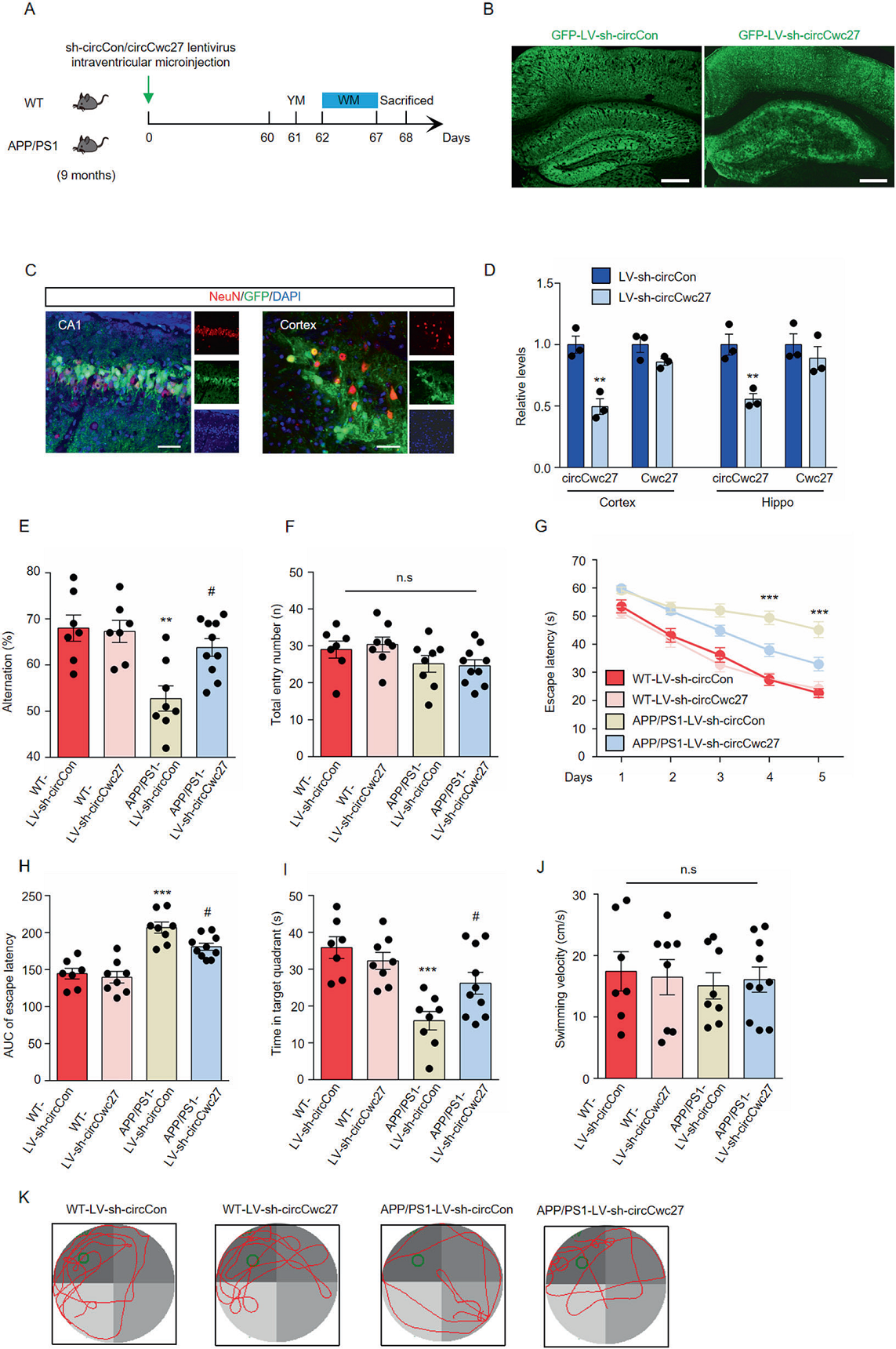
Figure 2敲掉circCwc27可以提高APP/PS1小鼠模型的空间学习记忆能力
CircCwc27下调可预防APP/PS1小鼠Aβ沉积及相关的神经退行性影响
行为测试后,进一步探索CircCwc27对AD病理的影响。研究中用抗Aβ抗体对APP/PS1小鼠的脑切片进行染色,结果显示,注射LV-shCircCwc27的小鼠斑块负荷明显减轻(Figs.3A),还发现注射LV-shCircCwc27后,皮质和海马的可溶性和不可溶性aβ40和aβ42也持续减少(Figs.3B-E)。此外,APP/PS1小鼠中,CircCwc27的表达与Aβ40和a β42的水平呈正向关(Figs.3F,G)。鉴于LV-sh-CircCwc27注射液对斑块沉积的保护作用,我们通过LAMP1抗体免疫染色检测了CircCwc27敲低是否影响轴突萎缩,因为在AD小鼠模型中,LAMP1阳性营养不良神经突与Aβ斑块密切相关。我们发现注射LV-sh-CircCwc27的小鼠海马中Aβ与营养不良神经突共定位的面积显著减少(Figs. 3H)。此外,还确定了CircCwc27对突触完整性的,LV-sh-CircCwc27注射并不影响突触相关蛋白的表达,而在APP/PS1小鼠中则显著防止突触相关蛋白降低(Figs. 3I)。小鼠脑切片免疫荧光染色进一步证实了上述结果。神经炎症是AD的另一个重要病理标志。研究中注射LV-sh-CircCwc27显著降低了APP/PS1小鼠小胶质细胞和星形胶质细胞的活性(Figs. 3J)。以上结果表明,敲除CircCwc27在AD的神经炎症和神经退行性影响中具有保护作用。
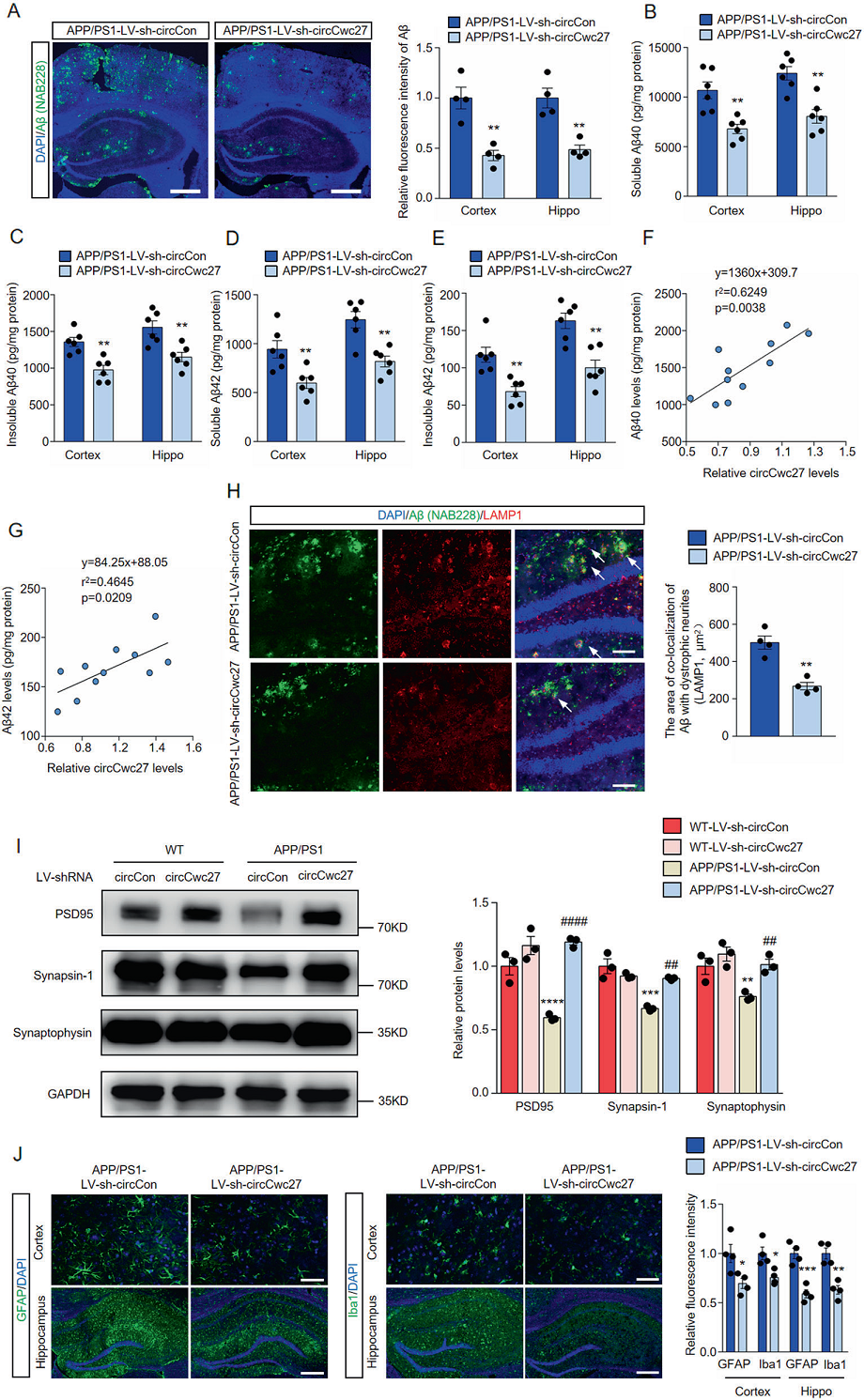
Figure3.抑制circCwc27可改善APP/PS1小鼠的AD情况
CircCwc27能直接与Pur-α蛋白结合,并影响Pur-α蛋白分布
为进一步探索CircCwc27引起AD的分子机制,作者假设CircCwc27具有翻译功能,但通过RegrRNA2.0分析,并未发现CircCwc27序列中包含开放的阅读框架(ORF),表明CircCwc27不能编码短肽。越来越多的证据显示,在细胞质中,大脑中的CircRNA能够作为miRNA海绵,于是作者检测了细胞质CircCwc27是否能与神经元中的miRNA结合。AGO2是RNA诱导沉默复合体的核心成分,也是CircRNA吸附miRNAs的必要条件。作者通过RNA免疫沉淀(RIP),观察到内源性CircCwc27并未在AGO2上富集(Figs.4A),说明CircCwc27并不作为miRNA的海绵发挥功能。于是,在APP/PS1小鼠中先通过RNA pull-down,再用质谱(MS)分析来寻找潜在的与CircCwc27相互作用的蛋白(Figs.4B),CircCwc27连接探针共拉下154个蛋白。GO富集分析表明,这些蛋白大部分与RNA结合相关(Figs.4C)。根据 RBPDB数据库进行分析,发现这154个蛋白中有85个是RNA结合蛋白(RBP)(Figs. 4B),筛选5个肽数最大的RBP进行进一步研究。RIP实验表明,CircCwc27能被Pur-α和HNRNPK抗体拉下(Figs.4D)。此外,与转染CircMock的细胞相比,转染CircCwc27的细胞中,Pur-α和HNRNPK能够显著拉下更高水平CircCwc27(Figs.4D)。RIP实验表明Pur-α对CircCwc27具有最大的结合能力,这与质谱结果一致(Pur-α在所有被CircCwc27拉下的蛋白中显示出最多的肽数),表明Pur-α介导CircCwc27功能,对CircCwc27具有重要的作用 (Figs.4D)。RNA下拉结果也验证了CircCwc27与Pur-α的直接相互作用(Figs.4E)。于是,进一步进行CircCwc27和Pur-α之间的内源性共定位(Figs.4F)。
已有研究表明,甘氨酸结构域和Pur-α中的PUR重复结构域可能负责招募RNA分子,因此作者构建了Pur-α全长和截断质粒。RIP检测结果表明PUR重复域(66-246aa)与CircCwc27直接结合(Figs.4G)。作者进一步研究了CircCwc27对Pur-α的调节作用,结果发现,CircCwc27的下调并不影响总Pur-α mRNA和蛋白水平,但CircCwc27引起的Pur-α沉淀的水平显著上调。与野生型小鼠相比,APP/PS1和APP/PS1- lv -sh- Circon小鼠中CircCwc27沉淀的Pur-α显著上调(Figs.4H)。
在APP/PS1小鼠中敲低CircCwc27,CircCwc27和Pur-α的结合显著降低(Figs.4H)。RIP测定也得到了类似的结果(Figs.4I)。由于CircCwc27主要定位于细胞质中,并且在AD中上调,我们探讨了增强CircCwc27和Pur-α之间的结合是否影响了Pur-α的分布。免疫印迹结果显示,APP/PS1小鼠中Pur-α在细胞核中的表达明显减少,而在细胞质中的表达明显增加(Figs.4J, K)。注射LV-shCircCwc27可显著促进Pur-α的分布(Figs.4J, K)。

Figs.4 CircCwc27与Pur-α蛋白相互作用,并影响Pur-α分布
Pur-α降低AD患者Aβ负荷,防止认知功能下降
最近研究表明,Pur-α在硬化症和额颞叶痴呆中起重要作用。但对Pur-α在AD中的作用知之甚少。由于Pur-α是CircCwc27的直接靶点,研究中通过注射与腺癌病毒相关的、携带flag标记物的Flag-AAV9-Control和Flag-AAV9-Pur-α到APP/PS1小鼠海马体中,观察Pur-α对AD病理的影响。注射两个月后,在小鼠海马体中出现明显的绿色荧光,说明存在有效转导(Figs.5A-C)。然而,CircCwc27在Pur-α过表达的大脑中表达没有变化(Figs.5D)。与对照组相比,Pur-α过表达显著减少APP/PS1小鼠海马区Aβ沉积和促炎因子(Figs 5E, F)。注射Flag-AAV9-Pur-α在很大程度上保护APP/PS1小鼠免于严重的记忆缺陷(图5G-I)。综上所述,Pur-α可减少Aβ沉积,挽救空间记忆损伤。
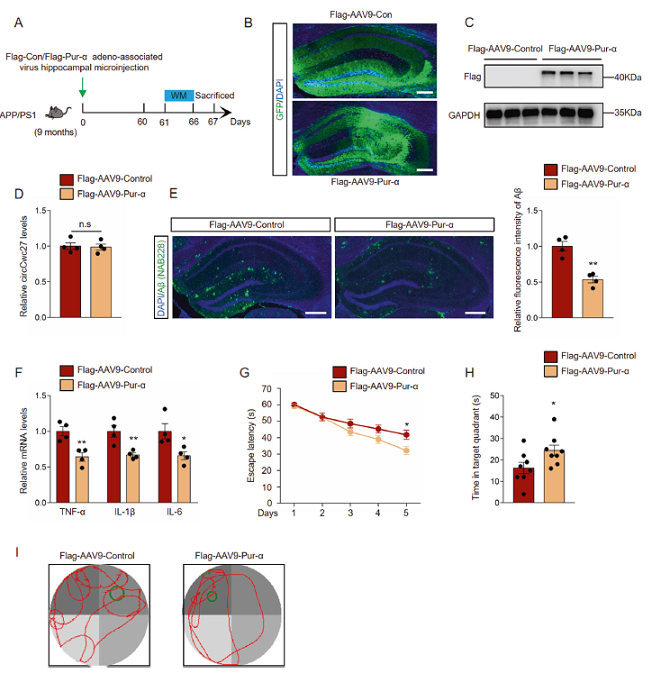
Figs.5 Pur-α可减少Aβ沉积,并预防AD认知功能下降
CircCwc27通过与Pur -α结合来调控AD基因的转录
以往研究发现,Pur-α有助于记忆保持和加强学习能力,并抑制APP的表达。结合组着的研究结果发现,CircCwc27可以与Pur-α结合,过表达Pur-α在很大程度上抑制了CircCwc27基因的表达,改善了Aβ负荷和认知功能下降的情况。作者推测,在AD患者中,Pur-α是CircCwc27下游的调节因子,可以调控a β和记忆相关基因。为了验证这一假设,作者对APP/PS1小鼠的海马体进行了lv-sh-Circcon-和LV-shCircCwc27-注射,并进行RNA-seq,筛选出鉴定了339个差异表达基因(Figs. 6A)。有意思的是,CircCwc27敲低后,APP和膜金属内肽酶(Mme)这两个负责Aβ代谢的基因也受到调节。不仅如此,学习和记忆方面的基因表达量显著上调(Figs. 6B–D)。而结果进一步发现,在APP/PS1小鼠和AD患者中,大部分CircCwc27调控基因的表达都发生了改变(Figs. 6E, F)。除了APP和Mme,多巴胺受体D1 (Drd1)、蛋白磷酸酶1、调节抑制剂亚单位1b (Ppp1r1b)、神经营养酪氨酸激酶受体1型(Ntrk1)和Lhx8这些已报道的参与了AD的病理过程的基因表达都发生改变。除了与RNA分子相互作用外,Pur-α还可以与RNA分子结合并参与许多细胞基因的转录控制,为了检验CircCwc27是否通过介导Pur-α与其启动子结合来调控基因表达,作者进行了ChIP-qPCR实验,验证了Pur-α直接结合到由CircCwc27控制的AD患者中异常基因的启动子上(Figs. 6G)。接下来,对CircCwc27进行敲低处理发现对Pur-α在其靶点启动子上富集确实受到影响。ChIP-qPCR实验表明,CircCwc27敲低可逆转Pur-α与这些基因启动子结合减少的现象(Fig. 6H)。因此,该研究表明,CircCwc27通过与Pur-α结合,减少了Pur-α对AD相关基因启动子的招募。
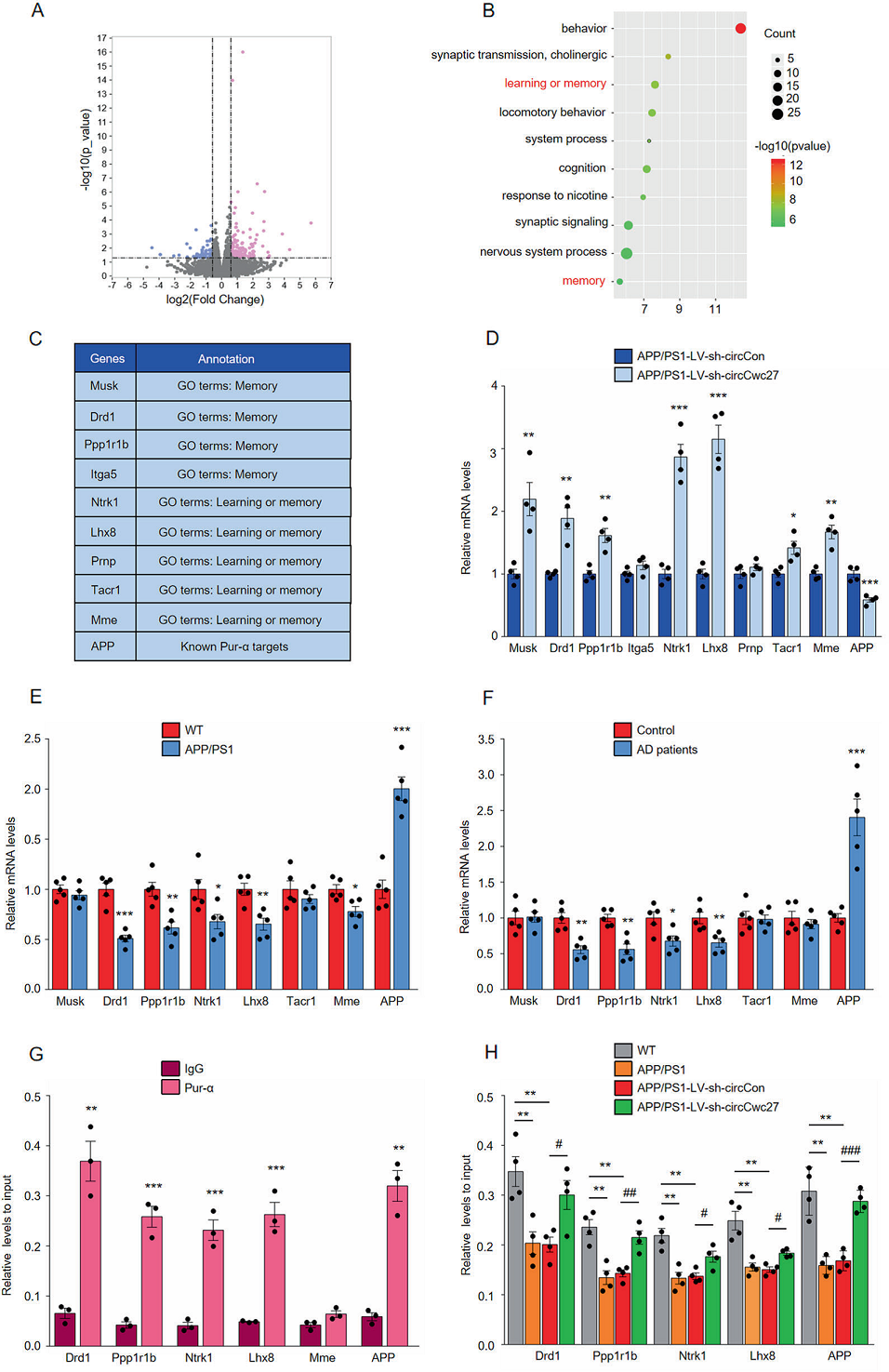
Figs.6 CircCwc27通过与Pur-α结合调控AD基因的转录
本文发现了一个与阿尔兹海默症直接相关的CircRNA- CircCwc27,并阐明了CircCwc27通过与Pur-α结合,使Pur-α减少了对AD相关基因启动子的招募,进而影响阿尔兹海默症进程的机制。
1. Song, C., et al., Circular RNA Cwc27 contributes to Alzheimer's disease pathogenesis by repressing Pur-alpha activity. Cell Death Differ, 2021.






