FBW7-NRA41-SCD1轴同步调控胰腺癌细胞凋亡和铁死亡

胰腺癌在美国癌症死亡原因中排第四名。手术切除是胰腺癌治愈的唯一机会,但由于诊断较晚,大多数患者失去了手术切除的机会,并且,胰腺癌对大多数化疗药物的反应很差。FBW7 (F-box and WD repeat domain-containing 7)是Skp1-Cul1-F-box (SCF)泛素连接酶复合物的底物识别成分,以多种癌蛋白为降解目标,也是人类癌症中最常见的突变基因之一,参与调节脂质过氧化。铁死亡是一种依赖铁的非凋亡细胞死亡形式,其特征是脂质过氧化,在癌症治疗方面表现出巨大的潜力。目前有作者研究了FBW7对胰腺癌患者铁死亡的影响,该研究发表在《Redox Biology》,IF:9.986。
技术路线:
主要研究结果:
1. FBW7促进胰腺癌细胞脂质过氧化
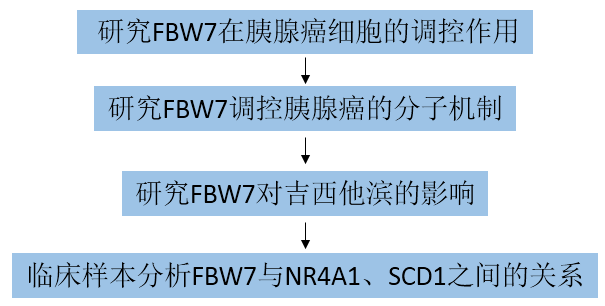
作者以分析在SW1990转染pCMV-FBW7或空载体(GEO: accession numbers GSE76443)的高通量基因表达谱阵列研究FBW7在胰腺癌中的作用。以谷胱甘肽代谢和脂肪酸代谢相关的氨基酸为重点,结果显示,FBW7WT和FBW7T205A下调丝氨酸、蛋氨酸、甘氨酸和胱氨酸,而FBW7R465H对丝氨酸、蛋氨酸、甘氨酸和胱氨酸无影响(图1A)。这些氨基酸可被催化生成谷胱甘肽(图1B)。作者检测了PANC-1和SW1990稳定细胞系异位表达空载体FBW7WT或FBW7T205A的GSH/GSSG比值,结果发现FBW7WT和FBW7T205A导致GSH/GSSG比值增加(图1C)。接着采用BODIPY 581/591C11探针检测氧化性脂质,并通过流式细胞术和共聚焦显微镜进一步分析发现当脂质过氧化发生时,荧光由红色变为绿色,显示FBW7WT和FBW7T205A导致脂质过氧化水平升高(图1D和E)。这些结果表明FBW7WT和FBW7T205A促进胰腺癌细胞的ROS和脂质过氧化。
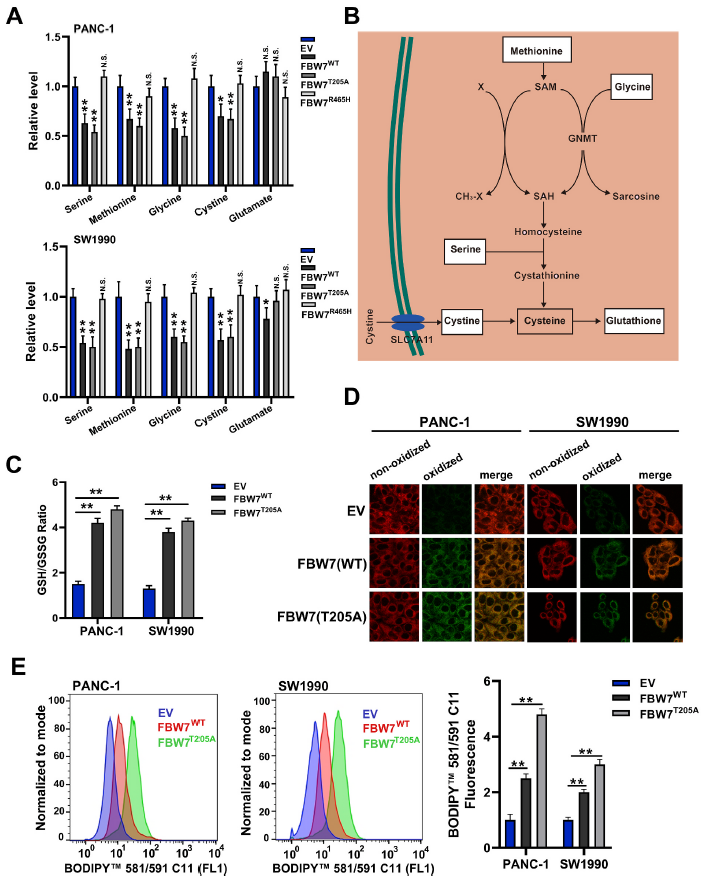
图1 FBW7促进胰腺癌细胞脂质过氧化
作者检测了铁死亡诱导物(RSL3、FIN56、erastin)对pan -1和SW1990稳定细胞系异位表达FBW7WT、FBW7T205A或空载体的杀伤作用。结果发现FBW7WT和FBW7T205A均增强了铁死亡诱导物对pan -1和SW1990细胞的杀伤作用,尤其是RSL3细胞(图2A和2B)。此外,铁死亡抑制剂ferrostatin-1(fer)可以逆转FBW7过表达引起的脂质过氧化(图2C和D),也部分挽救了被FBW7抑制的细胞活力(图2E)。这表明FBW7增强了胰腺癌细胞的铁死亡。
图2 FBW7可增强胰腺癌细胞的铁死亡
结合高通量基因表达谱阵列与SCD1有抑制铁死亡和凋亡的报道,作者推测FBW7可能通过抑制SCD1的表达来促进铁死亡。通过qRT-PCR和western blot验证了FBW7降低SCD1的mRNA和蛋白水平(图3A)。接着作者构建了pCMV-SCD1质粒,在PANC-1和SW1990稳定细胞系异位表达T205A突变体FBW7中过表达SCD1(图3B)。然后发现SCD1过表达主要可以逆转FBW7T205A引起的脂质过氧化(图3C和D)。此外, FBW7沉默能导致SCD1蛋白水平升高(图3E),也可以部分逆转RSL3或SCD1抑制剂降低的细胞活力(CAY 10566)(图3F)。SCD1过表达主要能减少FBW7T205A过表达引起的细胞凋亡(图3G)。电镜观察中发现FBW7T205A过表达导致细胞萎缩、线粒体萎缩、脂滴形成,其结构与RSL3与CAY 10566结合引起的结构相似(图3H)。这表明FBW7通过下调SCD1促进铁死亡和细胞凋亡。

图3 FBW7通过下调SCD1促进铁死亡和细胞凋亡。
4. FBW7通过NR4A1抑制SCD1的转录
作者在基因表达谱中发现了NR4A家族的核受体(NR4A1, NR4A2)是FBW7下调的基因。作者因此采用qRT-PCR和western blot检测了FBW7T205A过表达的PANC-1和SW1990细胞中NR4A1和NR4A2的水平。结果发现FBW7T205A降低了NR4A1和NR4A2的mRNA和蛋白水平。此外,与FBW7T205A相比,FBW7R465H(显性阴性FBW7突变体)仅略微降低了NR4A1、NR4A2和SCD1的表达(图4A和B)。同时NR4A1沉默降低了SCD1的表达(图4C和D) ,并且启动子实验发现NR4A1与SCD1启动子结合,促进了SCD1的转录(图4E和4F)。CHIP检测显示FBW7T205A过表达减少了NR4A1与SCD1启动子的结合,但过表达FBW7R465H无显著差异(图4G)。在荧光素酶检测中也有相同的趋势,MUT pGL3-SCD1启动子组没有显著差异(图4H)。此外, NR4A1过表达可抵消FBW7 T205A对SCD1的影响(图4I)。综上所述,FBW7通过降低NR4A1与SCD1启动子的结合来抑制SCD1的转录。
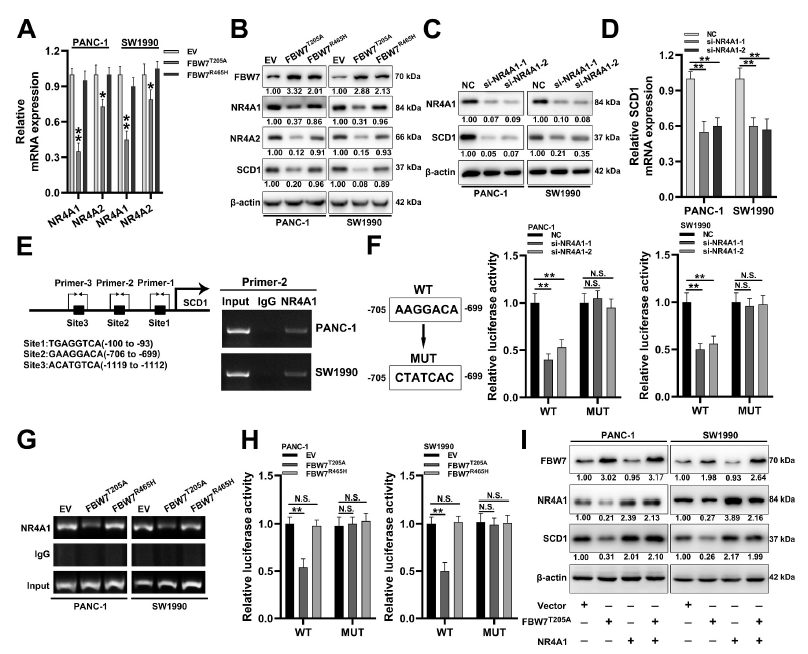
图4 FBW7通过NR4A1抑制SCD1的转录
此前文献报道NR4A1拮抗剂DIM-C-pPhOH通过抑制NR4A1的反式激活活性而诱导细胞凋亡。在本实验中,荧光报告基因检测显示,DIM-C-pPhOH降低了荧光素酶活性,但在NR4A1结合位点(MUT)突变组,荧光素酶活性无明显差异(图5A),这表明DIM-C-pPhOH通过NR4A1抑制SCD1的转录。此外,DIM-C-pPhOH还能降低pan -1和SW1990细胞中的SCD1蛋白(图5B)。同时DIM-C-pPhOH显著降低了RSL3在PANC-1和SW1990细胞中的IC50(半最大抑制浓度)(图5C)。DIM-C-pPhOH也可增加脂质过氧化水平,而铁死亡抑制剂Fer-1可在很大程度上逆转DIM-C-pPhOH引起的脂质过氧化(图5D和E)。此外, Fer-1、凋亡抑制剂 (zVAD)或SCD1活性的终产物(POA, OA)可以部分挽救DIM-C-pPhOH引起的细胞毒性效应(图5F)。同时在NR4A1沉默细胞中也得到了同样的趋势(图5G)。
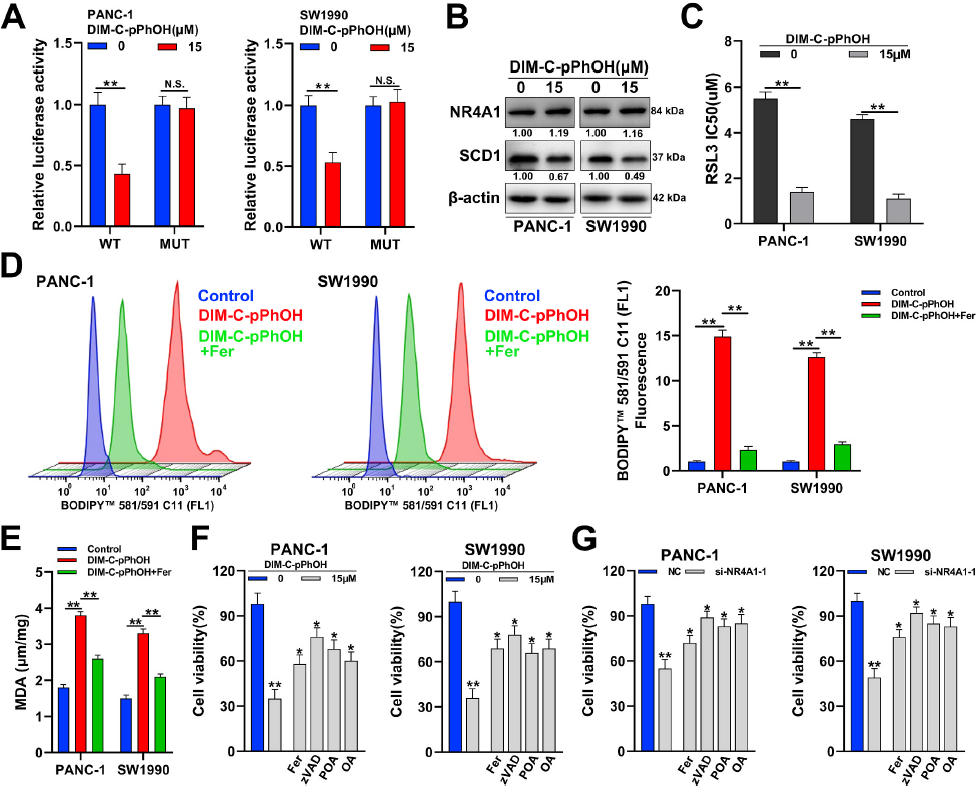
图5药物抑制NR4A1可促进胰腺癌细胞的铁死亡
6. FBW7通过铁死亡和细胞凋亡增强吉西他滨的细胞毒性作用
铁死亡诱导剂RSL3也可以增加吉西他滨对胰腺癌细胞的致死率,而铁死亡抑制剂Fer-1则具有相反的作用(图6A和B)。这表明激活铁死亡可以减轻胰腺癌患者对吉西他滨的耐药性。然后测试了FBW7对吉西他滨敏感性的影响。过表达FBW7T205A可明显增强吉西他滨的细胞毒作用,而过表达FBW7R465H则无明显变化(图6C和D)。用Fer-1或zVAD或两者同时预处理FBW7T205A过表达细胞。结果显示,Fer-1和zVAD均能部分挽救过表达FBW7T205A引起的细胞活力,而与Fer-1和zVAD联合使用则能完全回避FBW7T205A引起的细胞活力(图6E和F)。这些表明了FBW7通过铁死亡和凋亡增强吉西他滨的细胞毒性作用。

图6 FBW7通过铁死亡和细胞凋亡增强吉西他滨的细胞毒性作用
7. 胰腺癌组织中FBW7与NR4A1、SCD1相关
作者检测了在PADC患者组织中FBW7、NR4A1和SCD1表达之间的关系。对FBW7、NR4A1、SCD1进行组织免疫荧光检测,分别标记不同的荧光信号。结果显示,FBW7低表达时,NR4A1和SCD1高表达。FBW7高表达时则发现了相反的现象(图7A)。免疫组化染色进一步证实了上述结果(图7B),表明了FBW7与NR4A1、SCD1呈负相关(图7C)。IHC评分显示胰腺癌组织中NR4A1与SCD1呈正相关(图7D)。相应的TCGA和GTEx数据也显示相同结果(图7E和F)。Kaplan-Meier生存曲线和log rank检验显示,PDAC中NR4A1高表达与较差的总生存(OS)显著相关(图7G)。而在PDAC中,高水平的SCD1也与更大的肿瘤大小、较差的肿瘤分化和较差的总生存率相关(图7H)。
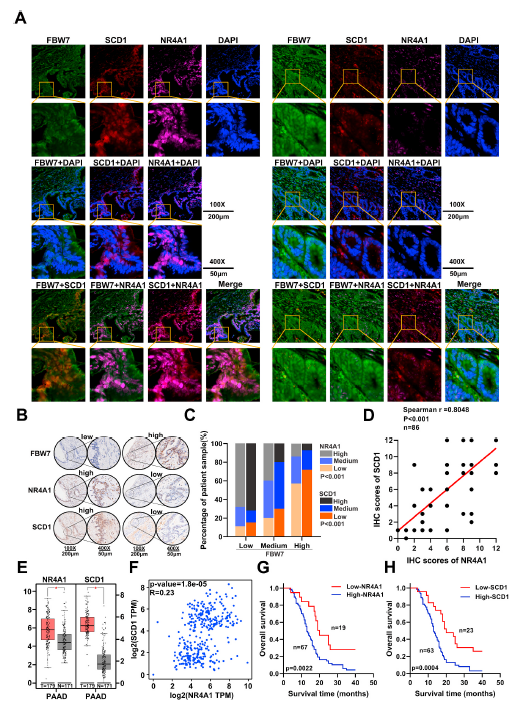
图7胰腺癌组织中FBW7与NR4A1、SCD1相关
主要结论:
作者证实FBW7-NR4A1-SCD1显著增强吉西他滨的细胞毒作用,为化疗干预提供了新的靶点。此外,还证明激活铁死亡和细胞凋亡极大地提高了吉西他滨的敏感性,这可能为胰腺癌的联合治疗提供策略。






