长链非编码RNA NR2F1-AS1通过调控NR2F1和ΔNp63 诱导乳腺癌肺转移性休眠
弥散性肿瘤细胞通常在远处器官中进入长期的休眠期,其特征是增殖减少但持续存活,直到转移生长觉醒。然而,转移性休眠和觉醒的调节机制在乳腺癌中仍然是未知的。本文中,作者发现乳腺癌干细胞样细胞(BSCS)的上皮样细胞和间充质样细胞在肺中表现出不同程度的休眠和致瘤性,于是进一步探索调节转移性休眠的机制。本文于2021年10月发表在《 Nature Communications》杂志上,IF=12.121。
本文技术路线:
主要结果如下:
许多研究报道了乳腺癌干细胞样细胞(BCSCs)的异质性。早期在MCF10乳腺癌细胞系中发现了两个BCSC亚群,其中的CD24−CD44med亚群(后面称为P1),CD44染色较弱,但检测为阳性。另一个CD24−CD44 high亚群(后面称为P2),CD44染色更强。在小鼠中发现,与没有CSC的细胞相比,P1和P2能显著提高致瘤能力,但只有P1能诱导BCSC转移。P1和富含P1细胞的转移细胞系MCF10CA1a中有上皮标记物CDH1的表达;而P2为间充质样亚群,能增强了体外迁移和侵袭特性。在含血清培养基中传代多次后,P1细胞部分转化为P2细胞,而在无血清培养基中则没有出现这种情况。当细胞被注射到小鼠体内时,P2肿瘤往往显示出更强的侵袭能力(Fig.1a)。
由于间充质样P2细胞表现出更高的迁移、侵袭和播散能力,但与上皮样P1细胞相比,肺转移数目却较少,作者试图分析这些细胞的转移过程。
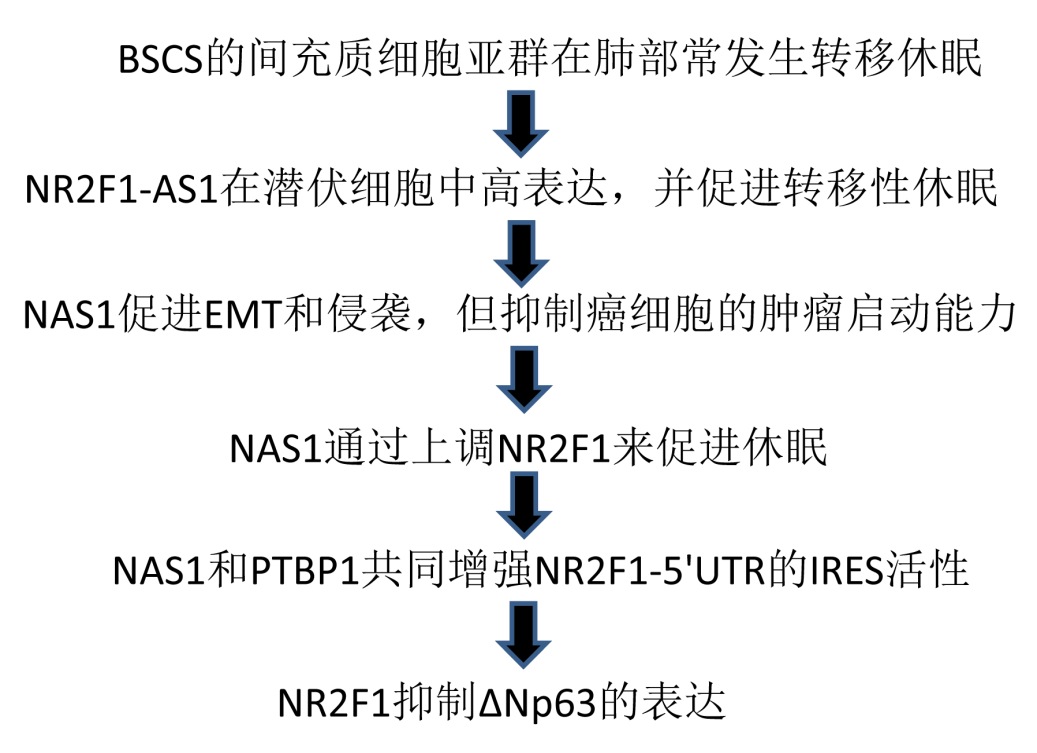
富含P1细胞的转移细胞系MCF10CA1a,转移性较低的细胞系MCF10CA1h,以及P1和P2亚群(CA1h-P1和CA1h-P2)通过萤火虫荧光素酶和GFP标记,再接种到小鼠中分析其在肺部的转移情况,结果发现,与MCF10CA1a细胞系相比,MCF10CA1h细胞系出现更多的GFP标记,与CA1h-P1细胞相比,CA1h-P2细胞GFP标记更显著(Fig. 1b, c)。然而,MCF10CA1h和CA1h-P2细胞在定殖初期不同时间点均有增殖活性(Fig. 1b, c)。小鼠生物荧光成像(BLI)的长期转移监测也显示初始播种期后肺内CA1h-P1稳定生长,而CA1h-P2细胞信号在18周后基本保持不变,但初始强度有所增强(Fig. 1d)。很多老鼠接种MCF10CA1a和CA1h-P1细胞最终在肺部发生转移(Fig. 1e),肺表面可见明显的肿瘤结节(Fig. 1f)和侵袭性肿瘤区域(Fig. 1g)。在20周内,MCF10CA1h和CA1h-P2保持为单细胞或小灶(Fig. 1g, h),导致肿瘤结节减少(Fig. 1f)。这些结果表明MCF10CA1h和CA1h-P2在肺部显示出休眠表型。

Fig1 P2 BCSC亚群在肺中显示休眠表型
然后,作者将肺休眠细胞(MCF10CA1h和CA1h-P2)和肺转移细胞(MCF10CA1a和CA1h-P1)以及在小鼠不能扩散到肺的MCF10AT进行测序比较。重点关注参与转移性休眠的LncRNA,在肺休眠细胞中发现了18个上调和7个下调的LncRNA (Fig. 2a)。NAS1表达与肿瘤复发潜伏期相关,NR2F1-AS1(NAS1)位于蛋白编码基因NR2F1的上游,但转录方向相反,属于上调的LncRNA。NAS1的片段长度在显示为3000bp左右(Fig. 2b)。进一步进行GSEA分析,显示NAS1敲低导致CA1h-P2转录组向P1样态转变,在NAS1 敲除后虽然肺部GFP+癌细胞更少,但这些细胞更具有增殖能力(Fig. 2c),4个月后,肺部会发生转移生长增强和甚至表现出更多的转移结节(Fig. 2d, e)。相反,过表达NAS1虽然在MCF10AT和CA1h-P1中增强了初始癌细胞在肺部的数量,但削弱了其增殖能力(Fig. 2f),导致肺部单个肿瘤细胞持续存在,最终导致转移性肿瘤结节减少(Fig. 2g,h)。将乳腺癌细胞的肺转移亚系MDA-MB-231原位注射到小鼠的乳腺脂肪中。后续分析显示NAS1增强肿瘤侵袭能力(Fig. 2i),但导致更多独立的肿瘤细胞并造成更少的转移性结节(Fig. 2 j, k)。这些数据表明,NAS1促进肿瘤细胞的转移,但抑制转移性产物的扩散,导致乳腺癌细胞在肺部的休眠。
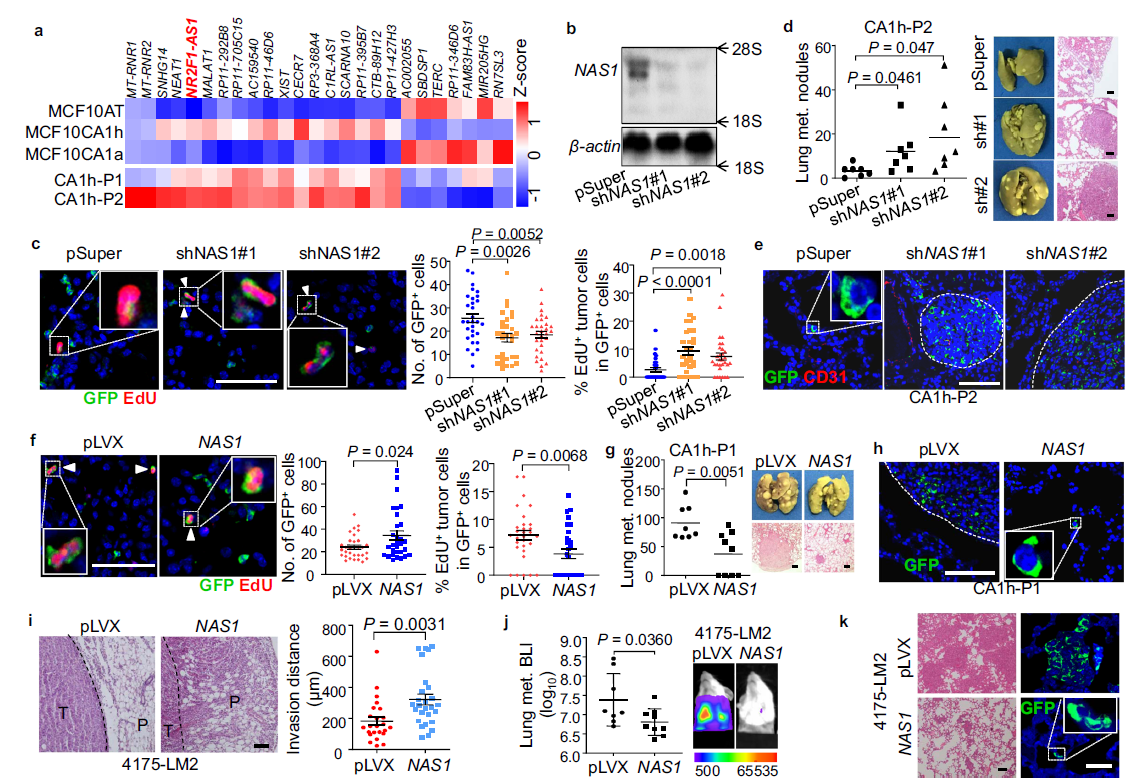
Fig. 2 NR2F1-AS1 (NAS1)促进乳腺癌的转移性休眠
3.NAS1促进EMT和侵袭,但抑制癌细胞的肿瘤启动能力
为了分析为什么NAS1会促进癌细胞生长,但抑制肺转移,作者首先分析了癌细胞的EMT状态和侵袭性。从细胞形态和各种EMT标记物的表达可以看出(Fig. 3a),在CA1h-P2 CSC亚群中,NAS1敲低可部分诱导上皮间充质转化(MET)。此外,作者还观察到,在CA1h-P2细胞中,NAS1敲低导致CD44下调,而在MCF10AT细胞中ALDH上调,而过表达NAS1能促进ALDH+细胞向cd44间质转化CSCs((Fig. 3b–e),证实了NAS1促进上皮-间质转化的作用。 转移性生长需要扩散的癌细胞产生新的肿瘤的能力。因此,作者接下来进一步评估NAS1在肿瘤启动中的作用。NAS1敲低显著增加CA1h-P2形成肿瘤的能力(Fig. 3f)。此外,肿瘤发生的限制性稀释试验显示,NAS1敲低极大地增加了体内肿瘤的发生和CA1h-P2引起的的肿瘤生长(Fig. 3g, h)。相反,在MCF10AT中过表达NAS1将会阻遏肿瘤的形成(Fig. 3i)。此外,作者发现在MCF10CA1a中过表达NAS1会降低了小鼠细胞的致瘤能力(Fig. 3j),,并降低原发肿瘤切除后的肿瘤复发率(Fig.3k)。总的来说,NAS1促进了肿瘤扩散和扩散所必需的癌细胞特征,包括EMT、迁移和侵袭,但抑制了启动新肿瘤生长的能力,从而导致了传播后休眠。
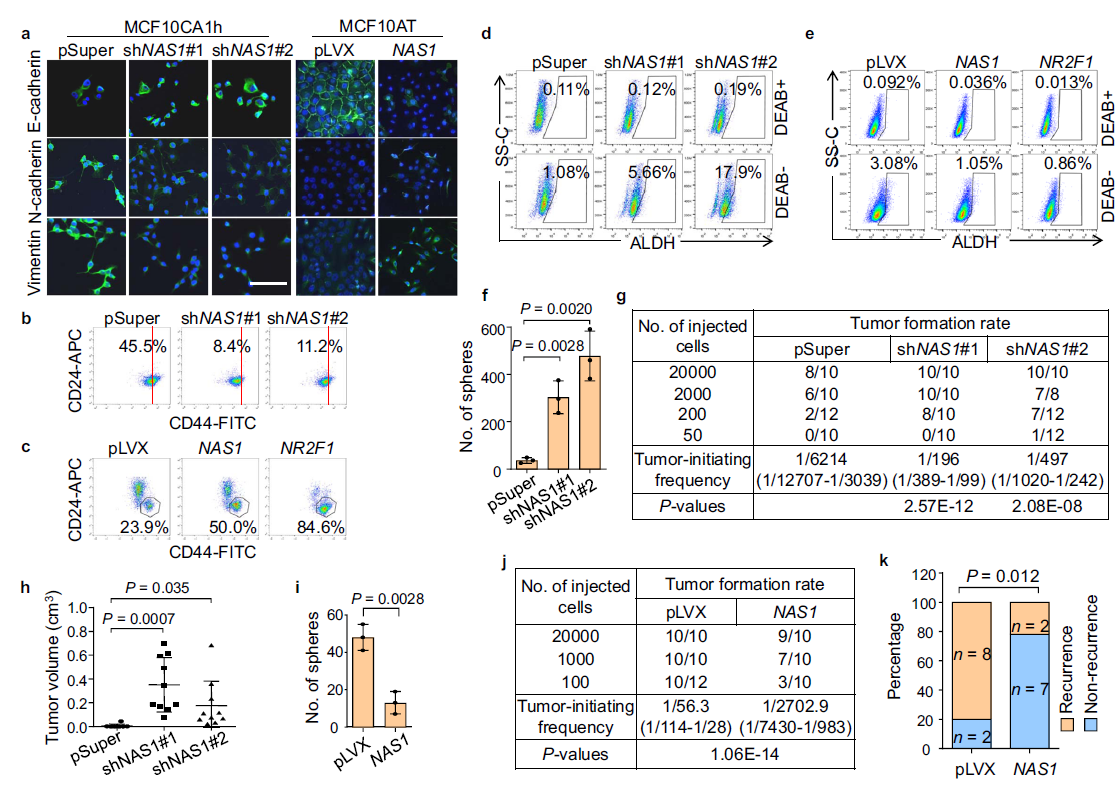
Fig3. NAS1促进EMT但抑制乳腺癌细胞的致瘤性
4. NAS1通过上调NR2F1来促进休眠
接下来,作者探讨了NAS1在转移调控中的分子机制。重点关注了位于NAS1附近的NR2F1基因,该基因编码一个促进肿瘤休眠的转录因子。作者发现NR2F1在不同转移能力的MCF10细胞中存在差异表达,NAS1能上调NR2F1的表达(Fig. 4a) 。此外,NR2F1过表达表现出类似NAS1的作用,能诱导细胞增殖(Fig. 4b),并在多个细胞系中抑制肿瘤球的形成(Fig. 4c)。为了进一步验证NR2F1是否作用于NAS1下游调控转移性休眠,将NR2F1在NAS1敲低的CA1h-P2细胞中过表达。NR2F1有效地恢复了这些细胞的间充质样表型(Fig. 4d)。此外,NR2F1降低了因NAS1敲低而增强的肿瘤形成能力(Fig. 4e, f)。更重要的是,当CA1h-P2细胞接种到小鼠体内,NR2F1过表达消除了NAS1敲除的作用,抑制了肿瘤细胞增殖(图4g),减少了肺转移瘤的生长和肿瘤结节的形成。这些数据提示,NAS1通过调节NR2F1促进乳腺癌转移性休眠。
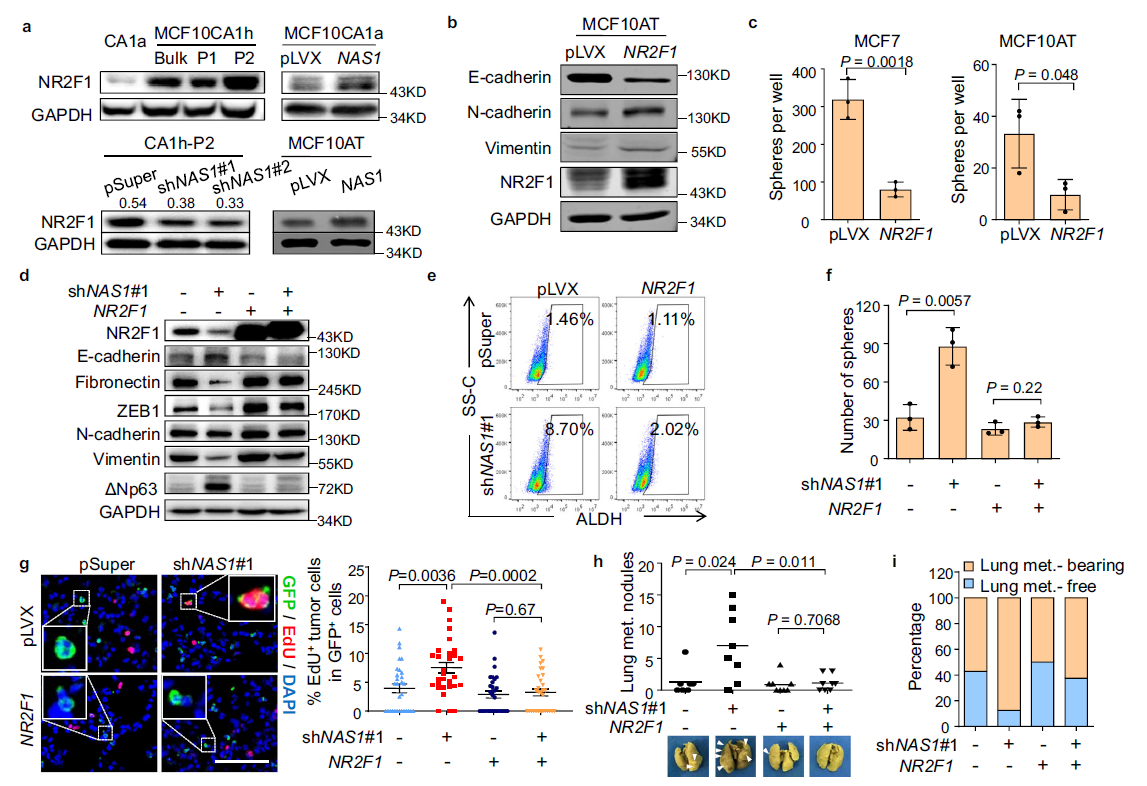
Fig4. NAS1通过NR2F1抑制乳腺癌肺转移
5.NAS1和PTBP1共同增强NR2F1-5'UTR的IRES活性
为了进一步研究NAS1如何调控NR2F1的表达,作者对NAS1进行RNA下拉实验,并进行质谱分析。将PTBP1作为结合蛋白,通过 WB实验发现 PTBP1能拉下NAS1 (Fig. 5a)。RNA免疫沉淀法也检测到PTBP1的免疫沉淀中含有NAS1, RNA(RIP)分析,进一步证明NAS1与PTBP1 的结合(Fig. 5b)。
接下来,作者分析了PTBP1在NR2F1表达中的作用。在MCF10AT中,过表达PTBP1可上调NR2F1,而在MCF10CA1h中,对 PTBP1进行干扰可明显降低NR2F1的蛋白水平,提示PTBP1参与了NAS1对NR2F1的调控。事实上,在MCF10AT中,敲除PTBP1以及过表达NAS1完全阻断了NR2F1通过NAS1表达;而在CA1h-P2中,PTBP1与NAS1敲除后,NR2F1蛋白水平恢复(Fig. 5c),证实了PTBP1介导了NAS1在NR2F1调控中的作用。
进一步分析PTBP1如何调控NR2F1的表达,在排除了PTBP1调控NR2F1启动子活性的可能性之后,通过RIP和融合蛋白免疫沉淀试验均发现NR2F1 mRNA与PTBP1结合(Fig. 5e),显示了PTBP1蛋白、NAS1 RNA和NR2F1 mRNA之间的相互作用。此外,作者还发现NAS1敲低可破坏PTBP1和NR2F1 mRNA的结合(Fig. 5f)。而抑制PTBP1后,拉下的NAS1中NR2F1 mRNA的下调无明显变化(Fig. 5g )。因此,这些数据表明NAS1促进PTBP1和NR2F1 mRNA的结合。
接下来,作者分析了NAS1和PTBP1如何调控NR2F1 mRNA。由于在NR2F1 mRNA的5'UTR中发现了多个多嘧啶区域,推测PTBP1和NAS1可能促进了NR2F1- 5'UTR的IRES功能。为了验证这一假设,作者构建了IRES活性报告质粒(Fig. 5h)以及NR2F1-5'UTR段(Fig. 5h),RES报告分析显示UTR具有轻微的启动翻译的活性,而5 'UTR-PT表现出更强的IRES活性。相反,5'UTR-GC完全没有IRES活性(图5i),接下来,作者通过pGL3报告基因评估了这些区域的潜在启动子活性,结果发现虽然5′UTR 和5′UTR-GC检测到轻微的启动活性,但5′UTR-PT没有启动转录的能力,表明NR2R1 5'UTR的多嘧啶区具有先天的IRES活性,而下游富含gc的序列的存在阻碍了这种活性的mRNA翻译。
有趣的是,通过蛋白-RNA,RNA-RNA相互作用预测工具(catRAPID61和IntaRNA62-65)进行分析,发现PTBP1和NAS1分别与NR2F1-5 '的多嘧啶和gc富集区域结合(Fig. 5j)。通过RIP和pull down实验对NR2F1 mRNA不同区域的进行RIP和RNA下拉分析,证实了NAS1 RNA优先结合5 'utr-gc(Fig. 5k), PTBP1只与5′UTR-P特异结合(Fig. 5l)。而且抑制PTBP1导致了5'UTR-PT IRES活性受到抑制(Fig. 5m)。反之,NAS1过表达可增强IRES 5'UTR的活性,但这种调节依赖于GC富集。5'UTR-PT较强的IRES活性不受NAS1的影响(图5n)。由此可见,PTBP1与NR2F1-5 ' utr的多嘧啶区域结合启动IRES活性,但NR2F1的翻译过程受到下游富gc区域的抑制。这种抑制可以通过与NAS1的结合而解除,可能是通过重塑在这个富含gc的区域形成的RNA结构(Fig. 5o)。
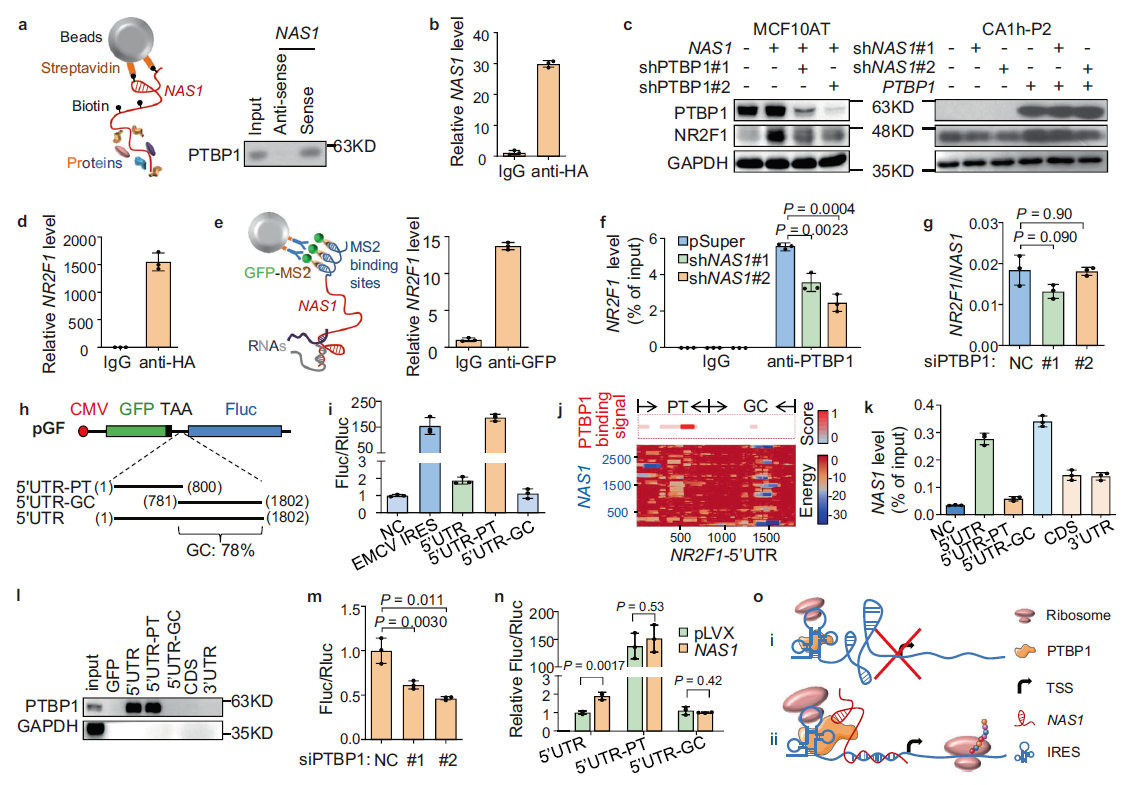
Fig 5 NAS1和PTBP1共同增强NR2F1-5'UTR的IRES功能
6. NR2F1抑制ΔNp63的表达
为进一步分析NAS1-NR2F1促进肿瘤细胞休眠的下游分子事件,通过对NAS1敲低或NR2F1过表达的癌细胞进行RNA测序分析。发现了miR-205和发生了miR-205的转录调控因子TP63基因变异的ΔNp63。已有报道阐明了miR-205通过靶向ZEB1和SIP168抑制肿瘤细胞EMT。
作者分析发现,miR-205和ΔNp63的表达均被NAS1和NR2F1显著抑制(Fig. 6a),,这一点被qPCR和WB检测进一步证实(Fig.6b–d)。
因此,作者对ΔNp63在NAS1诱导EMT和抑制肿瘤进行研究。在CA1h-P2细胞中,NAS1敲低的同时抑制ΔNp63,能逆转MET表型,恢复间质形态和标志物表达的(Fig. 6e)。而干扰ΔNp63也有效抑制了因NAS1基因敲低而造成肿瘤球形成能力(Fig. 6f)。GSEA分析发现NR2F1对ΔNp63的下游基因有抑制作用(Fig. 6g),。ChIP-qPCR分析显示NR2F1在ΔNp63启动子上结合(Fig.6h)。综上所述,这些数据表明NR2F1通过抑制ΔNp63的表达介导了NAS1的休眠促进功能。处理时,在CA1h-P2细胞中,抑制miR-205恢复了NAS1敲低造成的间叶细胞表型,NAS1过表达MCF10AT将会诱导细胞上皮恢复(Fig. 6i)。因此,miR-205作用于NAS1-NR2F1 -ΔNp63信号轴下游调控细胞EMT。
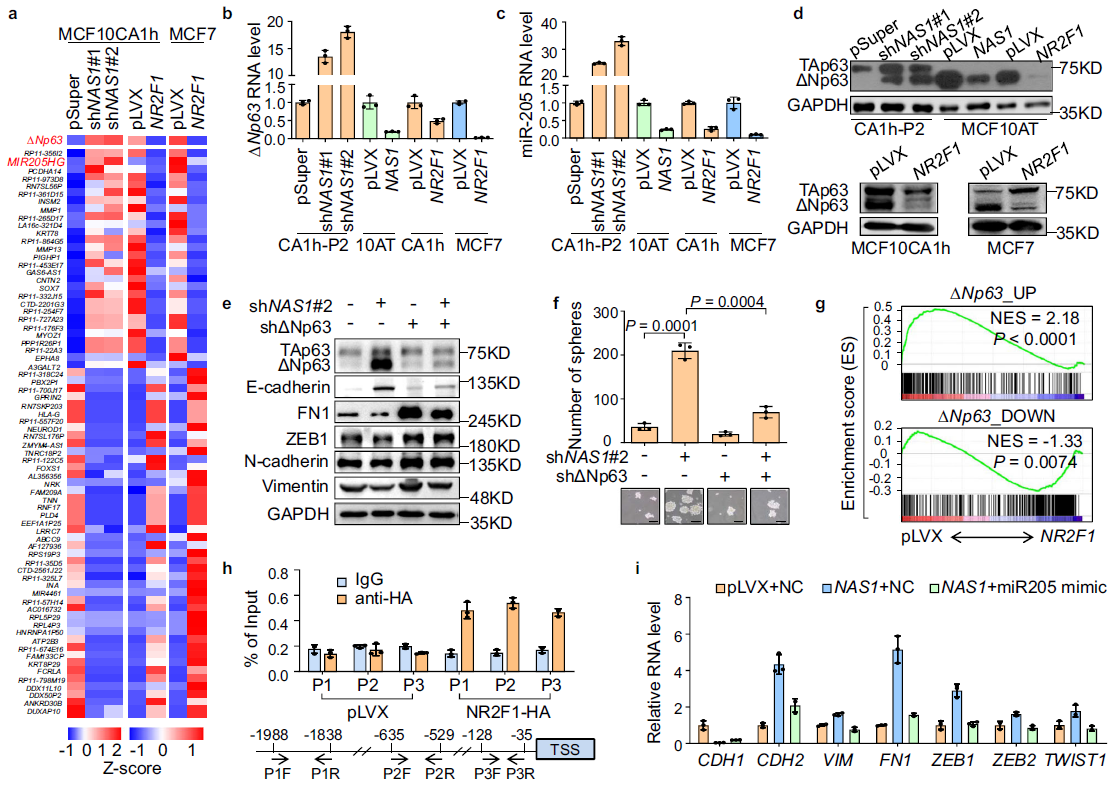
Fig 6 NR2F1通过抑制ΔNp63转录介导NAS1在休眠中的作用
7. 在乳腺肿瘤中,NAS1与NR2F1、EMT标记物和转移减少相关
最后,作者评估了NAS1的表达在乳腺肿瘤样本中的临床意义。首先,在乳腺癌患者的肿瘤样本中发现NAS1 RNA与NR2F1蛋白水平呈正相关(Fig. 7a), 验证了NAS1在调控中的作用NR2F1。然后,通过对RNA测序数据的分析,发现了NAS1与大量emt相关基因显著相关(Fig. 7b)。在乳腺癌阴性患者中,NAS1也与之前报道的M-BCSC和EMT基因标记的富集以及E-BCSC标记的缺失呈正相关(Fig. 7c)。其次,从齐鲁医院收集的89例乳腺癌样本分析发现肿瘤NAS1高表达与较低的转移和肿瘤复发风险相关(Fig. 7d, e)。
同时,Kaplan-Meier Plotter临床数据库74的分析也显示了NAS1改善了乳腺癌复发情况。通过转录组数据分析也发现敲低NAS1或过表达NR2F1都会促进 NAS1基因表达,与加速或抑制肿瘤转移相关(Fig. 7f, g)。最后,与正常乳腺组织相比,乳腺肿瘤中NAS1的下调(Fig. 10g),验证了NAS1抑制致瘤性的作用。
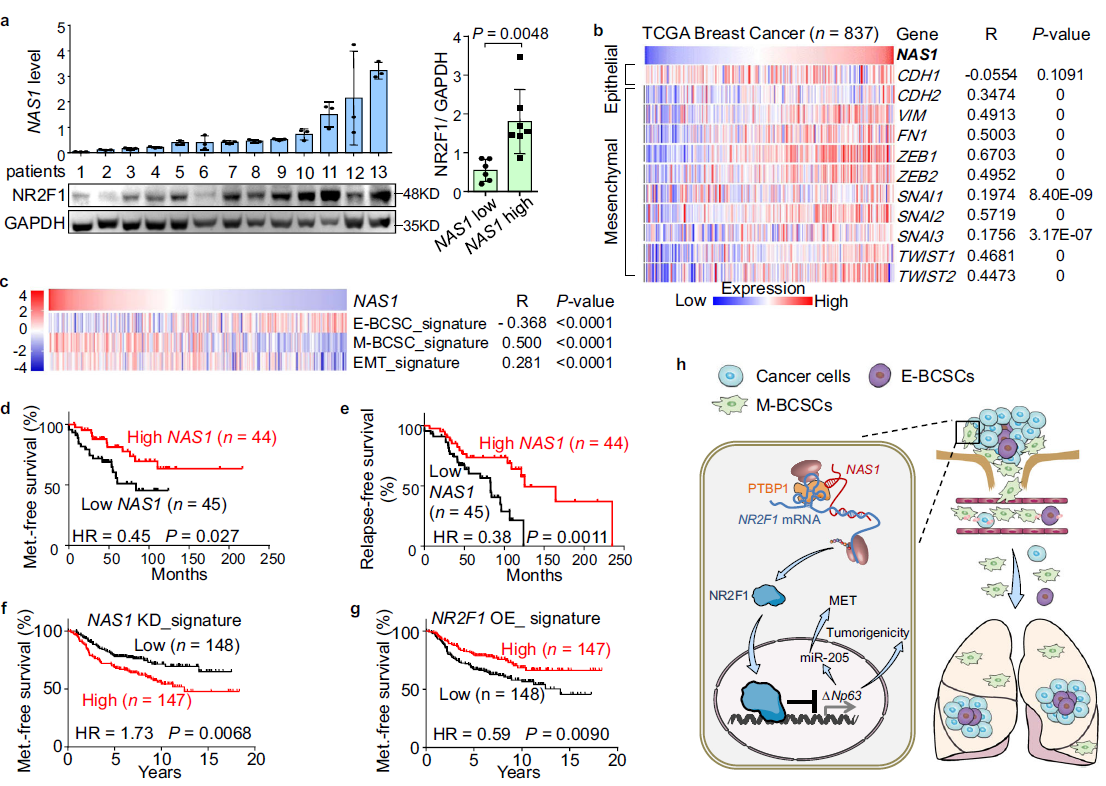
Fig 7 NAS1的表达在乳腺肿瘤中及其临床意义
本研究阐明了间充质肿瘤细胞在转移过程中的休眠机制。
1. Liu, Y., et al., Author Correction: Long non-coding RNA NR2F1-AS1 induces breast cancer lung metastatic dormancy by regulating NR2F1 and DeltaNp63. Nat Commun, 2021. 12(1): p. 5973.






