组蛋白去甲基化酶JMJD1C通过促进M1巨噬细胞极化预防胶质瘤
胶质瘤被认为是一种侵袭性致死的原发性脑肿瘤。JMJD1C是一种H3K9去甲基化酶,参与各种肿瘤的进展,但其在胶质瘤发展中的具体功能和潜在机制尚不明确。2021年9月发表于Clinical and Translational Medicine(IF=11.492)的文章“Histone demethylase JMJD1C promotes the polarization of M1 macrophages to prevent glioma by upregulating miR-302a”对此进行了介绍。在本文中,我们发现JMJD1C在胶质瘤组织中表达较差。此外,JMJD1C通过促进miR-302a启动子区域的H3K9me1去甲基化而增加了miR-302a的表达。miR-302a可靶向METTL3,METTL3可通过m6A修饰抑制SOCS2表达。在体内和体外,JMJD1C通过miR-302a/ METTTL3 /SOCS2轴促进M1巨噬细胞极化,抑制异种胶质瘤生长。这为JMJD1C在胶质瘤病理生物学中的作用提供了新的视角,可能为靶向治疗方法的研究提供了思路。

结果
1)JMJD1C在胶质瘤中下调并与免疫反应相关
根据生物信息学分析结果,发现胶质瘤样本中JMJT1C的表达呈下降趋势。通过RT-qPCR和IHC检测,与相邻正常组织相比,胶质瘤组织中JMJD1C表达较差(图1A,B)。同时,RT-qPCR显示U251、LN-229和LN-18细胞中JMJD1C水平较HEB细胞低(图1C)。我们采用高通量测序技术,在GBM LN-229细胞系中沉默JMJD1C后,研究基因的总体表达模式。JMJD1C的沉默改变了JMJD1C靶基因的表达。KEGG通路富集分析显示,JMJD1C相关基因在肿瘤坏死因子(TNF)信号通路和免疫应答过程的元件中富集(图1D,E),提示JMJD1C可能在LN-229细胞的免疫应答中发挥作用。随后,在LN-229和U251细胞株中检测免疫和炎症相关基因水平,发现过表达JMJD1C可导致LN-229细胞中TGFβ 1-3表达降低,IL -1β和IL-6表达升高(图1F,G)。因此,JMJD1C参与GBM的免疫应答。

2)JMJD1C在体内促进M1巨噬细胞极化,抑制胶质瘤
通过EdU染色和CCK-8法对稳定过表达JMJD1C的LN-229和U251细胞进行细胞增殖筛选,结果显示JMJD1C过表达对体外胶质瘤细胞增殖有作用(图2A,B)。然后,通过皮下注射表达OE-NC或OE-JMJD1C的LN-229细胞构建肿瘤小鼠模型。我们观察到过表达JMJD1C可抑制肿瘤的生长(图2C-E)。IHC和TUNEL检测结果显示,过表达JMJD1C诱导的TUNEL阳性细胞更多,Ki67阳性细胞更少(图2F)。采用流式细胞术检测M1巨噬细胞标记物CD86和M2巨噬细胞标记物CD206,结果显示JMJD1C过表达导致肿瘤组织中CD206+细胞减少,CD86+细胞增多(图2G)。RT-qPCR表明,相对于OE-NC,在OEJMJD1C处理的小鼠中M1标记IL-1β,TNF,CXCL9,IL-23,ROS1,IL-12和IL-12b水平增加,而M2标记TGFB1,VEGFA,EGF,IL-6,IL-10,ARG1,RETNLA 和CCL22减少(图2 h, I)。这些结果提示,JMJD1C本身并不影响胶质瘤细胞增殖,但能抑制胶质瘤细胞在体内的生长,这可能与M1巨噬细胞极化增强、M2巨噬细胞极化减弱有关。
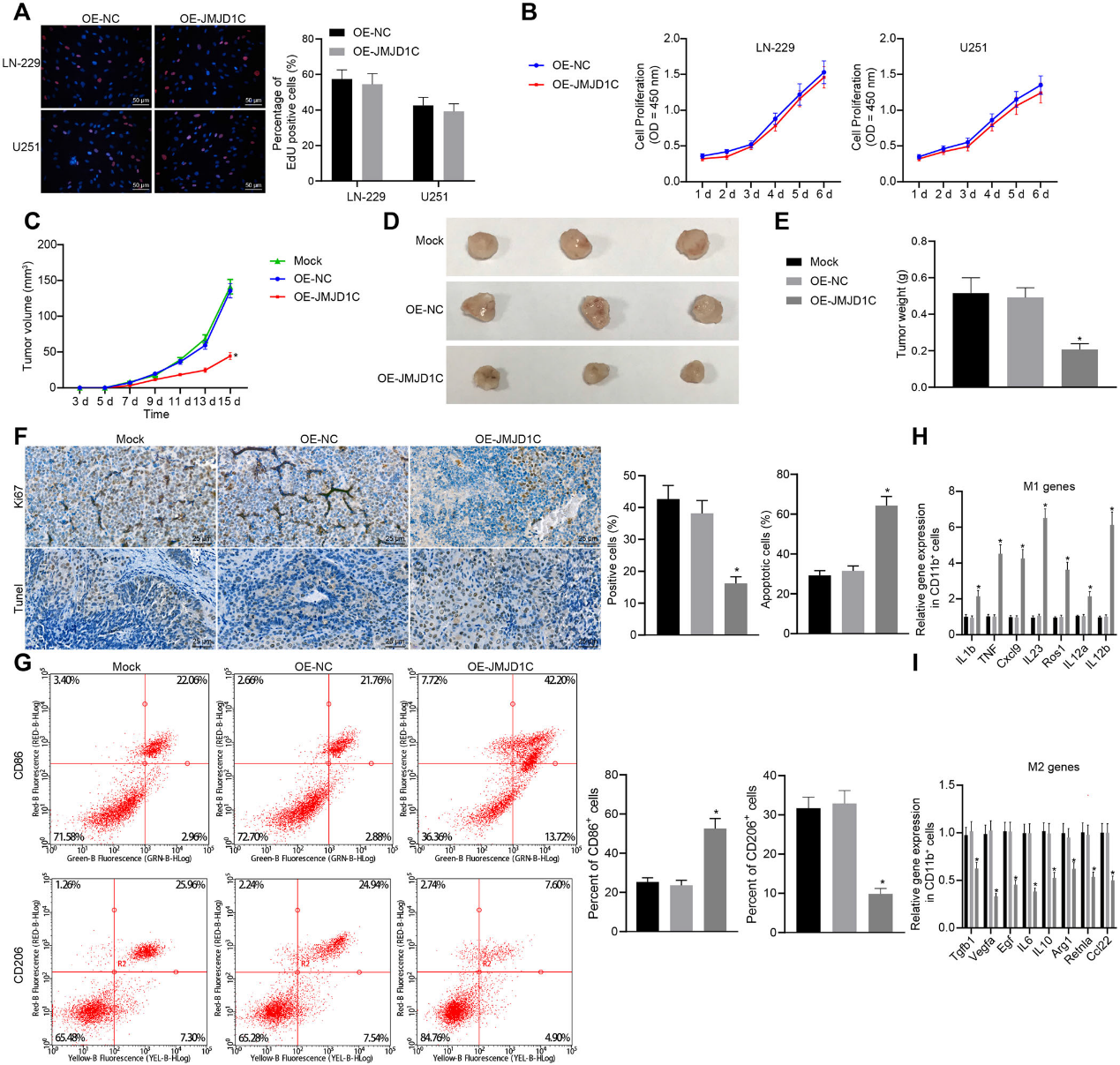
3)特异性表达JMJD1C可加速M1巨噬细胞的极化
免疫印迹法检测转染OE-JMJD1C质粒的LN-229和U251细胞系中JMJD1C的表达情况(图3A,B)。其次,根据效应细胞的E/T比值,CD86+ M1巨噬细胞的诱导与CD14 + PBMCs有区别,E/T比为50:1的共培养诱导效果最佳(图3C,D)。共培养实验显示,JMJD1C升高增加了LN-229和U251细胞中单核细胞分化的CD86+M1巨噬细胞的数量(图3E,F)。此外,RT-qPCR结果显示,在CD14+PBMCs中,上调JMJD1C可促进M1标记基因的表达,抑制M2标记基因的表达(图3G,H)。因此,JMJD1C过表达有可能使巨噬细胞向M1表型极化。
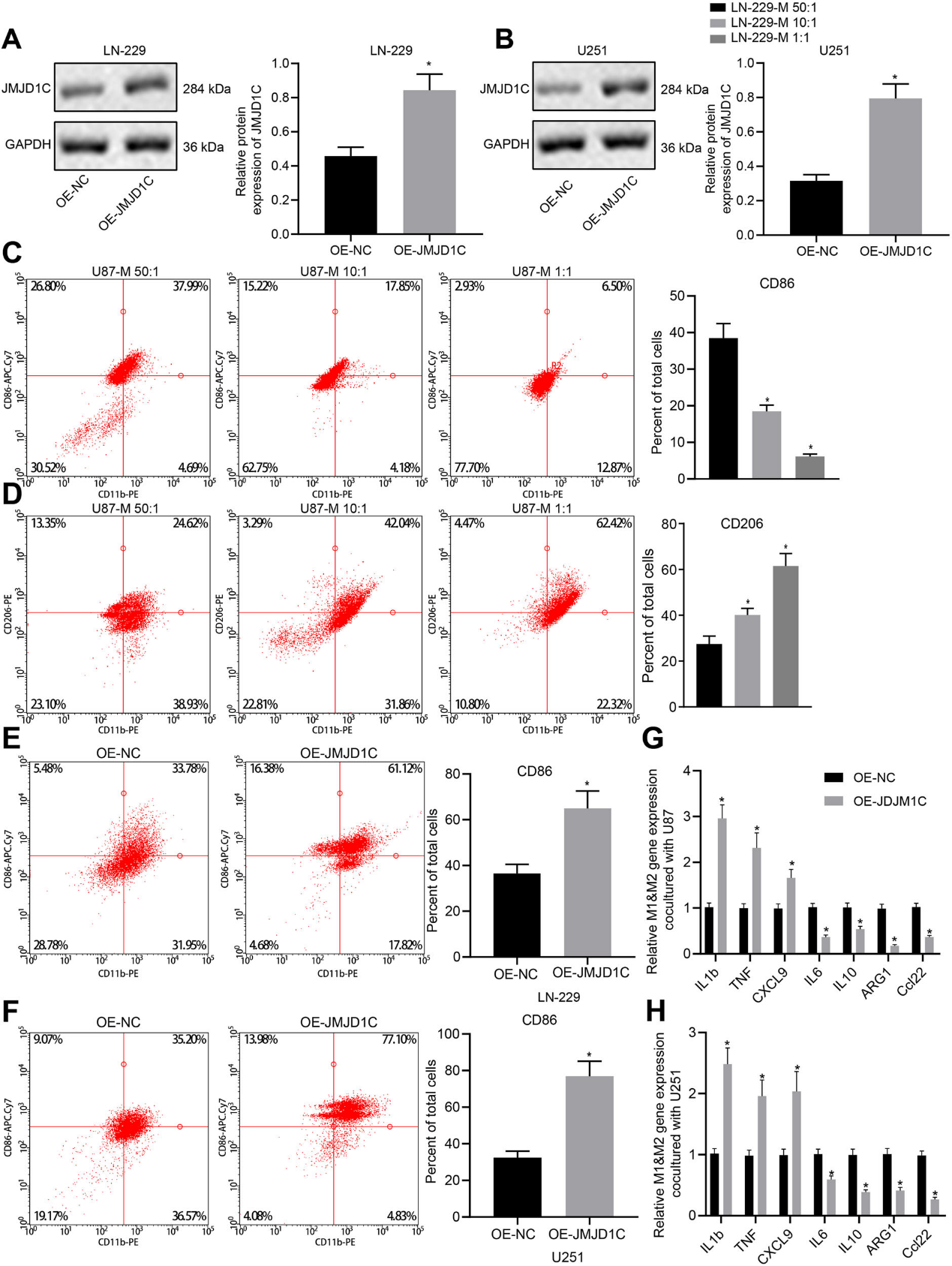
4)JMJD1C通过促进miR-302a启动子区H3K9去甲基化上调miR-302a
根据既往文献,我们推测JMJD1C可能通过调节miR-302a影响胶质瘤细胞增殖。正如预期的那样,RT-qPCR和原位杂交结果表明,miR-302a下调发生在胶质瘤组织中(图4A,B)。同时,miR-302a在胶质瘤细胞中的表达水平也降低(图4C)。而在JMJD1C过表达的LN-229细胞中miR-302a水平升高,在JMJD1C沉默的细胞中miR-302a水平显著降低(图4D)。然后,我们发现,通过ChIP检测,在OE-JMJD1C处理的细胞中,JMJD1C的富集程度(图4E)高于OENC处理的细胞。过表达JMJD1C后H3K9me1水平降低(图4F),说明JMJD1C可能通过H3K9去甲基化促进miR-302a的表达。

5)miR-302a靶向METTL3
正如生物信息学网站所预测的,miR-302a与METTTL3 3'UTR之间的靶向结合位点被鉴定出来(图5A)。双荧光素酶报告基因检测结果验证了靶向性(图5B)。使用生物素标记的miR-302a探针进行RNA下拉实验,进一步证实了miR-302a和METTL3之间的相互作用(图5C)。RT-qPCR结合免疫印迹技术检测LN-229细胞中miR-302a过表达或耗尽后METTTL3的表达变化(图5E,F)。通过RT-qPCR验证过表达和耗尽的效率(图5D)。在miR-302a模拟处理的细胞中,METTL3的表达减少,而在miR-302a抑制物处理的细胞中,METTL3的表达增加。这些结果一致表明miR-302a靶向METTTL3。
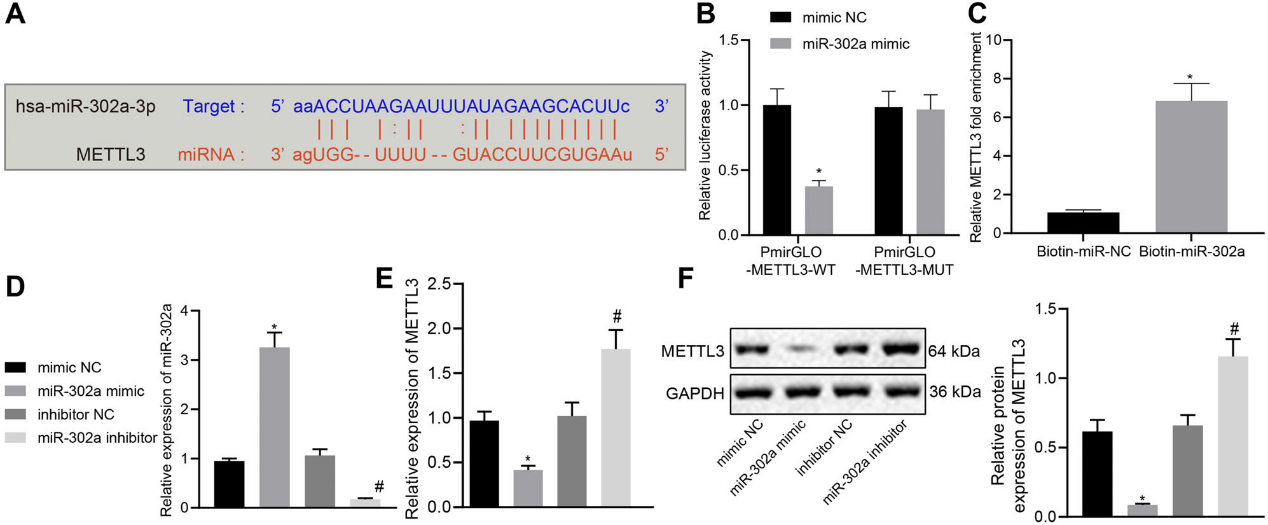
6)METTTL3通过降解m6A修饰诱导的SOCS2 mRNA抑制M1巨噬细胞极化
我们还研究了mRNA甲基化酶METTTL3对胶质瘤细胞SOCS2表达的影响。根据GEPIA数据库,GBM组织中SOCS2相对于正常组织有升高(图6A)。RT-qPCR检测的临床样本中SOCS2 mRNA水平在胶质瘤组织中呈上升趋势(图6B)。SOCS2蛋白在胶质瘤组织中的表达也增加(图6C)。随后,在LN-229细胞中过表达或沉默METTL3,发现这抑制了SOCS2 mRNA和蛋白的表达,而沉默METTL3则导致相反的结果(图6D,E)。考虑到METTTL3是一种甲基转移酶,采用MeRIP-RTqPCR分析过表达METTTL3的LN-229细胞中SOCS2的m6A水平,发现过表达METTTL3时SOCS2的甲基化水平升高(图6F)。以上结果表明,METTTL3通过促进SOCS2的m6A甲基化修饰来促进胶质瘤中SOCS2的降解。另外,METTL3过表达导致SOCS2表达受到抑制,而METTL3与SOCS2共转染促进SOCS2表达(图6G)。人类CD14+单核细胞和神经胶质瘤细胞的共培养显示,过表达METTL3减少CD86 + M1巨噬细胞的数量,而同时过表达METTL3和SOCS2使CD86 + M1巨噬细胞的数量增加(图6 h,I)。此外,过表达METTTL3导致M1标记表达被抑制,M2标记表达升高,而与SOCS2共转染促进M1标记基因表达,抑制M2标记基因表达(图6J)。以上数据表明METTTL3可能通过诱导SOCS2 mRNA的降解来促进M1巨噬细胞极化。
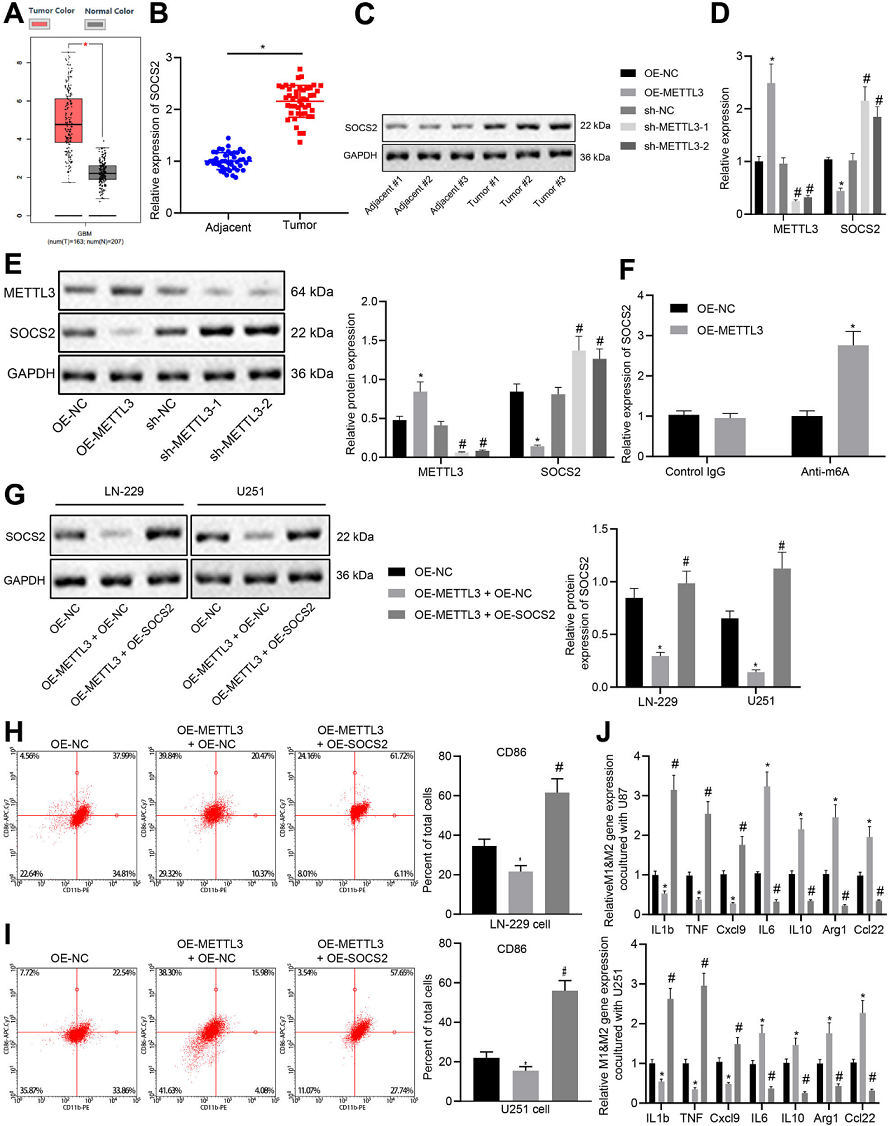
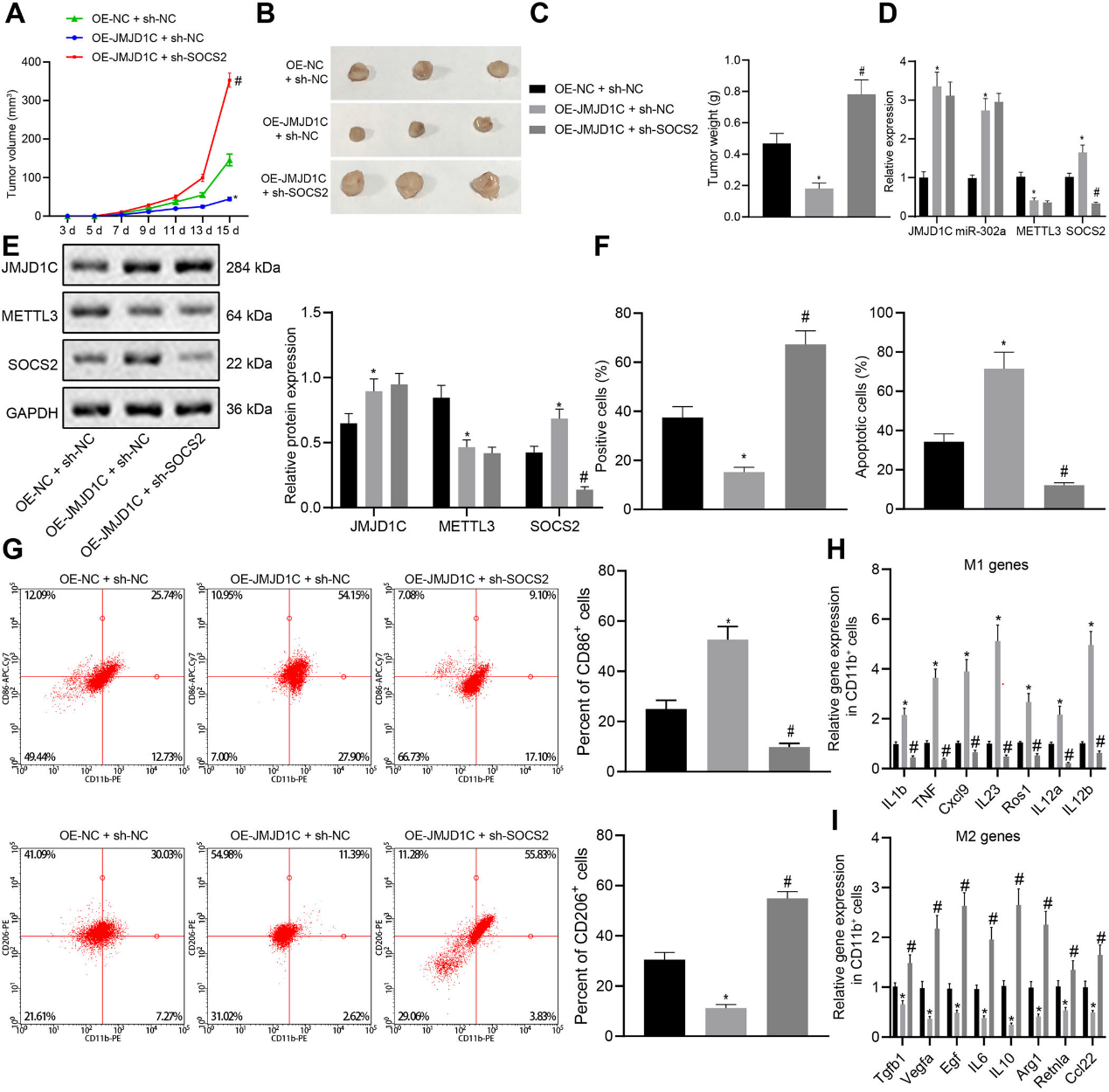
7)JMJD1C通过miR-302a/METTTL3/SOCS2诱导的M1巨噬细胞极化预防胶质瘤
为了验证JMJD1C是否通过miR-302a/METTTL3/SOCS2轴促进M1巨噬细胞的极化从而抑制胶质瘤的发展,我们获得了稳定过表达JMJD1C或与SOCS2沉默共同过表达的LN-229细胞,然后接种裸鼠。JMJD1C过表达抑制了肿瘤的生长,但加入sh-SOCS2治疗后这种作用被逆转(图7A-C)。OE-JMJD1C处理后,JMJD1C、miR-302a和SOCS2表达升高,METTTL3表达降低,而OE-JMJD1C和sh-SOCS2处理后SOCS2水平降低,但JMJD1C、miR-302a和METTTL3表达无统计学变化(图7D,E)。IHC和TUNEL检测显示,OE-JMJD1C处理后,TUNEL阳性细胞增多,ki67阳性细胞减少,而sh-SOCS2进一步处理后,这一趋势被逆转(图7F)。流式细胞术结果显示OE-JMJD1C中CD206+细胞百分率降低,CD86+细胞百分率增加,而sh-SOCS2进一步处理则相反(图7G)。同时,OE-JMJD1C中IL-1β、TNF、CXCL9、IL-23、ROS1、IL-12a和IL-12b上调,而TGFB1、VEGFA、EGF、IL-6、IL-10、ARG1、RETNLA和CCL22下调,而sh-SOCS2的进一步处理消除了这一趋势(图7H,I)。综上所述,JMJD1C通过miR-302a/METTTL3/SOCS2轴促进M1巨噬细胞极化,抑制胶质瘤的发展。
结论:JMJD1C通过上调miR-302a,进一步影响M1巨噬细胞METTL3/SOCS2介导的极化,在胶质瘤中发挥抑瘤作用。未来的研究需要进一步探索JMJD1C作为胶质瘤预后和治疗的生物标志物的可能性。
参考文献:Zhong C, Tao B, Yang F, Xia K, Yang X, Chen L, Peng T, Xia X, Li X, Peng L. Histone demethylase JMJD1C promotes the polarization of M1 macrophages to prevent glioma by upregulating miR-302a. Clin Transl Med. 2021 Sep;11(9):e424. doi: 10.1002/ctm2.424. PMID: 34586733; PMCID: PMC8473479.






