CircMEMO1通过调节启动子甲基化和TCF21的表达,进而控制肝癌进展和索拉非尼治疗敏感性
肝细胞癌(HCC)作为一种常见的恶性肿瘤,肿瘤转移给HCC患者预后带来极大挑战。本研究中,作者筛选出一个CircRNA,即CircMEMO1,阐明了CircMEMO1在HCC转移中的抑制作用以及在索拉非尼治疗敏感性的调节机制。本文于2021年5月发表在《 Molecular Cancer》杂志上,IF=15.302。
结果如下:
1.CircMEMO1 在HCC组织中表达显著下调,与患者预后有关
作者首先将癌旁组织和肝细胞癌患者组织中的差异CircRNA进行统计分析,发现其中28个CircRNA显著上调,18个显著下调,其中CircMEMO1显现出显著差异(Fig. 1a)。为进一步对CircMEMO1进行研究,首先对CircMEMO1进行了扩增(Fig. 1b ),产物通过Sanger测序检测CircMEMO1存在头尾剪接区,RNAse R耐受性检测进一步验证预测的CircMEMO1为 CircRNA。
为确定CircMEMO1是否与肝细胞癌相关,作者研究了CircMEMO1在不同的HCC细胞系中的表达量,发现CircMEMO1在转移细胞系中(MHCC97H,和HCCLM3)的水平低于非转移系(Hep3B, PLC/PRF/5,和Huh7)。进一步研究CircMEMO1在HCC组织中的变化的关系,发现与癌旁样本相比,CircMEMO1在HCC组织样本中明显下调(Fig. 1c),进一步分析CircMEMO1水平与HCC患者预后的关系,发现CircMEMO1在HCC样本中的水平血管侵入有关(Fig. 1d)。生存分析显示,CircMEMO1高水平的HCC患者的总生存(OS)和无病生存期(DFS)明显优于CircMEMO1表达水平低的HCC患者(Fig. 1e,f)。多变量Cox分析显示,HCC组织中的CircMEMO1水平是HCC患者的独立预后因素(Fig.1g)。这些数据表明CircMEMO1水平下调在HCC的发生发展中起重要作用。

Figure 1 CircMEMO1在HCC组织中表达显著下调,且与患者预后相关
2. CircMEMO1在体外和体内均能抑制肝癌细胞株的增殖、迁移和侵袭
为研究CircMEMO1在HCC进展中的生物学功能,CircMEMO1分别通过慢病毒在HCCLM3细胞系中过表达,在Huh-7细胞系中进行敲低处理(Fig. 2a)。细胞增殖、克隆形成和Transwell实验表明,CircMEMO1被敲除后,Huh-7细胞的增殖、克隆生成和迁移能力显著增强;在体外改变CircMEMO1水平, HCCLM3细胞系的增殖、克隆形成、侵袭和迁移能力削弱(Fig. 2b-g)。
为了进一步确定CircMEMO1是否作为肿瘤抑制因子,我们将对照HCCLM3或过表达的CircMEMO1细胞注射到裸鼠中,结果显示,在移植6周后,过表达CircMEMO1的 HCCLM3细胞形成的异种移植瘤明显小于由对照组细胞(Fig. 2h-j)。6只裸鼠中,过表达CircMEMO1的 HCCLM3细胞中只有1个 异种移植小鼠(16.7%)肺中有转移性结节,而对照组6只异种移植小鼠中有5只(83.3%)有肺转移迹象(Fig.2k,l)。因此,推测CircMEMO1在体内和体外均具有抑制肿瘤增殖、侵袭和转移的作用。
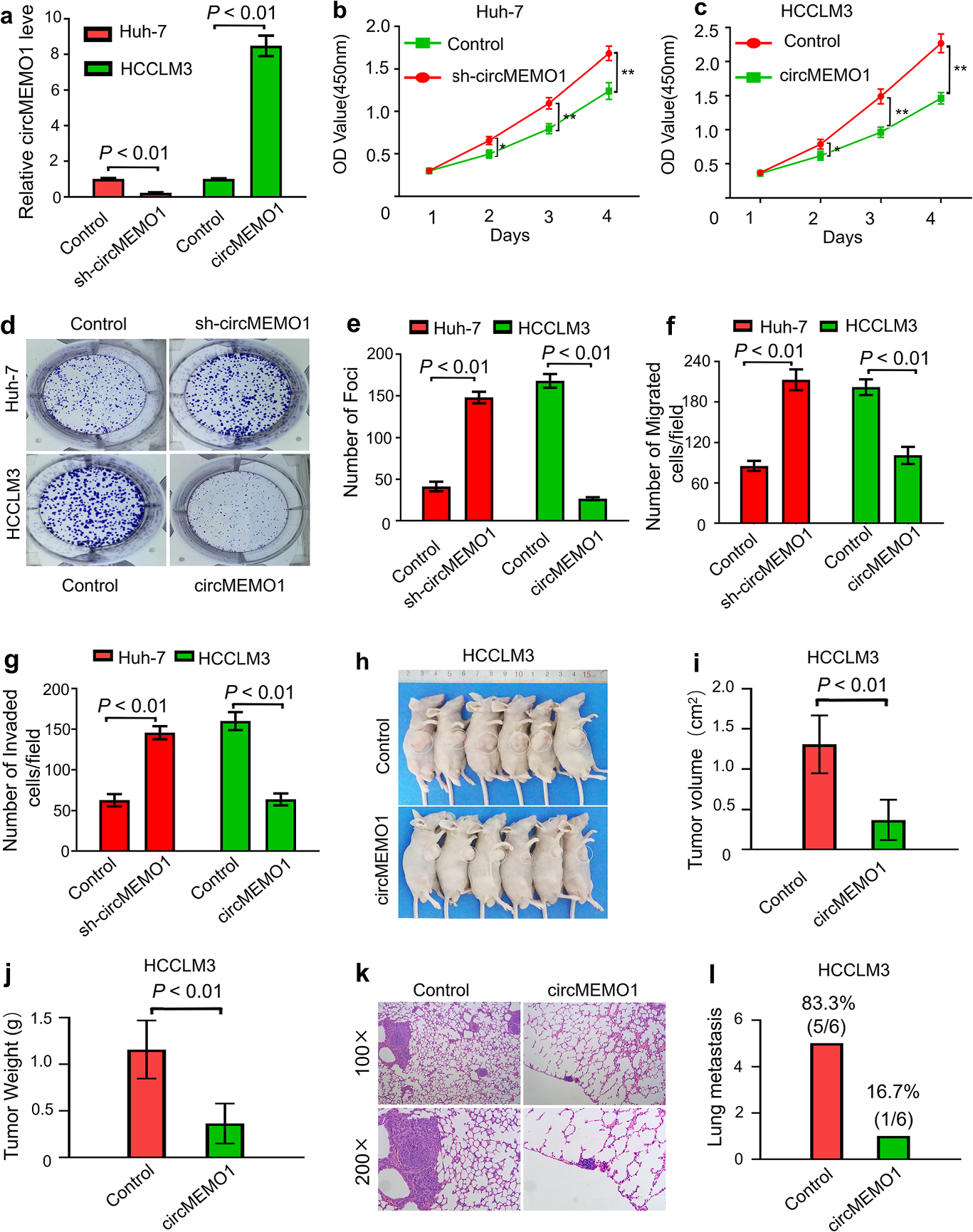
Figure 2 CircMEMO1在体外和体内抑制肝癌细胞增殖和侵袭
3. CircMEMO1通过吞噬HCC细胞中的miR-106b-5p来调节TET/5hmC轴水平
已有研究报道,CircRNA可以作为miRNA海绵。靶基因预测显示miR-106b-5p可能与CircMEMO1存在互作。为了研究CircMEMO1和miR-106b-5p之间的互作,作者设计了一个生物素化的线性CircMEMO1探针。qRT-PCR结果显示,在Huh-7 和HCCLM3 细胞系中,miR-106b-5p均能被CircMEMO1探针吸附。此外,通过 miR-106b-5p来下拉Huh-7 和HCCLM3 细胞系中CircMEMO1,qRT-PCR结果也显示miR-106b-5p能捕获CircMEMO1 (Fig. 3a,b)。
为了进一步阐明CircMEMO1抑制HCC进展的分子机制,作者接下来开始鉴定miR-106b-5p的靶基因。以往的研究表明,TET基因中编码将5位胞嘧啶(5-mC)氧化为5-羟甲基胞嘧啶的关键双加氧酶,TET1和TET2在HCC组织中经常表现出下调表达。通过在线靶基因预测算法,作者发现TET1和TET2是miR-106b-5p的潜在候选靶基因。
为了探讨HCC细胞系中不同miR-106b-5p表达水平对TET1和TET2表达的影响,作者分别在Huh-7细胞系中过表达miR-106b-5p,在HCCLM3 细胞系中对miR-106b-5p进行敲低处理,结果显示,miR-106b-5p在Huh-7细胞系中上调显著抑制TET1和TET2 mRNA和蛋白水平 (Fig. 3d)。荧光素酶报告试验显示野生型荧光活性显著低于对照组(Fig. 3e)。接下来,作者检测了5hmC和5-mC水平的变化来评估miR-106b-5p是否可以通过靶向TET基因和调节5hmC水平来重塑表观遗传。正如所料,Huh-7 / miR -106b-5p-OE细胞的5hmC水平低于hu -7/Control细胞,在HCCLM3细胞系中抑制miR-106b-5p 明显提高了5hmC的水平,但5-mC的水平没有改变(Fig 3f,g)。
CircMEMO1充当miR-106b-5p海绵在HCC细胞中发挥生物学功能,作者进一步检测了不同CircMEMO1水平的HCC细胞中TET1、TET2蛋白表达和gDNA 5hmC水平的变化。结果显示,下调CircMEMO1降低了Huh-7细胞系中TET1和TET2蛋白的表达和gDNA 5hmC的水平,而过表达CircMEMO1则增加了HCCLM3细胞系中TET1和TET2的表达和gDNA 5hmC的水平(Fig 3h,i)。这些数据表明CircMEMO1可以充当miR-106b-5p海绵,调节肝癌细胞的TET/5hmc轴。
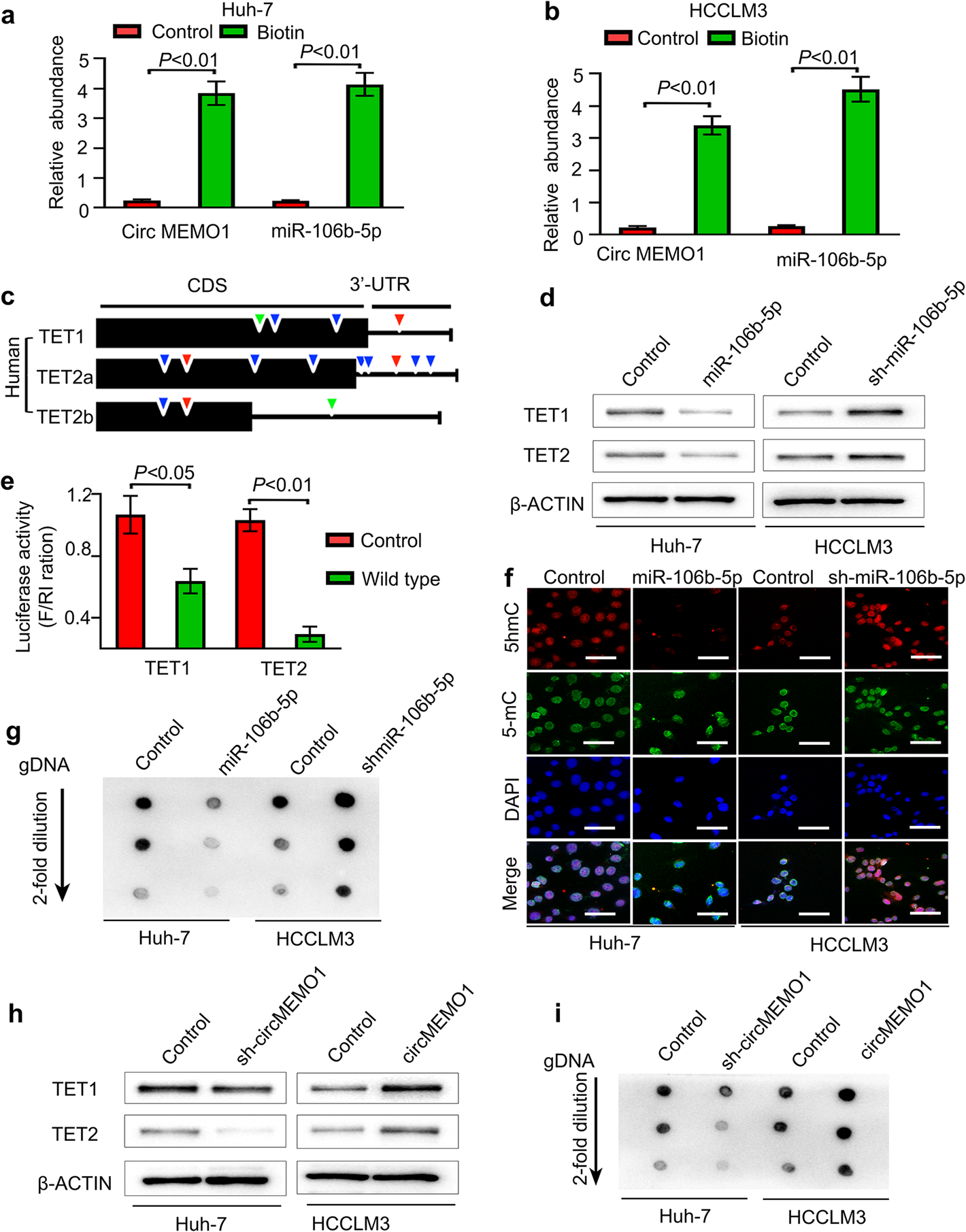
Figure 3 CircMEMO1通过海绵MiR-106b-5p调控HCC细胞中TET1/5hmC轴的水平
4. CircMEMO1水平与miR-106b- 5p/TET1/5hmC轴相关,高水平miR-106b- 5p会促进肝细胞癌进展
通过qRT-PCR分析了CircMEMO1和TET1/2 mRNA水平的相关性,作者观察到CircMEMO1在HCC样本中的表达水平与TET1的mRNA水平直接正相关,而与TET2的mRNA水平无关(Fig 4a, b)。这表明TET1可能在CircMEMO1引起的抑制肝癌的进展。
为了确定TET1蛋白在HCC进展和预测HCC患者预后中的作用,我们进一步通过免疫组化和TMA检测TET1蛋白的表达。结果发现, TET1蛋白水平高的的HCC患者预后比TET1蛋白水平低的HCC患者总生存期更长,复发率更低(Fig 4c,d)。
miR-106b-5p和5hmC作为CircMEMO1调控HCC进展生物学功能的重要中间体,采用原位杂交和免疫组化染色的方法分别检测HCC患者miR-106b-5p和5hmC水平之间的关系。结果显示,HCC细胞系中,miR-106b-5p高表达的在人体内的5hmC水平较低,反之亦然(Fig 4e)。此外,HCC患者中表现出高水平miR-106b-5p和低水平5hmC往往预后较差,且复发率高。这些数据表明CircMEMO1可能通过调节miR-106b-5p/TET1/5hmC轴来影响肝癌中恶性细胞的特性,并促进肝癌的进展。
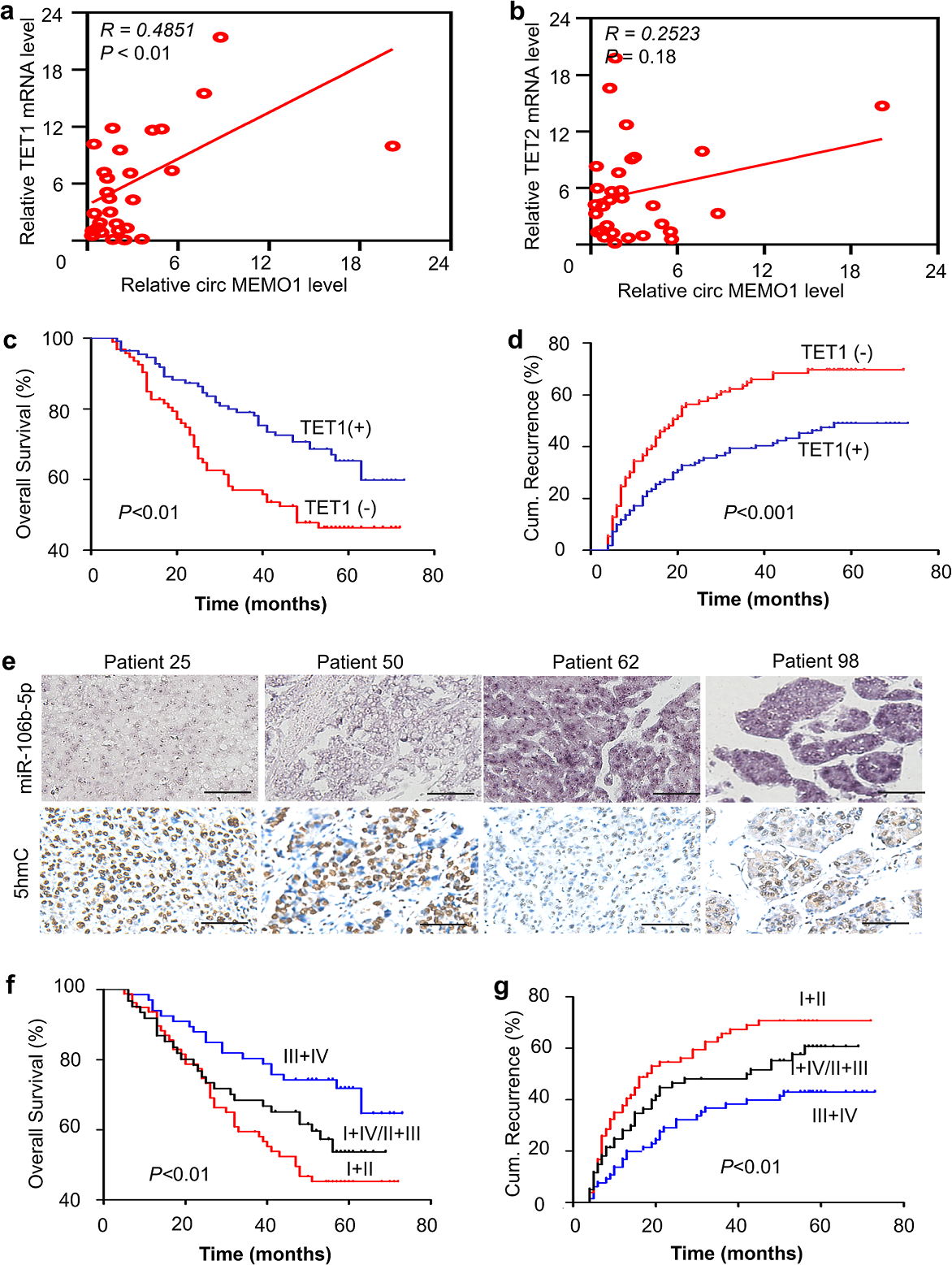
Figure 4 CircMEMO1水平与miR-106b-5p/TET1/5hmC轴相关
5. CircMEMO1通过MiR-106b-5p/TET1/调控EMT过程来抑制HCC转移和干细胞特性
上皮-间质转化(EMT)是癌细胞侵袭和转移的关键过程。在HCC中,miR-106b-5p已被证实通过激活EMT过程促进HCC的迁移和转移。研究发现CircMEMO1可以充当miR-106b-5p海绵,抑制HCC浸润和进展。这些结果提示CircMEMO1可能通过miR-106 b-5p / TET1/5hmC轴调控EMT过程来抑制HCC转移。为了证实该假设,作者研究了HCC细胞中EMT相关分子标记的表达。与相应细胞相比,sh-CircMEMO1 的HCC细胞上皮标记物E-cadherin表达较弱,间质标记物Fibronectin、Vimentin和Snail表达较强。此外,western blotting结果证实,在HCCLM3细胞中上调CircMEMO1的表达降低了间充质标记的表达纤维连接蛋白,波形蛋白和转录因子,但增加了上皮标记Ecadherin (Fig. 5a,b)。EMT过程已知与正常和恶性乳腺干细胞功能相关。我们进一步推测CircMEMO1可能也有抑制肝癌细胞的干性。值得注意的是,下调CircMEMO1的表达可以增加Huh-7细胞形成肿瘤球结构的能力,而过表达CircMEMO1则降低HCCLM3细胞形成肿瘤球结构的能力(Fig. 5c)。由于CircMEMO1在人类HCC样本中与TET1 mRNA水平直接正相关,我们进一步试图验证TET1/ 5hmc轴是否在CircMEMO1或miR-106b-5p的功能中发挥直接作用。首先,TET1异位表达hu -7/sh-CircMEMO1或hu -7 miR-106b-5p-OE细胞,然后分析这些细胞的侵袭能力。我们发现,外源性表达TET1蛋白显著降低了sh-CircMEMO1或miR-106b-5p过表达介导的增强的癌细胞侵袭(Fig.5d)。
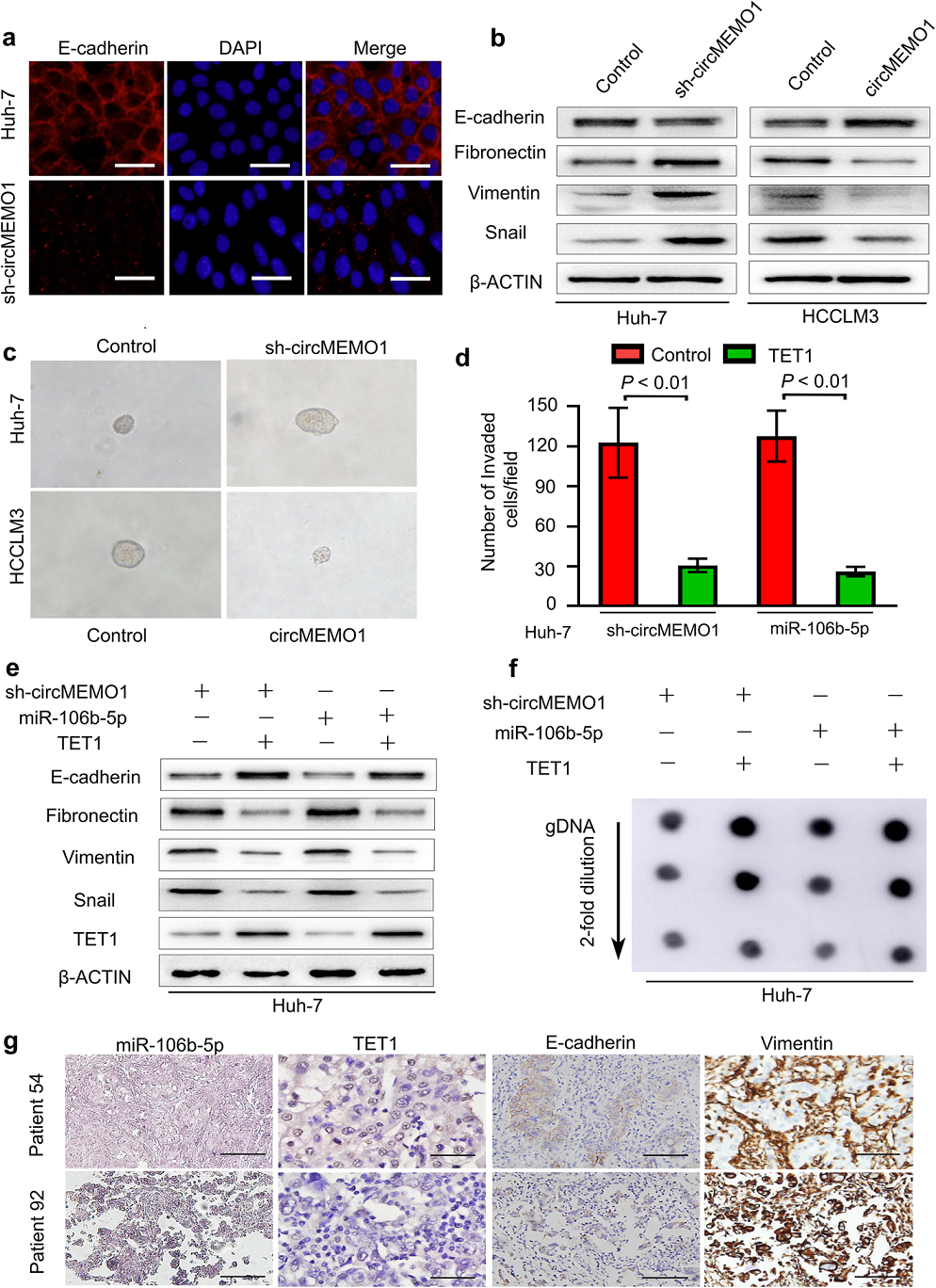
Figure 5 CircMEMO1通过miR-106b-5p/TET1/5hmC轴调控EMT过程抑制HCC进展
6.CircMEMO1通过调节DNA去甲基化与TCF21的表达
作者假设CircMEMO1和miR-106b-5p可能调节TCF21基因启动子的去甲基化并调节其表达,导致其同源靶点的变化。为了探索这种可能性,首先分析了TCGA数据库HCC样本中TCF21和miR-106b-5p/CDH1水平的关系。我们的结果显示,TCF21 mRNA水平与miR-106b-5p水平呈负相关,而与CDH1水平呈正相关(Fig. 6a,b)。此外,与正常组织相比,在包括HCC在内的一系列癌症中,TCF21 mRNA水平下调(Fig. 6c),HCC患者样品中TCF21基因启动子甲基化水平明显高于对照组(Fig. 6d,e)。因此,TCF21可能是一种重要的肿瘤抑制因子,在HCC样本中由于基因启动子甲基化异常而下调。我们进一步检测了不同CircMEMO1或miR-106b-5p水平的HCC细胞中TCF21的表达,发现CircMEMO1可以促进肝癌细胞中TCF21的mRNA和蛋白表达,而miR-106b-5p可以抑制TCF21的表达(Fig. 6f, g)。hMeDIP-qPCR检测结果显示,在不同CircMEMO1水平下,TCF21表现出不同的5hmC水平(Fig.6h)。更重要的是,TCF21过表达通过抑制CircMEMO1或激活miR-106b-5p降低了转移和EMT过程(Fig.6i, j)。这些结果表明CircMEMO1通过调控DNA启动子去甲基化和TCF21的表达进而抑制肝癌进展作用。

Figure 6 CircMEMO1通过调节DNA去甲基化和TCF21表达抑制肝癌进展
7. 在HCC细胞中,CircMEMO1的水平调节抗肿瘤活性
索拉非尼作为晚期HCC患者标准治疗方法,但耐药性使其临床疗效有限。研究报道HCC进展中的EMT特性可能导致索拉非尼耐药,因此作者推测,肝癌细胞中的CircMEMO1可能影响索拉非尼治疗的敏感性。为了验证这种假设,作者首先评估了索拉非尼治疗后肝癌患者TCF21水平及与预后的关系。TGCA分析显示,TCF21水平与索拉非尼治疗后的HCC患者的总生存期相关 (Fig.7a)。然后,分析了40例接受索拉非尼和进行了肝切除术的晚期肝癌复发患者的回顾性数据,结果也表明TCF21水平与患者预后相关(Fig. 7b)。
随后,作者检测了CircMEMO1水平对的肿瘤生长和迁移能力变化的影响。索拉非尼在体外治疗HCC细胞。MTT结果显示,下调CircMEMO1表达可减弱10 mmol/L索拉非尼在HCC细胞中诱导的生长抑制作用,而过表达CircMEMO1可增强索拉非尼诱导的生长抑制作用(Fig.7c)。Matrigel分析表明,与对照Huh-7细胞相比,低CircMEMO1水平的Huh-7细胞具有更强的迁移能力,而CircMEMO1在HCCLM3细胞中过表达的结果则相反(Fig. 7d)。为了进一步确定CircMEMO1在调节索拉非尼治疗敏感性中的作用,我们在上述40例晚期复发性肝细胞癌患者中的组织样本中检测了CircMEMO1和miR-106b-5p的水平,Kaplan-Meier生存分析显示,低水平CircMEMO1组的总生存期远低于高水平CircMEMO1组,而低水平的miR-106b-5p组的总生存期远高于高水平miR-106b-5p组。因此,推断CircMEMO1及其下游靶点miR-106b-5p可调节索拉非尼治疗过程中的敏感性。
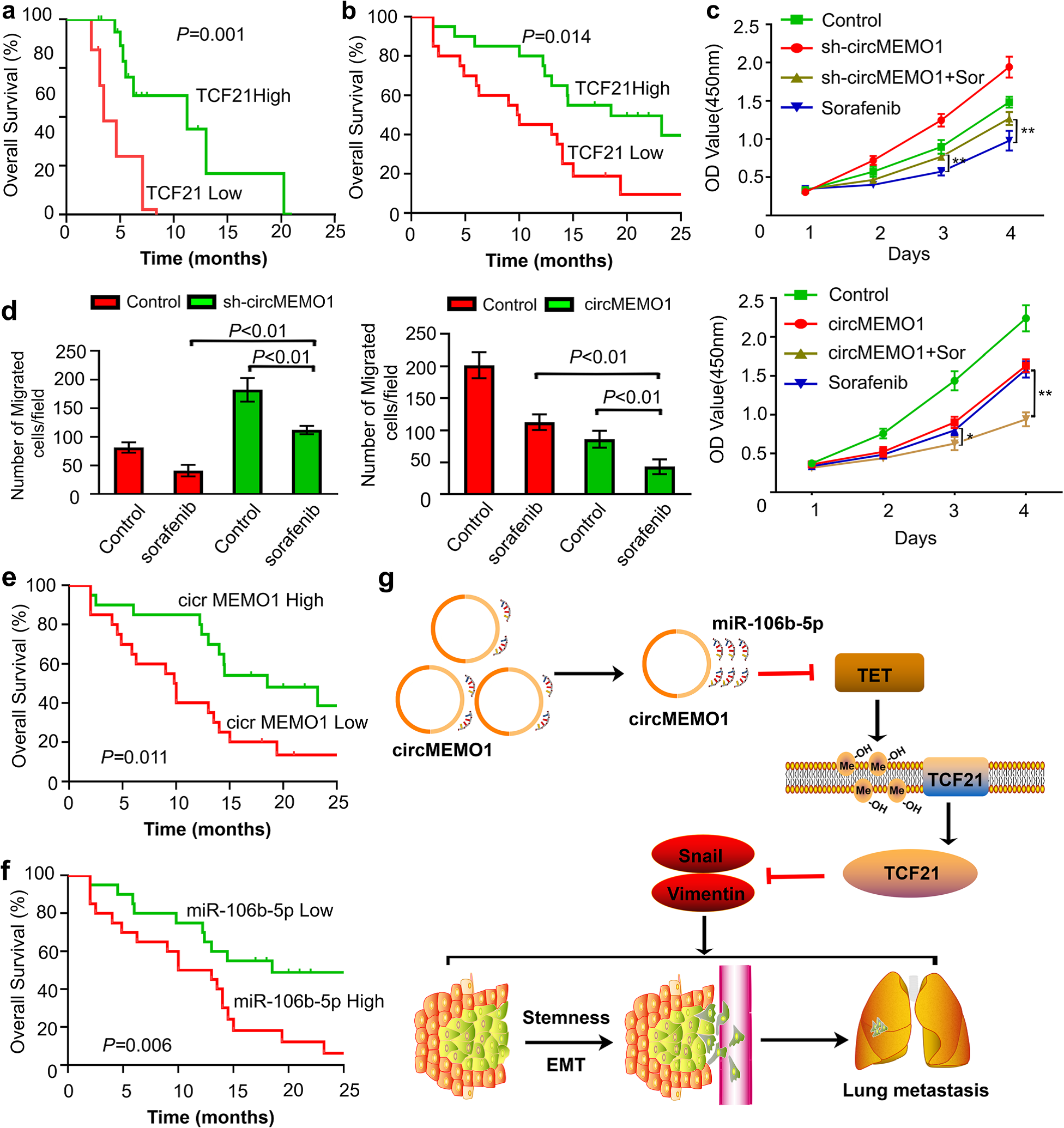
Figure 7 CircMEMO1调控索拉非尼治疗肝癌细胞的抗肿瘤活性
circMEMO1是HCC转移和细胞干性中是一个关键的肿瘤抑制因子,它通过miR-106b-5p/TET1/5hmC/TCF21轴和EMT过程发挥作用。circMEMO1作为一种关键的表观遗传修饰物,也可以调节肝癌对索拉非尼治疗的敏感性。
参考文献:
Dong, Z.R., et al., CircMEMO1 modulates the promoter methylation and expression of TCF21 to regulate hepatocellular carcinoma progression and sorafenib treatment sensitivity. Mol Cancer, 2021. 20(1): p. 75.






