CircMAPK14编码多肽——抑制肿瘤
众所周知,MAPK信号通路和肿瘤进展密切相关,其中MAPK14是该通路上调控结直肠癌(CRC)进展的重要分子模块。近来,也有不少研究表明circRNA可以编码多肽,但是circMAPK14是否具有翻译功能又在CRC中扮演何种作用仍然未知。本研究对此进行了探讨,发现CircMAPK14是一个可编码的肿瘤抑制因子。本文于2021年10月发表在《Clinical and Translational Medicine》IF:11.492期刊上。
技术路线:

主要结果:
作者首先从circRNADb数据库中筛选到了4个来源于MAPK14分子的circRNAs,结果发现只有(hsa_circ_24603在72对CRC组织中显著上调,将其命名为circMAPK14,其低表达与CRC肿瘤不良预后相关,且在多个CRC细胞系中显著下调表达。研究显示circMAPK14来源与MAPK14的外显子4至10的片段背向剪切而成,全长536nt,并主要定位在细胞质中。
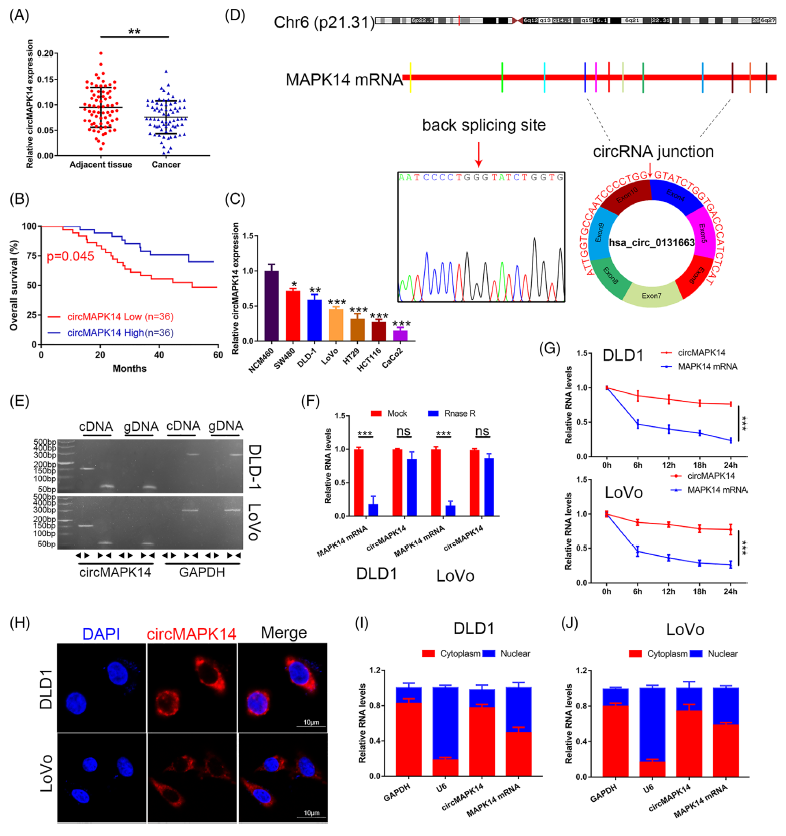
图1 CRC组织和细胞系中circMAPK14的鉴定和特征
2、circMAPK14抑制CRC的增殖和迁移
接下来作者研究了circMAPK14的生物学功能,如图2,结果显示过表达circMAPK14会显著抑制CRC细胞系的增殖,集落形成,迁移和侵袭,同时促进癌细胞凋亡。
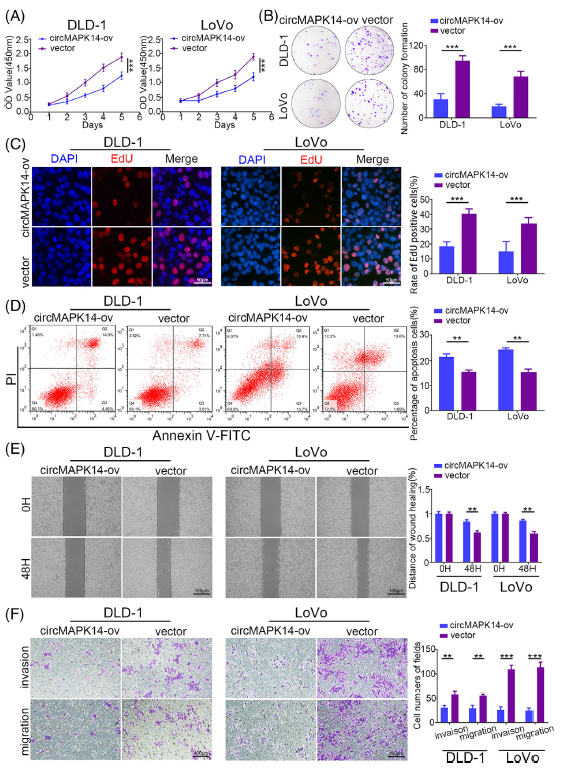
图2 CircMAPK14抑制CRC细胞的增殖和迁移
3、circMAPK14在CRC中编码一种新蛋白
基于上述circRNADb数据库分析,作者发现circMAPK14包含一个开放阅读框和一个IRES序列,可能编码一个175个氨基酸的蛋白(命名为circMAPK14-175aa),如图3A所示。随后为验证其编码蛋白的活性,将IRES的两个不同区域突变掉(图3B),发现IRES突变体1显著降低了荧光素酶活性,但突变体2没有影响(图3C)。circMAPK14-175aa多肽序列包含一段MAPK14的同源片段,该片段包含一个特殊的C末端‘Gly Ile Trp’(GIW)序列,并且作者发现了一种针对MAPK14中间段的抗体(aa 150-250),它能同时识别MAPK14和circMAPK14-175aa。随后作者进一步探究了circMAPK14-175aa的IRES活性,发现circMAPK14编码175 aa蛋白,分子量为20 kDa,由IRES序列在核苷酸288-427处驱动(图3E)。之后将circMAPK14过表达载体和IRES突变体1载体同时转染至CRC细胞,银染和LC-MS/MS结果显示一个特殊序列,FANVFIGANPLGIW,它包含一段C末端有GIW的氨基酸序列,这和前面的研究结果一致,且同样的结果在WB中也发现了(图3F-H)。在CRC细胞系和组织中, 这175aa的表达水平都显著低于对照组,而过表达或敲除这175aa,都不能改变MAPK14的蛋白水平(图3I-J)。这些结果表明这175个氨基酸是由circMAPK14编码而来。

图3 CircMAPK14编码175个氨基酸的新蛋白质,称为circMAPK14 -175aa
4、circMAPK14抑制CRC细胞的恶性表型是通过circMAPK14 -175aa
为了进一步评估circMAPK14在CRC中生物学功能是否通过编码蛋白,作者将以下载体转染至两株CRC细胞系中:circMAPK14-ov,circMAPK14 ATG mut,circMAPK14 IRES mut,线性化的175aa-ov,和circMAPK14-sh#1。上述载体都没有影响MAPK14的表达。结果如图4所示,circMAPK14-ov和线性化的175aa-ov都能显著抑制CRC细胞的生物学功能,但是和circMAPK14-ov组相比,circMAPK14 ATG mut,circMAPK14 IRES mut的生物学功能没有显著回复,表明circMAPK14抑制CRC细胞的恶性表型是通过circMAPK14 -175aa。

图4 CircMAPK14体外通过175aa抑制CRC恶性表型
5、circMAPK14缓解肿瘤生成和转移是通过circMAPK14 -175aa
之后作者进一步在体内探究了circMAPK14 -175aa多肽是否具有生物活性。这里是将circMAPK14-ov和线性化的175aa-ov的细胞系接种至小鼠,结果如图5所示,这两种方式都能显著抑制小鼠的肿瘤体积和重量,以及肺转移和肝脏转移。表明circMAPK14编码的多肽175aa-ov承载了缓解肿瘤生长的生物学功能。
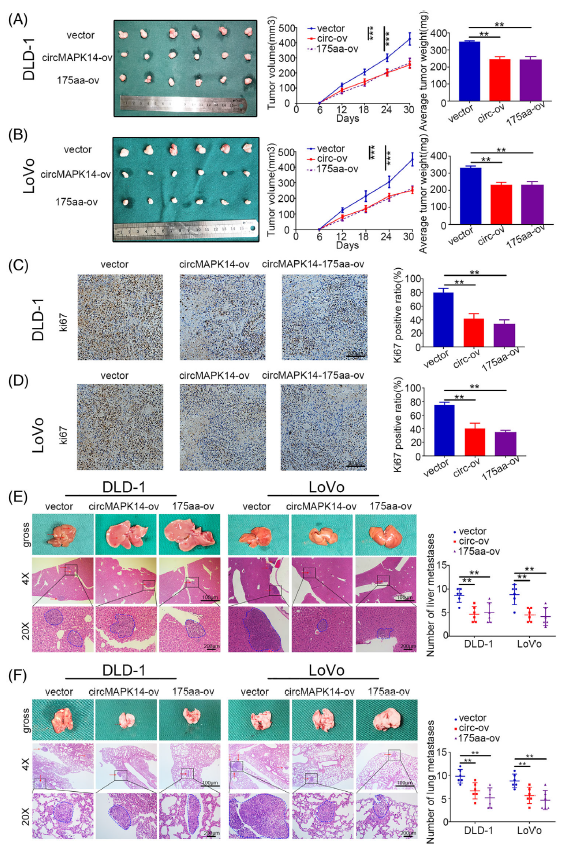
图5 CircMAPK14在体内通过175aa降低CRC的致瘤性和转移
6、circMAPK14-175aa抑制MAPK14的磷酸化通过竞争性结合MKK6
为了探究circMAPK14 -175aa调控的潜在机制,作者将Flag-tagged circMAPK14 -175aa转染至HEK193T细胞,进行免疫沉淀(IP)实验。作者通过IP裂解物的MS结果鉴定到MKK6蛋白可能与circMAPK14-175aa结合。Flag标记的circMAPK14-175aa可以和MKK6相互作用,并具有细胞质共定位(图6A-C)。此前有研究表明激活上游激酶MKK6可以磷酸化MAPK14,当MAPK14被磷酸化,它就会被转移至细胞核从而阻断FOXC1的降解。由于circMAPK14-175aa和MAPK14共享序列包含其磷酸化识别位点,所以作者猜测circMAPK14-175aa可能可以结合MKK6。因此,进行了co-IP实验,结果显示上调circMAPK14增加了circMAPK14-175aa和MKK6的绑定程度,但是降低了MAPK14和MKK6之间的结合(图6D)。这些结果表明circMAPK14-175aa通过竞争性结合MKK6来抑制MAPK14的磷酸化。
随后,作者进一步证实改变circMAPK14表达后FOXC1的mRNA和蛋白表达水平,如预期地,FOXC1的蛋白水平随着circMAPK14表达的改变而改变,但是mRNA水平不受影响(图6E-F)。作者用蛋白合成抑制剂CHX处理CRC细胞,发现circMAPK14促进FOXC1蛋白的降解,缩短其半周期(图6G)。为了确定降低circMAPK14的表达是否通过抑制泛素化来维持FOXC1蛋白的稳定性,将Myc-FOXC1和HAUb共转染到稳定转染circMAPK14的CRC细胞中,研究发现,过表达circMAPK14可增强FOXC11的泛素化(图6I)。FOXC1的下游靶基因也发生了相应的变化,包括SOX4、SOX13和MMP10(图6J)。总的来说,这些数据表明,circMAPK14编码的circMAPK14-175aa通过抑制MAPK14核易位促进FOXC1降解,而不是直接与FOXC1结合。
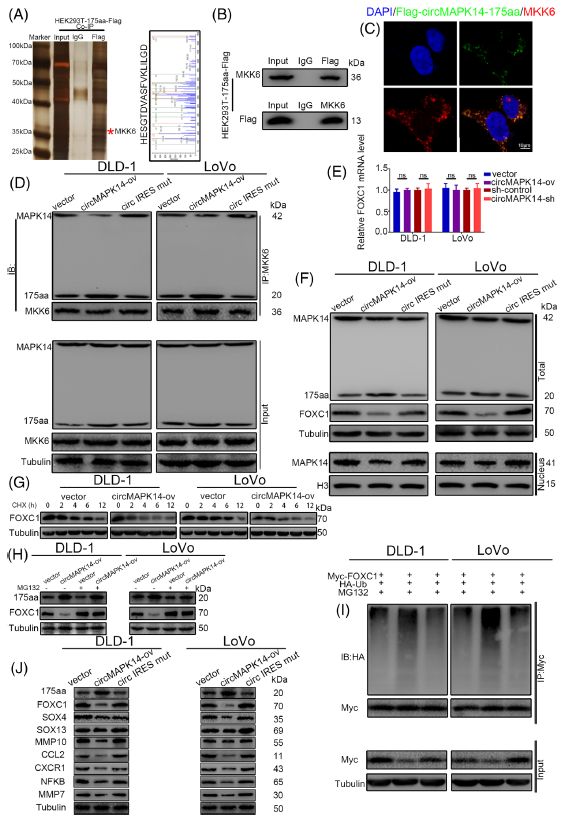
图6 CircMAPK14-175aa通过与MKK6竞争抑制MAPK14的磷酸化,随后通过泛素化促进FOXC1的降解
总之,本研究表明circMAPK14- 175aa由circMAPK14编码,依赖于其ORF和IRES序列。circMAPK14- 175aa通过与MKK6竞争性结合抑制MAPK14的磷酸化,从而抑制MAPK14的核转位。此外,circMAPK14-175aa加速了泛素介导的FOXC1降解,抑制了CRC的进展和转移。此外,CRC中FOXC1升高是circMAPK14-175aa表达减少所致。反过来,这通过抑制U2AF2的转录降低了circMAPK14的循环效率,形成了一个正反馈回路来调节CRC中的circMAPK14(图7)。
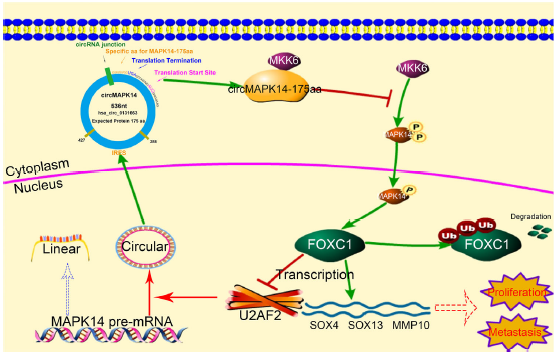
图7 circMAPK14编码的circMAPK14-175aa与MKK6竞争抑制CRC的致瘤性和转移的机制图
参考文献:
Wang, L, Zhou, J, Zhang, C, et al. A novel tumour suppressor protein encoded by circMAPK14 inhibits progression and metastasis of colorectal cancer by competitively binding to MKK6. Clin Transl Med. 2021; 11:e613. https://doi-org.washington.80599.net/10.1002/ctm2.613






