lncRNA MELTF-AS1-骨肉瘤转移的靶点
骨肉瘤是一种高度侵袭性的癌症,常见于儿童和青少年。对于转移性或复发性骨肉瘤仍然缺乏有效的治疗方法。lncRNA在骨肉瘤中的作用逐渐引起人们的关注。在这里,我们通过分析骨肉瘤组织的测序数据,识别出转移性骨肉瘤中异常表达的lncRNA,并选择上调的lncRNA MELTF-AS1进行详细研究。qRT-PCR分析显示MELTF-AS1在骨肉瘤组织和细胞中表达增高,MELTF-AS1高表达提示骨肉瘤患者预后不良。MELTFAS1在骨肉瘤中的高表达部分是由于RREB1的转录激活。transwell实验、划痕创面愈合实验和尾静脉注射肺转移模型结果表明,敲除MELTF-AS1可抑制骨肉瘤细胞的转移能力。此外,RNA下拉实验、荧光素酶报告基因实验和RNA免疫沉淀(RIP)实验结果显示MELTF-AS1可以通过与miR-485-5p的相互作用调控MMP14的表达。我们的研究表明MELTF-AS1通过上调MMP14在骨肉瘤中起促转移基因的作用,可能成为骨肉瘤治疗和诊断的潜在靶点。本文于2021年8月发表在“MOLECULAR THERAPY-NUCLEIC ACIDS”(IF:8.886)期刊上。
技术路线

结果
1)MELTF-AS1在骨肉瘤中上调,并与骨肉瘤的远处转移有关
通过分析TARGET数据库中骨肉瘤组织的转录组数据,我们首先发现了在伴有远处转移的骨肉瘤组织中异常表达的lncRNA(图1A)。qRT-PCR结果显示,与正常组织相比,MELTF-AS1在骨肉瘤组织中的表达显著升高。此外,与测序结果一致的是,有远处转移的骨肉瘤组织中MELTF-AS1的表达水平显著高于无转移的骨肉瘤组织(图1B和1C)。MELTF-AS1高表达的骨肉瘤患者预后较差(图1D)。细胞的qRT-PCR分析显示MELTF-AS1在骨肉瘤细胞(SaoS-2、143B、MG63、U2-OS、HOS、NIH 3T3)中的表达明显高于成骨细胞hFoB1.19。此外,MELTF-AS1在两种尤文氏肉瘤细胞系(a -673和Hs863.T)中的表达水平并不明显高于hFoB1.19,说明MELTF-AS1可能仅在骨肉瘤中发挥特定作用(图1E)。

2)RREB1激活骨肉瘤中MELTF-AS1的转录
我们探讨了骨肉瘤中MELTF-AS1表达升高的原因。我们使用JASPAR数据库预测可能结合到MELTF-AS1启动子区域的转录因子。在这些候选转录因子中,RREB1得分较高。沉默RREB1后,骨肉瘤细胞中MELTF-AS1的表达水平显著降低(图2A),过表达RREB1后,MELTF-AS1的表达水平显著升高(图2B)。此外,PCR检测结果显示,RREB1在骨肉瘤组织中明显升高,且在有远端转移的骨肉瘤组织中表达水平高于无转移的骨肉瘤组织(图2C)。免疫组化(IHC)检测结果显示,骨肉瘤组织中RREB1蛋白水平的变化趋势与RNA水平一致(图2D)。此外,利用该RREB1抗体进行ChIP实验,发现该抗体可以直接结合MELTF-AS1的启动子区域(图2E)。当RREB1过表达时,荧光素酶的相对活性显著升高,但在启动子中RREB1的结合区域被删除后,过表达RREB1并不引起荧光素酶活性的变化(图2F)。

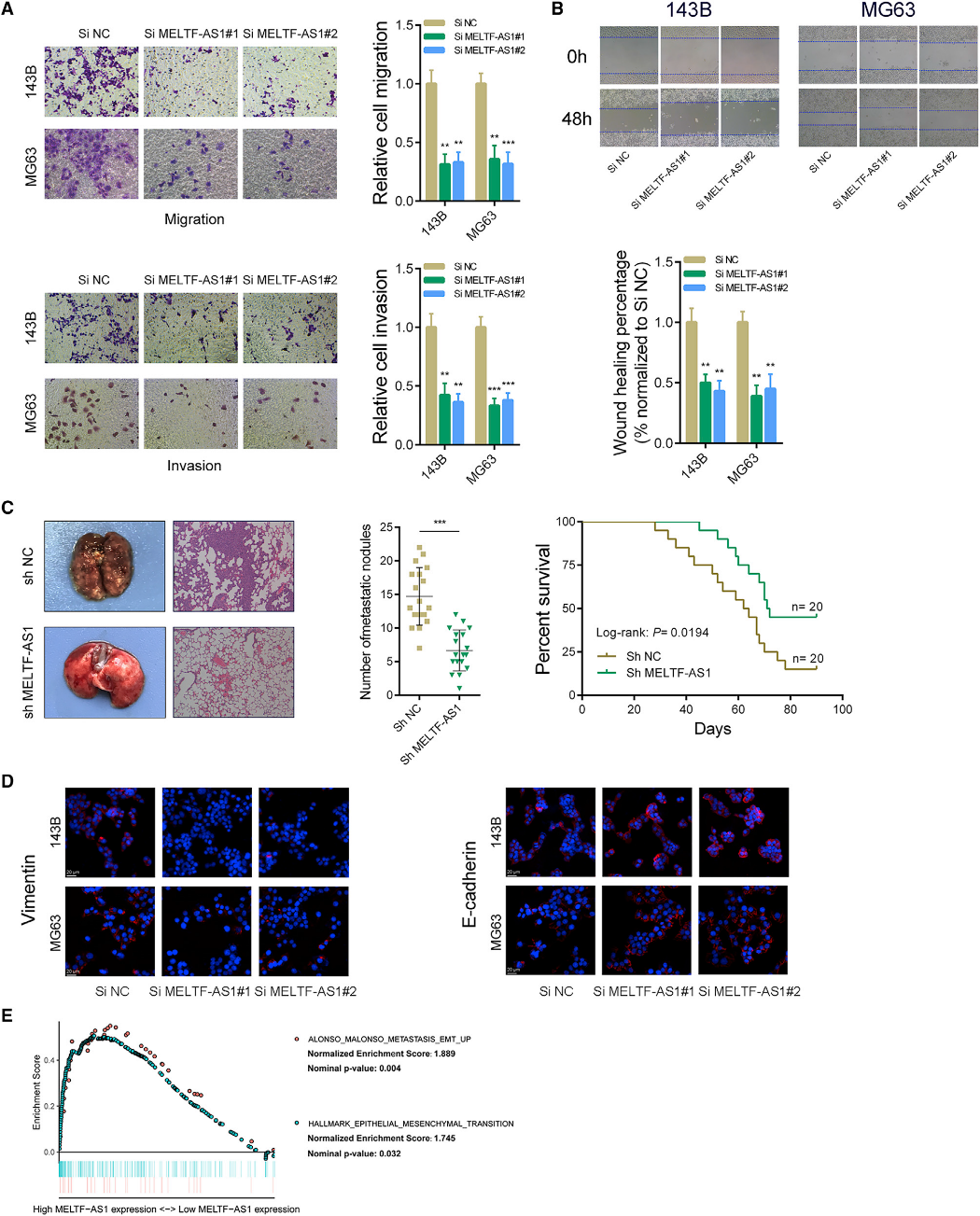
3)MELTF-AS1促进骨肉瘤细胞在体内和体外的转移
Transwell实验显示,敲除MELTF-AS1后,骨肉瘤细胞的迁移和侵袭能力显著降低(图3A)。划痕创面愈合实验结果也显示,MELTF-AS1沉默后,骨肉瘤细胞的迁移能力显著下降(图3B)。静脉注射肺转移模型的结果表明,抑制MELTF-AS1后,骨肉瘤细胞的体内转移能力减弱。如图3C(左图)所示,MELTF-AS1沉默组(sh MELTF-AS1)骨肉瘤细胞形成的肺转移结节数量明显减少。sh MELTF-AS1组小鼠的生存时间也比对照组长(图3C,右图)。免疫荧光检测显示,沉默骨肉瘤细胞中MELTF-AS1后,Vimentin蛋白水平降低,E-cadherin蛋白水平升高(图3D)。波形蛋白高度扩张,与转移增加呈正相关。E-Cadherin在上皮细胞中高表达,与减少转移有关。基因集富集分析(GSEA)显示MELTF-AS1在骨肉瘤组织中的高表达与ALONSO_METASTASIS_EMT_UP和HALLMARK_EPITHELIAL_MESENCHYMAL_TRANSITION基因集相关(图3E)。以上结果表明MELTF-AS1在体内外均能促进骨肉瘤细胞的转移,并影响骨肉瘤的转移相关途径。
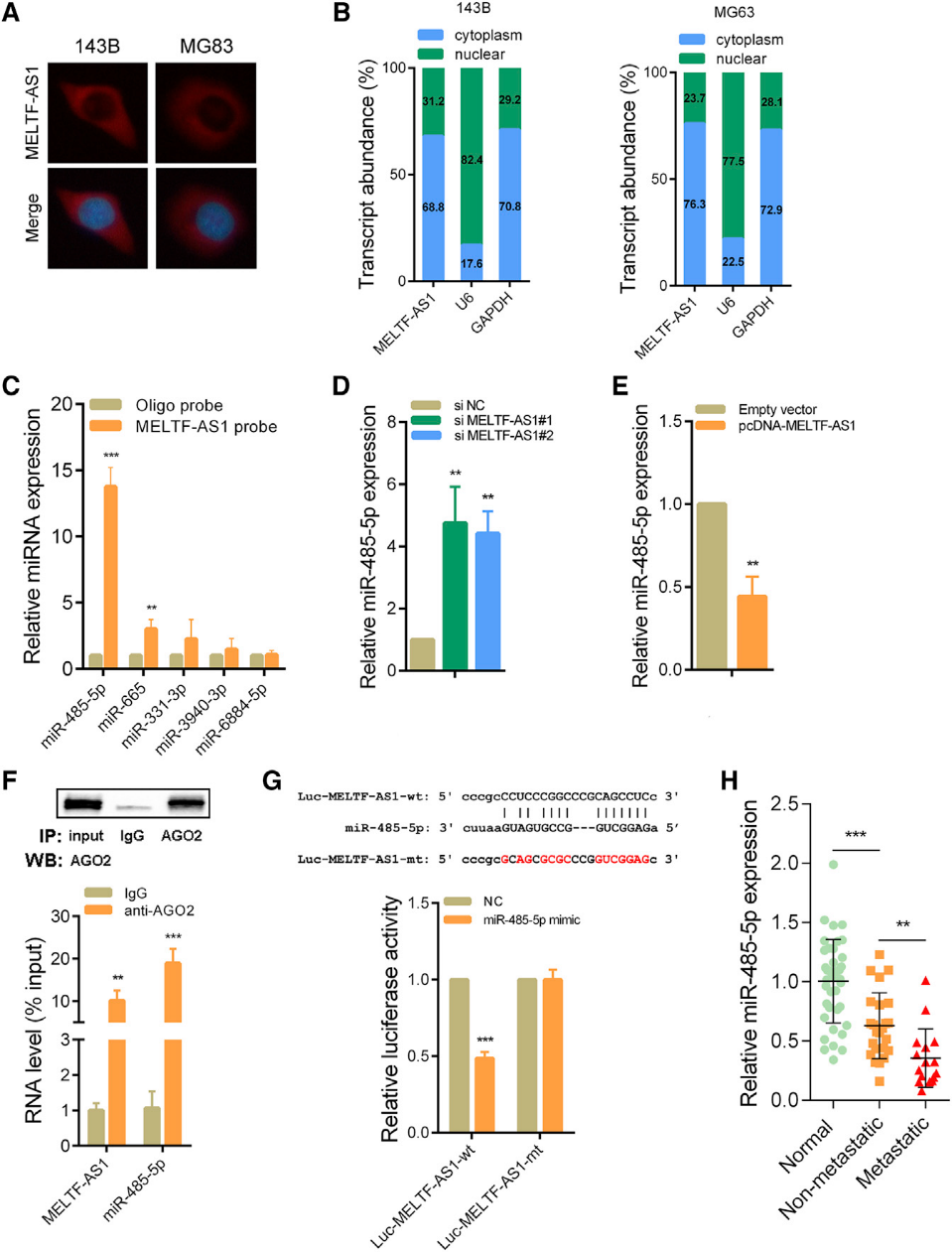
4)MELTF-AS1在骨肉瘤中作为miR-485-5p的ceRNA
荧光素原位杂交(FISH)检测显示MELTF-AS1主要分布于骨肉瘤细胞的细胞质中(图4A)。亚细胞分离的qRT-PCR分析也显示MELTF-AS1主要位于细胞质中(图4B)。考虑到细胞质中的lncRNA可以作为ceRNA,我们使用ENCORI数据库预测microRNA与MELTF-AS1的潜在结合。接下来,我们用生物素标记的MELTF-AS1探针进行RNA下拉实验,验证哪些microRNA可以与MELTF-AS1结合。如图4C所示,miR485-5p和miR-665可以直接与MELTF-AS1结合。由于miR-485-5p与MELTF-AS1的结合丰度较高,我们选择其作为进一步研究的对象。在143B细胞中MELTF-AS1沉默后miR-485-5p表达显著增加(图4D)。相反,当MELTF-AS1过表达时,miR-485-5p的表达显著降低(图4E)。RNA免疫沉淀实验结果显示MELTF-AS1和miR-485-5p均可直接结合Argonaute 2 (AGO2)蛋白(图4F)。我们基于MELTF-AS1和miR-485-5p的结合位点构建了双荧光素酶报告基因。实验结果表明,过表达miR-485-5p可显著降低荧光素酶活性。然而,如果MELTF-AS1和miR-485-5p的结合位点发生突变,过表达miR-485-5p对荧光素酶活性几乎没有影响(图4G)。骨肉瘤组织的qRT-PCR分析显示,miR-485-5p在骨肉瘤中表达降低,在伴有远处转移的骨肉瘤组织中miR-485-5p表达降低(图4H)。
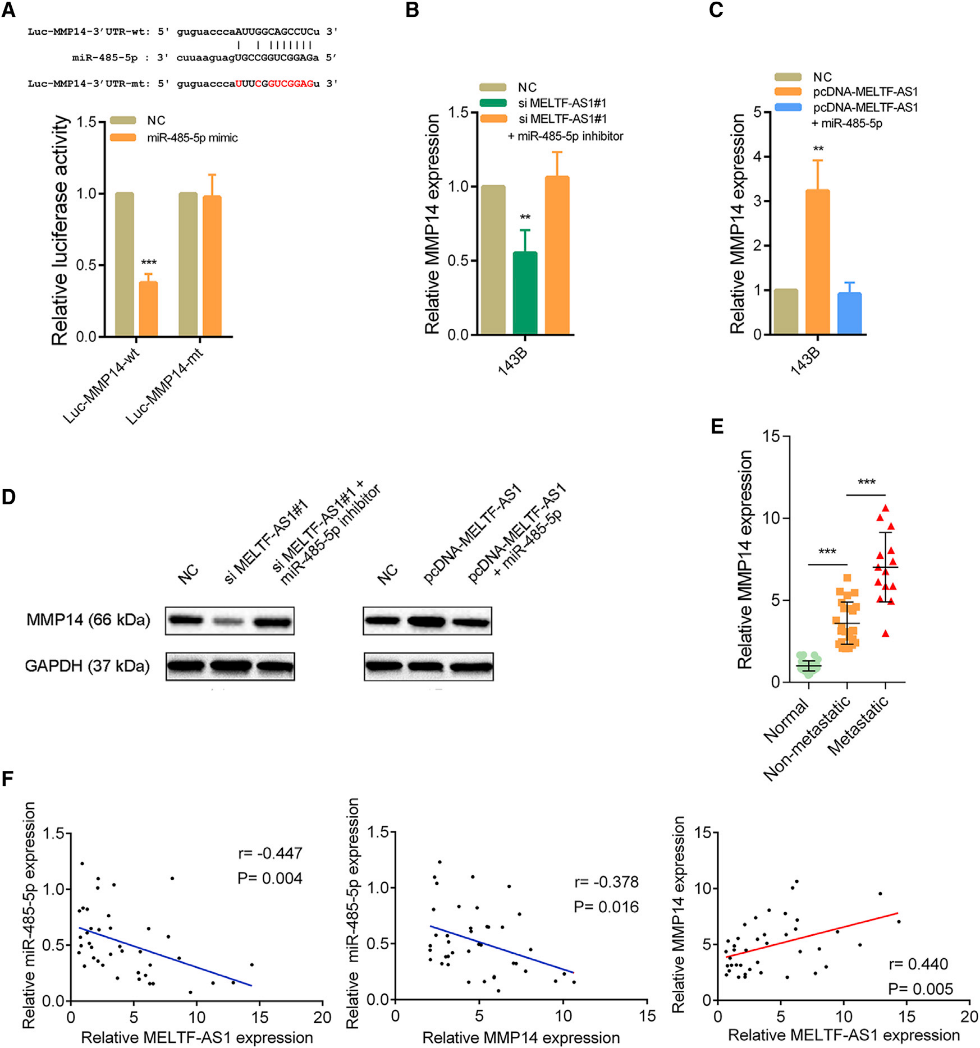
5)MELTF-AS1通过与miR-485-5p的相互作用调控MMP14的表达
我们使用生物信息学工具预测miR-4855p的靶基因,结果显示转移相关蛋白MMP14是miR-485-5p的一个潜在靶点。荧光素酶报告基因检测结果显示,miR-485-5p可直接与MMP14的3’UTR结合,导致荧光素酶活性降低。当结合位点发生突变时,miR-485-5p对荧光素酶活性没有影响(图5A)。qRT-PCR结果显示,骨肉瘤细胞中MELTF-AS1沉默后,MMP14的RNA水平下降,同时沉默MELTF-AS1并转染miR485-5p抑制剂后,下降的MMP14又恢复到正常水平(图5B)。此外,骨肉瘤细胞中过表达MELTFAS1可导致MMP14表达增加,但如果过表达MELTF-AS1同时过表达miR-485-5p,则MMP14表达减弱(图5C)。western blot结果显示,蛋白水平的变化与RNA水平的变化一致(图5D)。骨肉瘤组织中MMP14的RNA水平升高,且在远处转移的骨肉瘤组织中MMP14的水平高于未转移的骨肉瘤组织(图5E)。骨肉瘤组织中相关分析显示miR485-5p的表达与MELTF-AS1和MMP14的表达呈负相关,而MELTF-AS1的表达与MMP14的表达呈正相关(图5F)。综上所述,MELTF-AS1吸附细胞质中的miR-485-5p,作为ceRNA促进MMP14表达。
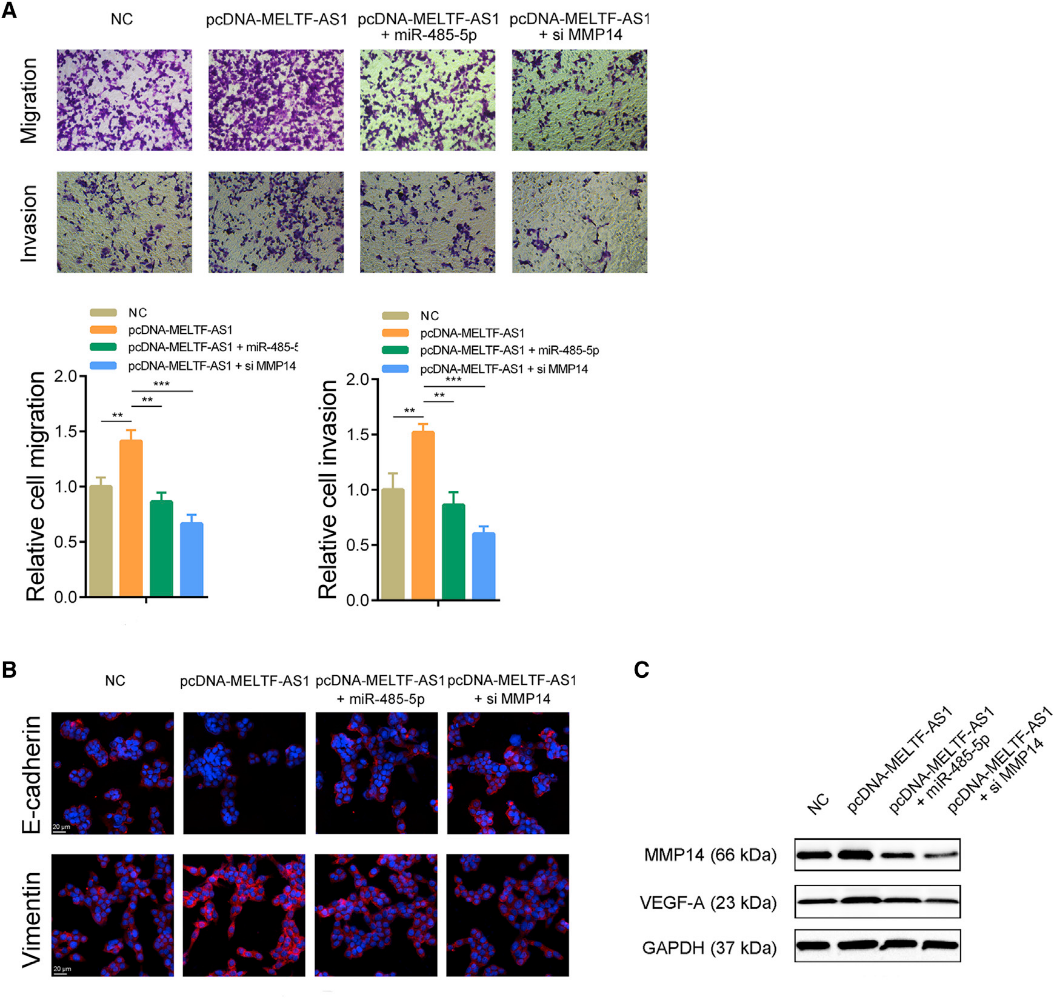
6)MELTF-AS1通过调节MMP14促进骨肉瘤转移
transwell实验结果显示,过表达MELTF-AS1可提高骨肉瘤细胞的迁移和侵袭能力。过表达MELTF-AS1,而过表达miR-485-5p或抑制MMP14,削弱了MELTF-AS1过表达引起的转移能力的增加(图6A)。免疫荧光分析显示,过表达MELTF-AS1增加了Vimentin的表达,降低了E-cadherin的表达,共转染miR-485-5p或MMP14 siRNA消除了MELTF-AS1引起的变化(图6B)。western blot显示MELTF-AS1过表达促进了MMP14下游靶点VEGF-A的表达。同样,过表达miR-485-5p或抑制MMP14可减弱MELTF-AS1诱导的VEGF-A升高(图6C)。上述结果表明MELTF-AS1通过调控MMP14影响转移相关通路和蛋白,促进骨肉瘤细胞转移(图7)。
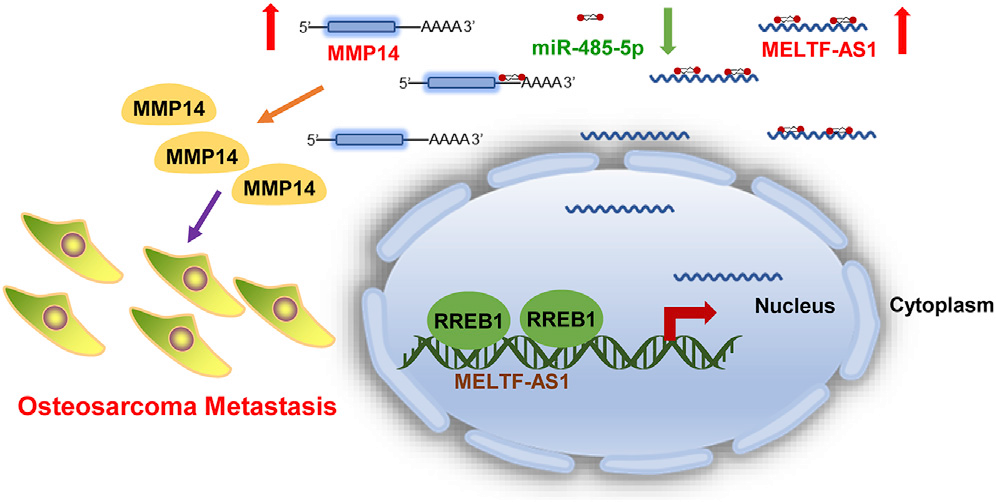
结论:MELTF-AS1是骨肉瘤的促转移lncRNA。MELTF-AS1在伴有远处转移的骨肉瘤中表达升高,其高表达与骨肉瘤患者的不良预后相关。MELTF-AS1通过调控MMP14的表达增强骨肉瘤细胞的转移能力。我们的研究表明MELTF-AS1可能是骨肉瘤患者潜在的治疗靶点。
参考文献:Ding L, Liu T, Qu Y, Kang Z, Guo L, Zhang H, Jiang J, Qu F, Ge W, Zhang S. lncRNA MELTF-AS1 facilitates osteosarcoma metastasis by modulating MMP14 expression. Mol Ther Nucleic Acids. 2021 Aug 26;26:787-797. doi: 10.1016/j.omtn.2021.08.022. PMID: 34729248; PMCID: PMC8526484.






