m6A修饰通过肝星状细胞自噬信号通路调控铁死亡
肝纤维化是一种复杂的生理和病理生理状况,与瘢痕形成机制有关。细胞外基质的沉积是肝纤维化的核心事件,肌成纤维细胞基质主要由活化的 HSC 产生。今天我们来讲一篇关于m6A修饰调控铁死亡的文章,文章题名为:N6-methyladenosine modification regulates ferroptosis through autophagysignaling pathway in hepatic stellate cells,发表于Redox Biology期刊(IF=11.79)
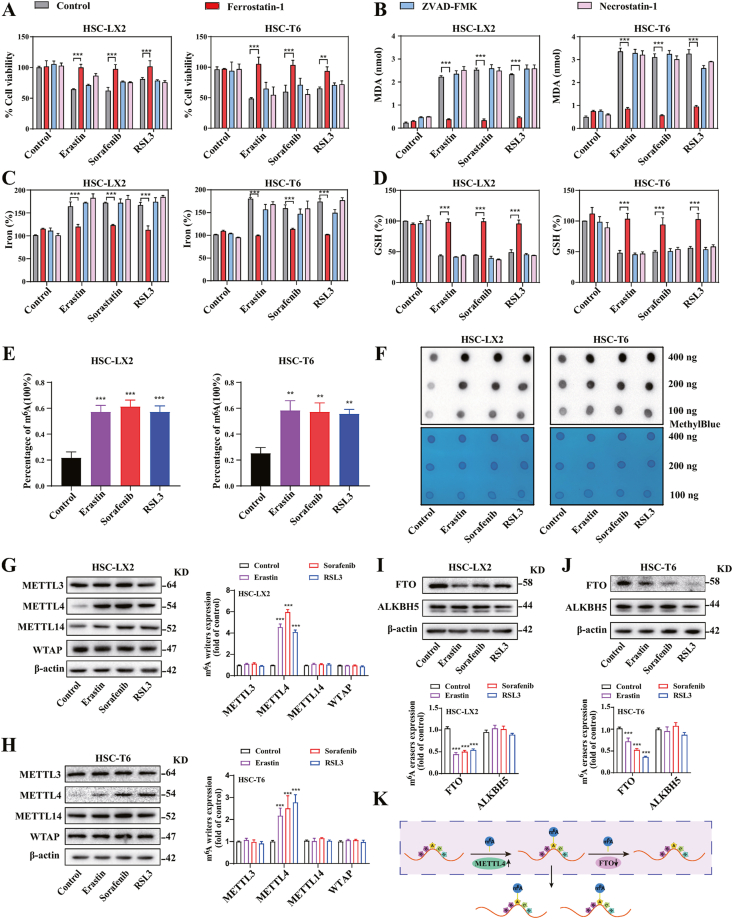
m6A 修饰在HSC铁死亡期间上调
Erastin、Sorafenib和RSL3处理明显抑制了大鼠 (HSC-T6)、人 (HSC-LX2) HSC细胞,但铁死亡抑制剂(ferrostatin- 1) 而不是坏死性凋亡抑制剂 (necrostatin-1) 和凋亡抑制剂 (ZVAD-FMK) 完全挽救了细胞生长抑制。erastin、Sorafenib 和RSL3 治疗还显著显着增加了细胞内MDA和铁水平,降低了谷胱甘肽水平和脂质ROS积累。是ferrostain-1,而不是 necrostatin-1 和 ZVAD-FMK,削弱了HSC 铁死亡。总的来说,这些结果充分证实了erastin、sorafenib和RSL3可以在体外触发HSC ferroptosis。
m6A RNA甲基化定量测定和斑点印迹显示,在用Sorafenib、erastin 和 RSL3 处理后,HSC细胞m6A 修饰水平显着增加。与其他甲基转移酶相比,METTL4 的蛋白质和mRNA表达显着上调。FTO在HSC铁死亡中显着下调。这些发现表明m6A修饰增加是由于HSC铁死亡期间METTL4和FTO的失调。
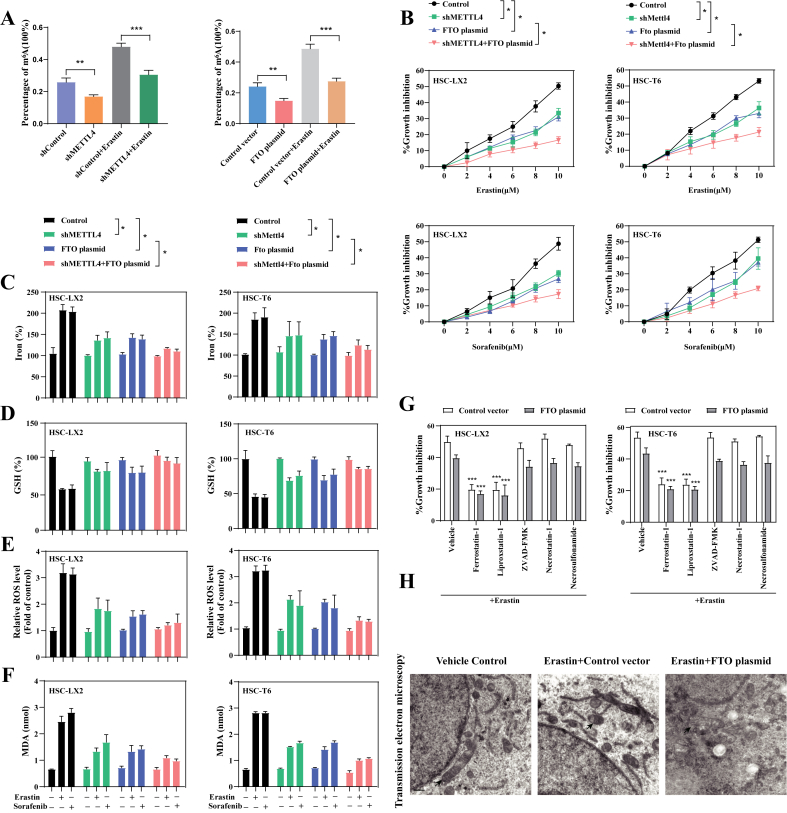
抑制m6A修饰赋予HSC铁死亡的抗性
m6A RNA甲基化定量分析证实,METTL4敲低和FTO过表达都可以降低Erastin诱导的HSC-LX2中m6A修饰的上调。METTL4敲低和FTO过表达显着消除了erastin和sorafenib处理对HSC-LX2和HSC-T6细胞的生长抑制。METTL4敲低和FTO过表达明显破坏了erastin和sorafenib诱导的细胞内铁、MDA和ROS水平,提升了谷胱甘肽水平。在FTO过表达条件下,liproxstatin-1和ferrostain-1 在内的铁死亡抑制剂显着逆转了erastin 诱导的生长抑制。透射电子显微镜分析证实,erastin 处理大大减少了线粒体并减少了脊的数量,而 FTO 质粒完全消除了铁死亡细胞的典型变化。这些数据表明,铁死亡诱导剂处理对m6A修饰的上调可能有助于 HSC 铁死亡,但不会导致坏死性凋亡和细胞凋亡。
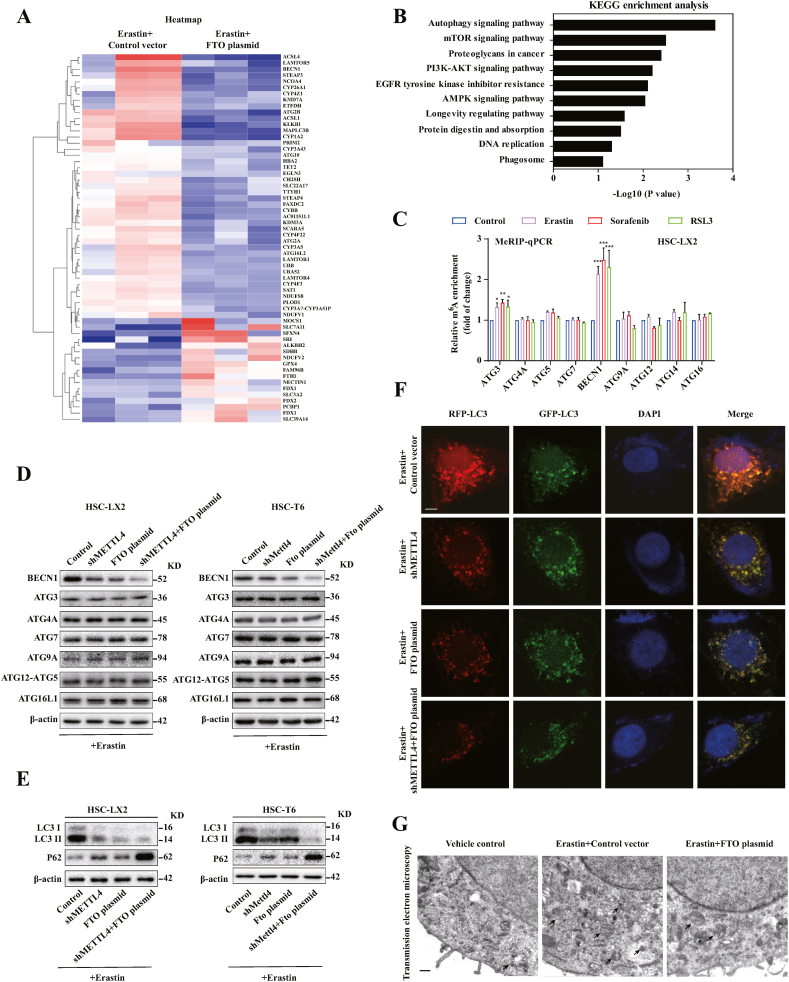
通过m6A修饰抑制减少铁死亡与自噬失活有关
进行了 RNA 测序 (RNA-seq),以进一步探索m6A修饰促进 HSC 铁死亡的分子机制。在 FTO 过表达的HSC-LX2细胞中,424个mRNA显着增加,而317个 mRNAs明显减少。这其中包含一些铁死亡相关基因,例如 SLC7A11、SLC3A2、GPX4。KEGG)分析和 GO 分析充分表明,HSC铁死亡过程中自噬信号可能受到m6A修饰的调节。我们发现自噬信号传导中的关键靶基因 BECN1 的表达在 FTO 过表达后显着降低。m6A RNA免疫沉淀 (MeRIP) qPCR 显示,在HSC铁死亡中,BECN1中m6A修饰的水平增加,但在ATG3、ATG4A、ATG5、ATG7、ATG9A、ATG12和ATG16L1中没有增加。METTL4敲低和FTO过表达显着降低了BECN1的蛋白质表达,而其他自噬相关基因没有大的差异。METTL4敲低和FTO过表达介导的m6A降低有效抑制erastin 诱导的HSC中LC3-I向LC3-II 的转化。荧光图片显示m6A降低抑制了erastin 诱导的自噬流。透射电子显微镜检测进一步证实FTO质粒对m6A修饰的下调减少了HSC铁死亡中的自噬囊泡。这些数据表明 m 6 A 修饰诱导铁死亡与自噬激活有关。
BECN1诱导自噬损害m6A修饰抑制赋予的HSC铁死亡抗性
BECN1过表达在HSC铁死亡过程中完全削弱了m6A修饰抑制诱导的BECN1下调。BECN1过表达恢复了自噬体的产生和自噬通量。在存在 m 6 A 修饰还原的情况下。Erastin 和sorafenib诱导的生长抑制被 FTO过表达和 METTL4 敲低破坏,而BECN1过表达在HSC铁死亡期间显着促进生长抑制。erastin和sorafenib治疗在HSC中METTL4敲低或FTO过表达处理完全消除了铁的积累、MDA、谷胱甘肽耗竭和脂质 ROS 积累。然而,BECN1过表达,抑制m6A 修饰并未显着削弱铁死亡事件。这些发现表明 BECN1过表达激活自噬削弱了抑制m6A修饰对HSC铁死亡的抵抗力。
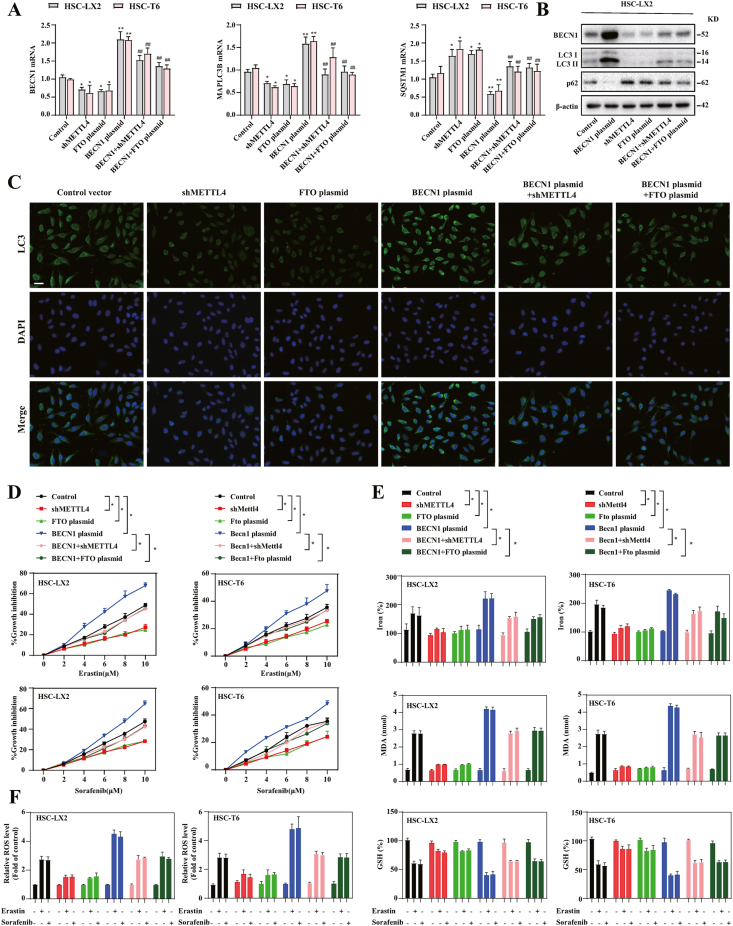
YTHDF1通过识别m6A结合位点促进BECN1mRNA 稳定性和激活自噬
YTHDF1蛋白和mRNA在 HSC铁死亡期间显着上调。放射菌素D实验显示YTHDF1过表达后BECN1的mRNA半衰期较对照载体组延长。蛋白酶处理显示YTHDF1过表达后BECN1的蛋白质半衰期没有显着差异。RIP-PCR显示YTHDF1能够富集BECN1,RNA pulldown实验显示,YTHDF1 可以很容易地与 BECN1 CDS 而不是 BECN1 的3'-UTR和5'-UTR转录本相互作用。MeRIP qPCR 还显示m6A修饰在BECN1 CDS中显着富集。转染了BECN1 CDS的HSC-LX2 细胞中的荧光素酶活性显着增加。BECN1 mRNA 序列的CDS中的两个m6A修饰位点序列。实验显示实BECN1-CDS-Mut2破坏了 YTHDF1 和 BECN1 mRNA 的结合,而不是 BECN1-CDS-WT和BECN1-CDS-Mut1。RNA稳定性分析表明,YTHDF1质粒延长了BECN1-CDS-WT mRNA和BECN1-CDS-Mut1 mRNA的半衰期,但没有延长BECN1-CDS-Mut2 mRNA的半衰期。此外,蛋白质印迹结果还表明BECN1-CDS-Mut2 明显破坏了erastin 诱导的 BECN1 蛋白上调。这些数据表明YTHDF1过表达通过与A1276的m6A结合位点CDS区域的结合来促进BECN1 mRNA 的稳定性。

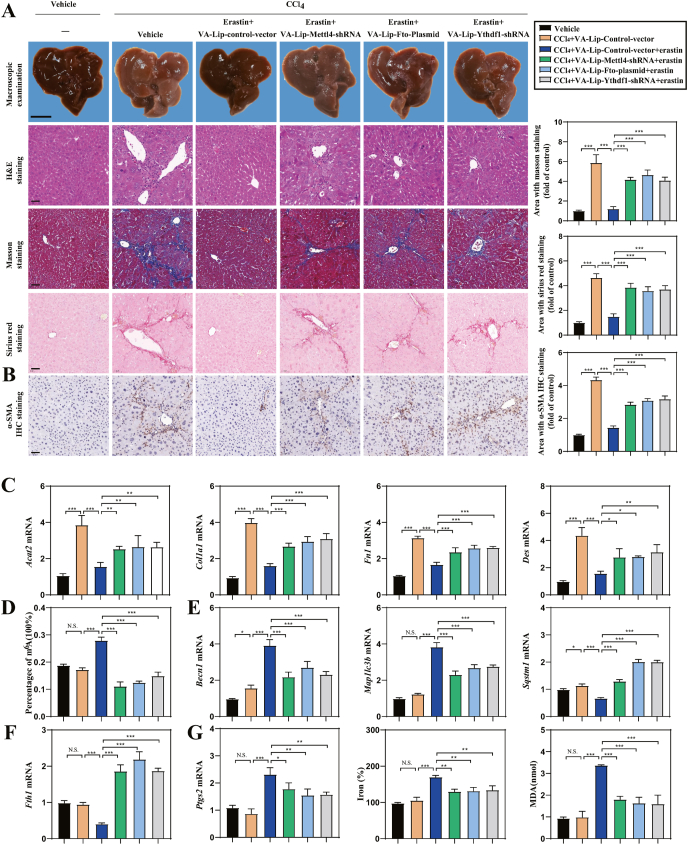
m6A修饰的HSC特异性抑制损害erastin诱导小鼠肝纤维化中HSC铁死亡
肉眼观察肝纤维化模型组与对照组相比纤维化病理改变,而erastin治疗减轻了CCl 4诱导的肝纤维化。用VA-Lip-Mettl4-shRNA、VA-Lip-Fto-质粒和VA-Lip-Ythdf1-shRNA预处理完全破坏了erastin对肝纤维化的改善。苏木精和伊红 (H&E) 染色、马森染色和天狼星红染色表明,erastin 处理显着减少了中央静脉中的胶原沉积。VA-Lip-Mettl4-shRNA、VA-Lip-Fto-质粒和VA-Lip-Ythdf1-shRNA明显逆转了erastin对肝纤维化的影响。免疫组化染色显示VA-Lip-Mettl4-shRNA、VA-Lip-Fto-质粒和VA-Lip-Ythdf1-shRNA完全消除了erastin对α-SMA表达的抑制作用。结果表明VA-Lip-Mettl4-shRNA、VA-Lip-Fto-质粒和VA-Lip-Ythdf1-shRNA完全消除了被erastin抑制的Acta2、Col1a1、Fn1和Des的mRNA表达。VA-Lip-Mettl4-shRNA、VA-Lip-Fto-质粒和 VA-Lip-Ythdf1-shRNA 显着阻止了对 m 6 A 修饰的erastin 的上调。VA-Lip-Mettl4-shRNA、VA-Lip-Fto-质粒和VA-Lip-Ythdf1-shRNA通过erastin处理阻断了自噬的激活,其特征是Becn1和Map1lc3b表达降低,Sqstm1和Fth1表达增加。VA-Lip-Mettl4-shRNA、VA-Lip-Fto-质粒和 VA-Lip-Ythdf1-shRNA对 m 6 A 修饰的抑制完全损害了以 Ptgs2为特征的铁死亡、氧化还原活性铁还原和 MDA 消除。这些结果支持了以下假设:鼠肝纤维化中的 HSC 特异性 m 6 A 修饰抑制损害了erastin诱导的HSC铁死亡。
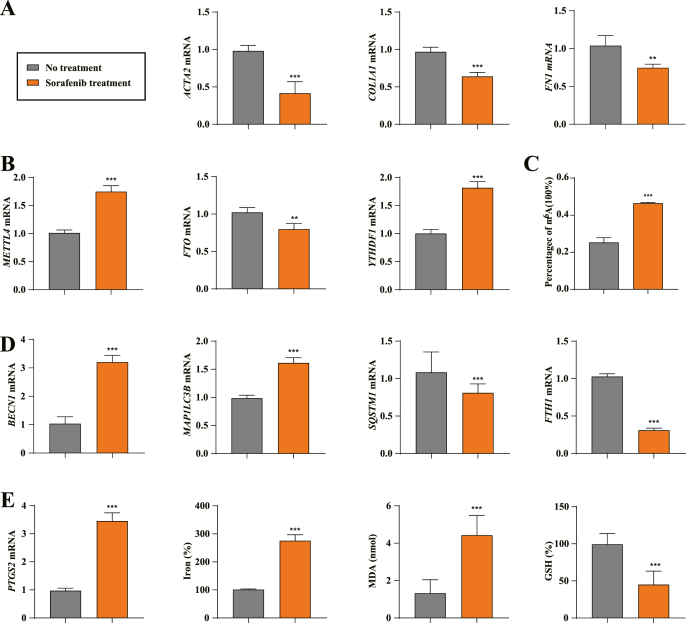
索拉非尼单药治疗的人类 HSC中m6A修饰上调、促进自噬和铁死亡
为了在临床上评估m6A修饰的潜在机制,分析了10名接受索拉非尼单药治疗的肝硬化并发HCC患者的部分肝切除标本和10名未接受任何治疗的肝硬化患者的肝活检标本。然后,根据先前的报道,使用激光捕获显微切割从收集的肝组织中分离出原代HSC。与之前的研究结果一致,与未经处理的肝活检样本相比,索拉非尼治疗的肝切除样本中纤维化标志物 ACTA2、COL1A1 和 FN1 的 mRNA 水平显着降低。正如预期的那样,PCR分析显示METTL4和YTHDF1 的表达上调,但 FTO 的表达在索拉非尼单药治疗样本中下调。m 6定量分析表明,与未处理的对照相比,用索拉非尼处理的原代 HSC中 m 6 A 修饰水平显着增加。此外,索拉非尼治疗可能会上调人 HSC 中铁蛋白吞噬标志物 BECN1 和 MAP1LC3B 的水平,并下调铁蛋白吞噬底物 SQSTM1 和 FTH1 的水平。重要的是,索拉非尼治疗增加了原代 HSC 中铁死亡标志物 PTGS2 的表达,以及包括氧化还原活性铁超载、脂质过氧化和 GSH 缺失在内的铁死亡事件。综上所述,这些发现表明索拉非尼单一疗法有助于上调 m 6 A 修饰、激活自噬和诱导来自纤维化患者的人类 HSC 中的铁死亡。