lncRNA稳定表达后与蛋白结合促进肿瘤恶性进展
LncRNA在不同癌症类型中异常调节被认为是人类癌症发生和进展的重要调控元素。但是其在胃癌(GC)中的作用仍有较大空白。本研究发现lncRNA THAP7-AS1被SP1转录激活然后被METTL3介导的m6A修饰稳定,进而提高CUL4B进入核中,从而发挥了原癌特性。本文于2021年10月发表在《Cell Death and Differentiation》IF:15.828期刊上。
技术路线:

主要实验结果:
1、THAP7-AS1在伴有淋巴结转移的胃癌样本中上调
对10例GC样本和2例非肿瘤胃组织进行芯片分析,获得lncRNA的差异表达谱,包含989个上调lncRNA(图1A)。只有2个lncRNA,LOC100133669和THAP7-AS1满足以下条件:差异倍数大于5,P<0.05,在GC中显著上调(图1B)。但是在72个GC临床样本中,只有THAP7-AS1在淋巴结转移(LNM)的组织中的表达显著非LNM组织(图1C-D)。因此被初步选为候选基因。随后发现THAP7-AS1同时定位于细胞核和细胞质,并能稳定表达(图1E-J)。
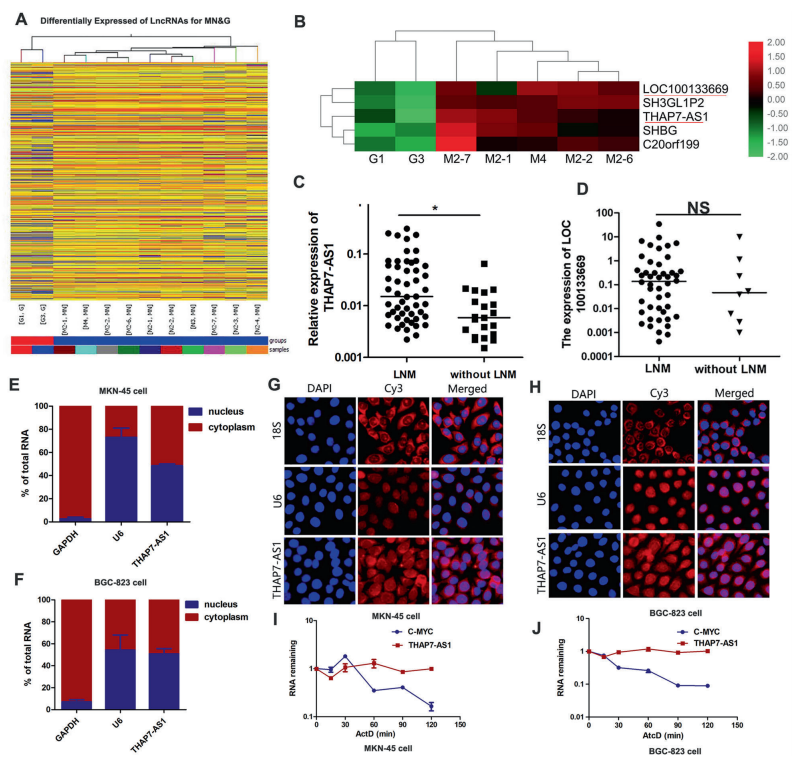
2、在GC细胞中SP1激活THAP7-AS1的转录
对THAP7-AS1进行启动子分析,如图2A-B,启动子207区域活性显著低于509区域,表明-509-207区域是THAP7-AS1完整转录活性所需要的。随后预测了5个与THAP7-AS1结合的转录因子,发现当过表达SP1,KLF5,EGR1后THAP7-AS1启动子509-0区域活性显著升高,但是只有SP1可以促进THAP7-AS1的表达(图2C-E)。为了确定SP1上3个与THAP7-AS1结合的位点的实际作用,进行了单位点突变实验,结果显示SP1-1,SP-1-2和SP-1-3突变质粒的THAP7-AS1启动子的活性显著下降,且下降倍数不同,表明3个结合位点各自独立作用(图2F-G)。ChIP结果显示,SP1可以和THAP7-AS1启动子之间结合,并且两者的表达呈正相关(图2H-J)。以上表明SP1结合THAP7-AS1启动子进而激活其转录。
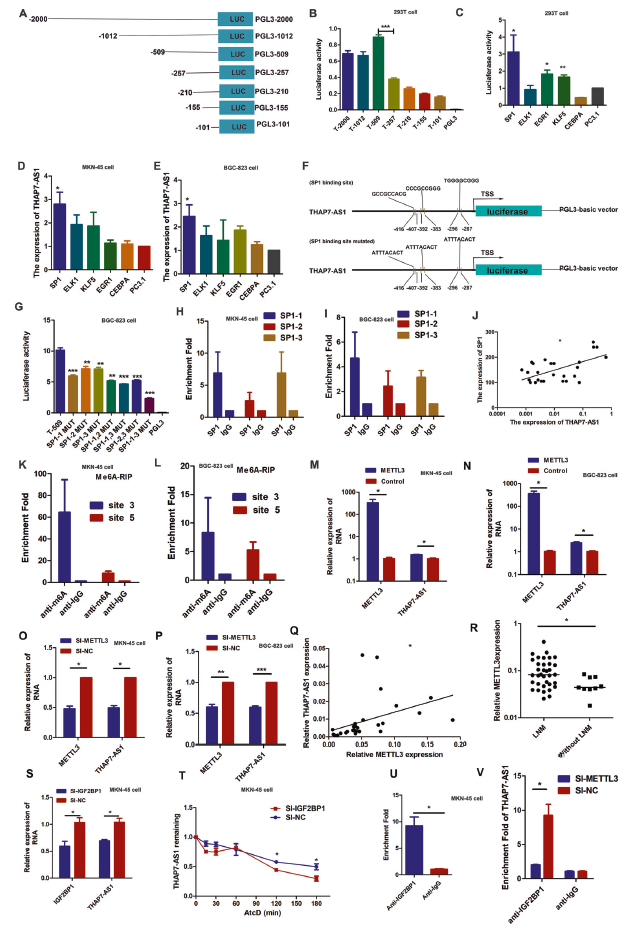
3、METTL3介导m6A修饰通过IGF2BP1依赖的RNA稳定性增强THAP7-AS1表达
m6A修饰被认为是最普遍的内部RNA修饰,涉及到RNA的降解,稳定性和剪切。为了评估m6A修饰在THAP7-AS1转录后调控中的重要作用,对THAP7-AS1序列进行了m6A修饰预测,发现其包含7个潜在的修饰位点。MeRIP实验结果显示THAP7-AS1确实存在m6A修饰(图2K-L)。此外,过表达或敲除METTL3,而不是METTL14,可以显著性增加或减少THAP7-AS1的水平(图2M-P)。并且和非LNM组织比较,METTL3的表达在LNM中显著上调,其表达和THAP7-AS1表达呈正相关关系(图2Q-R)。RNA pull-down实验表明THAP7-AS1可以和METTL3直接结合(图2P-Q)。敲除IGFBP1,而不是IGFBP2-3,导致THAP7-AS1表达下降,并且敲除IGFBP1后THAP7-AS1的稳定性下降,RIP也发现IGFBP1和THAP7-AS1的直接结合(图2S-U)。此外,在METTL3沉默的GC细胞中,IGFBP1和THAP7-AS1的结合显著下降。因此,以上表明METTL3介导的m6A修饰通过IGFBP1依赖的增强THAP7-AS1稳定性提高其表达。

图2(下部分)THAP7-AS1由METTL3介导的m6A修饰转录后稳定
如图3所示,过表达THAP7-AS1显著促进GC细胞的增殖,迁移和侵袭,沉默则相反。在体内,过表达THAP7-AS1增加了肿瘤体积,和肺转移。
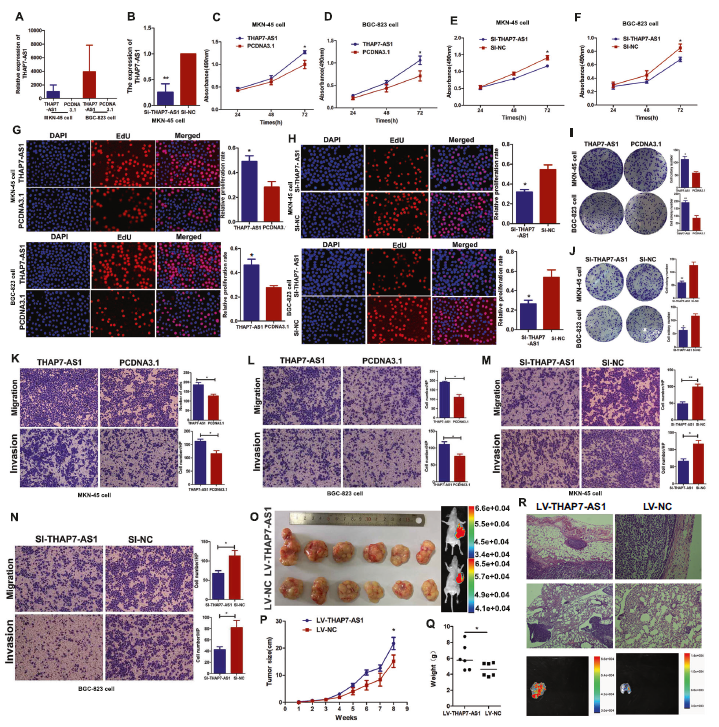
图3 THAP7-AS1促进GC细胞体内外的生长,迁移和侵袭
5、THAP7-AS1结合CUL4B的核定位信号区域,介导CUL4B进入细胞核
近来研究表明lncRNA通过和蛋白质相互作用发挥功能,作者推测THAP7-AS1也可能是通过这种方式介导GC恶性表型。RNA pull-down和MS实验鉴定了与THAP7-AS1结合的蛋白,包括CUL4B和STAT3(图4A)。但是只有CUL4B在GC细胞中特异性结合THAP7-AS1(图4B-D)。随后,作者构建了一系列截断突变体去探究它和CUL4B的结合区域,发现THAP7-AS1的1-442nt区域是和CUL4B结合所必须的(图4E)。FISH证实了两者的共定位(图4F),但是作者发现THAP7-AS1并不能改变CUL4B的表达(图5A,E),提示THAP7-AS1不参与CUL4B的转录后调控。有趣的是,慢病毒转染THAP7-AS1后,细胞质中CUL4B表达减少,细胞核中CUL4B表达增加(图4G-H),表明THAP7-AS1促进CUL4B蛋白进入细胞核。进一步研究发现THAP7-AS1提高了NLS和importin α1的结合能力(图4I-K),并且THAP7-AS1直接结合CUL4B的NLS区域(图4L-O);THAP7-AS1也可以直接结合importin α1(图4P-S)。表明THAP7-AS1与importin α1和CUL4B的NLS区域结合,从而促进CUL4B和importin α1的结合。随后的挽救实验证实了THAP7-AS1的生物学功能是通过CUL4B的核易位(图4T-U)。总之,以上表明THAP7-AS1结合CUL4B的核定位信号区域,介导CUL4B进入细胞核,进而促进了GC细胞的恶性表型。

图4 THAP7-AS1结合CUL4B的核定位信号区域,介导CUL4B进入细胞核
6、THAP7-AS1/CUL4B复合物可启动miR-22-3p/miR-320抑制PI3K/AKT信号通路
为了鉴定参与THAP7-AS1/CUL4B复合物介导的生物学功能的潜在基因,对si-THAP7-AS1和对照HC细胞进行了RNA测序。与对照相比,在THAP7-AS1/CUL4B干扰组总计获得6502个上调基因,5794个下调基因。如图5的WB和RT-qPCR结果所示,PI3K/AKT信号通路上的基因,包括PIK3CA,PIK3CD,AKT3,显著响应THAP7-AS1或CUL4B的干扰或过表达处理;白合成抑制剂环己亚胺(CHX)和蛋白酶体抑制剂MG132处理实验结果表明,THAP7-AS1/CUL4B是在转录后水平调控上述PI3K/AKT信号通路上的基因表达,而不影响他们的稳定性和降解。
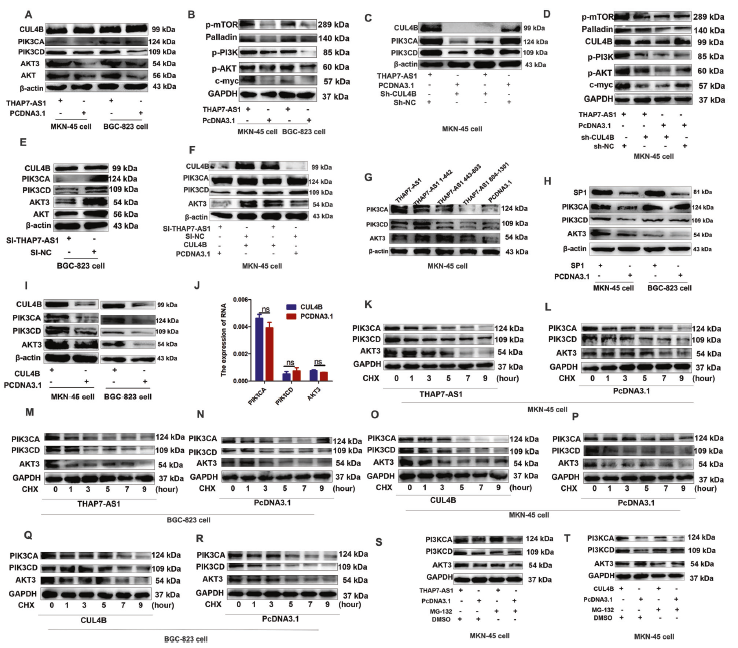
图5 THAP7-AS1/CUL4B复合物启动PI3K/AKT信号通路
鉴于miRNAs常见的转录后负调控因子,所以作者猜测miRNA可能参与CUL4B对PI3K/AKT信号通路上的基因表达的调控。如图6所示,作者使用GSE数据和在线预测获得了5个候选miRNAs,进一步验证后锁定了miR-22-3p/miR-320a,随后实验证实AKT3是miR-22-3p的靶基因,而miR-320a 可同时靶向调节PIK3CA,PIK3CD,AKT3蛋白的表达,挽救实验也再次证实了这个结果。总之,以上表明THAP7-AS1/CUL4B复合物通过miR-22-3p/miR-320靶向抑制PI3K/AKT信号通路。

图6 THAP7-AS1/CUL4B复合物可启动miR-22-3p/miR-320a抑制的PI3K/AKT信号通路
7、THAP7-AS1/CUL4B复合物转录抑制miR-22-3p/miR-320a表达通过CUL4B催化H2AK119ub1和EZH2介导的H3K27me3
研究发现CUL4B通过单泛素化H2AK119调控肿瘤抑制子的表观遗传失活。EZH2是PRC2的催化亚基,对于形成稳定的、酶活性强的甲基转移酶复合物至关重要。为了检测miR-22-3p和miR320a的表达是否受到上述表观遗传修饰的调控,用5-AZ、TSA和Dznep处理GC细胞,结果发现它们的表达在TSA和Dznep组显著上调(图7A-B),表明其启动子存在组蛋白甲基化和组蛋白乙酰化。抗CUL4B、EZH2、H2AK119ub1、H3K27me3、HDAC1和HADC2或对照IgG的ChIP检测显示,CUL4B(图7C, G)、EZH2(图7D, H)、H3K27me3(图7E, I)和H2AK119ub1(图7F, J),有效地免疫沉淀了miR-22-3p和miR-320a的启动子区域,表明它两可被CUL4B催化的单泛素化H2AK119和PRC2-介导的H3K27me3调控。
敲除CUL4B导致CUL4B,EZH2,H3K27me3,H2AK119ub1绑定到miR-22-3p和miR-320a启动子显著减少。这表明CUL4B调节miR-22-3p和miR320a的转录抑制是通过招募PRC2(图7K-R)。THAP7-AS1过表达导致与miR-22-3p和miR-320a启动子结合的CUL4B和EZH2显著增加,表明THAP7-AS1参与了CUL4B介导的PRC2招募(图7S-V)。CUL4B敲低逆转了THAP7- AS1过表达引起的pri-miR-22-3p/pri-miR-320a的下降,反之亦然(图7W, X)。综上所述研究表明THAP7-AS1/CUL4B复合物通过CUL4B催化的H2AK119ub1和ezh2介导的H3K27me3在转录水平抑制miR-22-3p/miR-320a的表达。
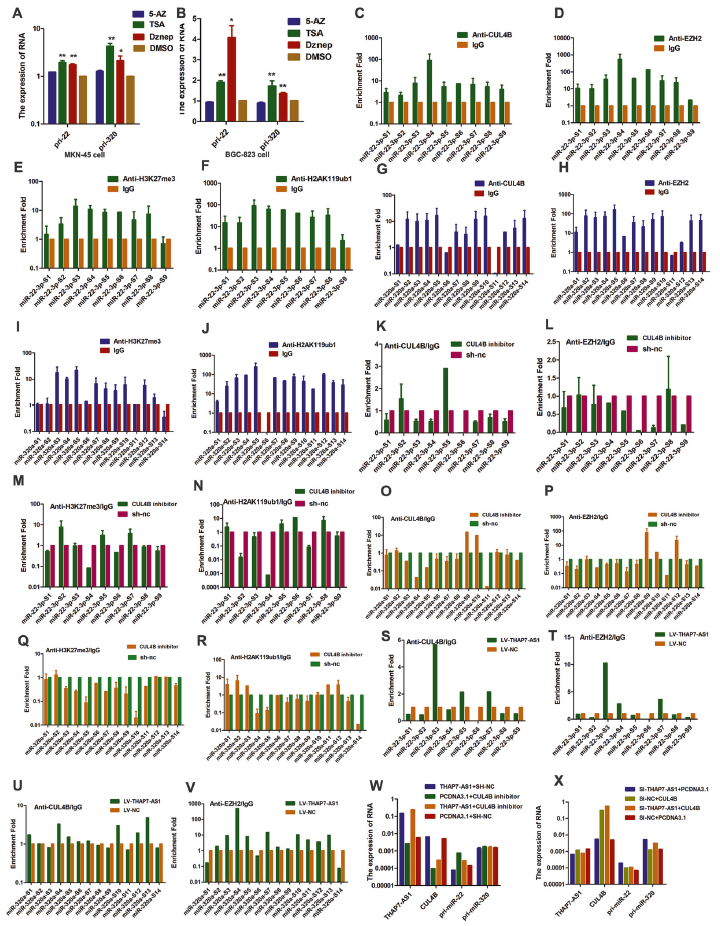
图7 THAP7-AS1-CUL4B复合物可通过CUL4B催化的H2AK119ub1和EZH2介导的H3K27me3转录抑制miR-22-3p/miR-320a的表达
如图8所示,THAP7-AS1高表达患者的LNM危险性更高,总体生存率更差,敲除THAP7-AS1后肿瘤大小和肿瘤下降,Ki67阳性率下降。提示THAP7-AS1可作为胃癌患者的预后和治疗标志物。
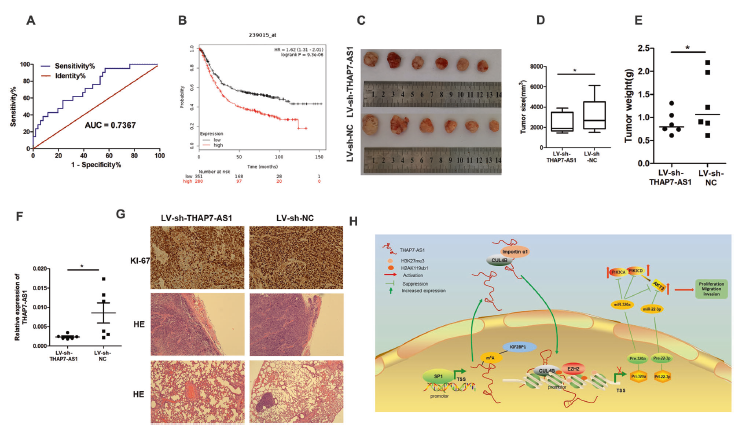
图8 THAP7-AS1可作为胃癌患者的预后和治疗标志物
综上所述,lncRNA在人GC组织中产生了差异表达谱。THAP7-AS1是一种新的促进GC进展的lncRNA,由SP1转录激活,并由METTL3介导的m6A修饰转录后稳定。此外,THAP7-AS1促进了CUL4B与importin α1的结合,并增强了CUL4B蛋白进入细胞核的能力。THAP7-AS1/CUL4B复合物通过CUL4B催化的H2AK119ub1和ezh2介导的H3K27me3转录抑制miR-22-3p和miR-320a,从而激活PI3K/ AKT信号通路(图8H)。本研究结果突出了GC中lncRNA、miRNA和蛋白之间重要的功能相互作用,提示THAP7-AS1可能成为GC治疗的一个有前景的分子靶点。
参考文献:
Liu Hai-Ting., Zou Yong-Xin., Zhu Wen-Jie., Sen-Liu., Zhang Guo-Hao., Ma Ran-Ran., Guo Xiang-Yu., Gao Peng.(2021). LncRNA THAP7-AS1, transcriptionally activated by SP1 and post-transcriptionally stabilized by METTL3-mediated m6A modification, exerts oncogenic properties by improving CUL4B entry into the nucleus. Cell Death Differ, undefined (undefined), undefined. Doi: 10.1038/s41418-021-00879-9






