结肠直肠癌中m6A阅读器IMP2稳定ZFAS1/OLA1轴并激活Warburg效应
越来越多的证据表明,n6 -亚甲基腺苷(m6A)调节剂参与了结直肠癌(CRC)的病因和进展。然而,m6A阅读器参与糖酵解代谢的确切机制仍不清楚。本文旨在通过m6A与糖酵解代谢的交互作用,揭示CRC进展的新机制。
本文技术路线:

1、CRC细胞和组织中IMP1/2/3表达与异常调节的LncRNAs的相关性
IMP属于一种m6A阅读器,在CRC中IMP1/2/3家族如何识别lncRNAs尚未被探索。作者首先分析了IMP1,IMP2,IMP3在CRC组织中的表达量,结果发现在CRC组织中,只有IMP2过表达,且其表达量远高于IMP1和IMP3(Fig 1B)。在7个CRC细胞系中(LOVO,CACO2、SW48、SW480、HT29、HCT116和SW620),IMP2的表达量均高于正常人肠上皮细胞系(HIEC) (Fig. 1c)。m6A斑点杂交实验显示CRC细胞系,特别是HCT116,SW620,HT29细胞株的m6A水平显著高于正常的结直肠上皮细胞HIEC中m6A水平(Fig. 1d)。这也符合IMP2的功能,即稳定RNA表达,增加总RNA的m6A水平。然后,通过TCGA数据库和GEO数据库分析发现,在CRC中,7个lncRNA候选基因中,ZFAS1、SNHG15和CRNDE均显著表达。在CRC细胞中,ZFAS1表现出最显著的过表达(Fig. 1e)。通过检测正常对照细胞HIEC和CRC细胞系(HCT116、SW620、SW480、LOVO、HT29、CACO2、SW48)中ZFAS1、CRNDE和SNHG15的RNA表达水平,发现在CRC细胞中,ZFAS1表达量显著上升(Fig. 1f)。然后,对IMP1/2/3与ZFAS1进行相关性研究,结果表明,ZFAS1与IMP2呈显著正相关(R = 0.6476, P < 0.0001, Fig. 1g)。但ZFAS1和IMP1或IMP3之间没有明显的相关性。
接下来,为了研究IMP2在ZFAS1表达及其相关m6A甲基化水平中的潜在作用,作者采用组织芯片(TMA)、RNA原位杂交(ISH)和免疫组织化学(IHC)检测了在配对的CRC组织和匹配的邻近肿瘤对照中IMP2、m6A、和ZFAS1的表达水平(Fig. 1h)。CRC组织中IMP2, ZFAS1的表达量以及m6A表达水平明显增高(Fig. 1i)。进一步进行相关性分析发现,IMP2和ZFAS1表达量以及m6A水平正相关(Fig. 1j)。
通过临床分析发现,上调的IMP2表达显著缩短了总生存期和无病生存,同样,m6A甲基化的高表达与总生存期短显著相关,同时, ZFAS1表达较高的患者总生存期和无病生存期显著降低(Fig. 1k)。
这些结果表明,在人类CRC细胞和组织中,IMP2过表达,并伴有相关的m6A甲基化水平和ZFAS1表达。这些指标也显示出未来作为CRC评估和治疗生物标志物的独立预后预测因子的潜在功能。
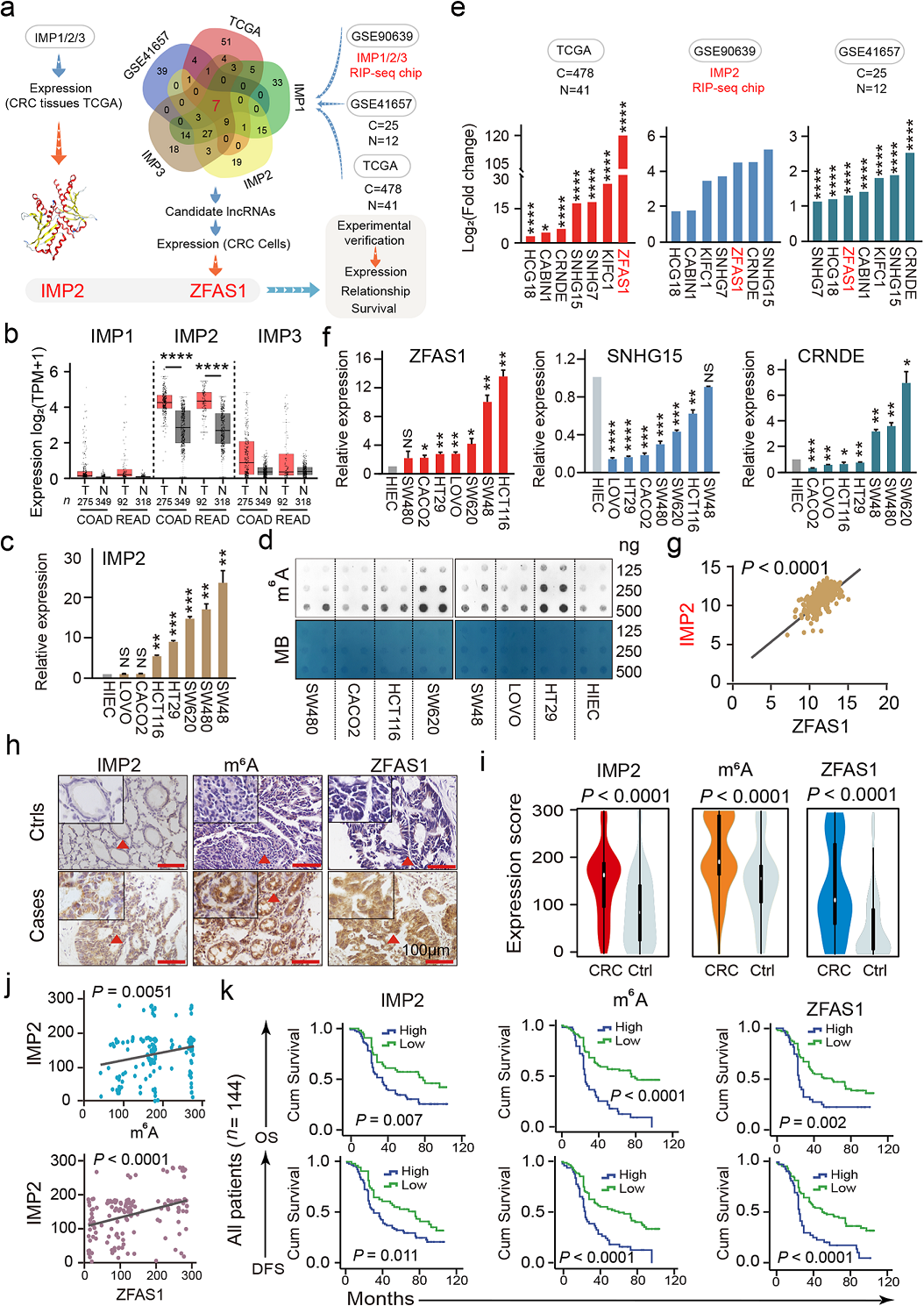
Fig1 CRC细胞及患者组织中IMP1/2/3与lncRANs表达的关系
2 IMP2通过直接结合结直肠癌细胞中ZFAS1的m6A位点,促进ZFAS1的稳定性
为了探究IMP2介导的m6A稳定性及其相关ZFAS1表达在CRC肿瘤发生和发展中的关键生物学特性,作者在HCT116和SW620 CRC细胞系中干扰IMP2表达,然后检测IMP2和ZFAS1的表达量。结果表明,异位的IMP2表达显著增强了ZFAS1和IMP2的表达。然而,IMP2敲低抑制了ZFAS1和IMP2的表达(Fig. 2b )。此外,在挽救实验中,在IMP2敲低的CRC细胞中上调ZFAS1检测到ZFAS1表达恢复(Fig. 2C )。更重要的是,RNA稳定性分析发现IMP2敲低或放线菌素D在不同时间点(0,2,4,6 h) 进行处理都会缩短ZFAS1 RNA的半衰期(Fig. 2D )。这些结果初步确信,作为m6A阅读器的IMP2对ZFAS1具有稳定作用。为了验证IMP2和ZFAS1之间的直接关系,通过RIP-seq发现,在HEK293T细胞中,异位IMP2表达显著富集了内源性ZFAS1(Fig. 2e)。此外,CLIP数据库显示IMP2蛋白具有特定的结合域识别ZFAS1序列中的m6A的RGGAC/ rach基序(Fig. 2F)。
同样,通过Cuilab进行生信分析在ZFAS1基因中成功地发现了4个m6A结合基序RGGAC和1个m6A结合基序RAGAC(Fig. 2g)。catRAPID和MOE平台也被用来确定在二级和三级结构水平上的直接结合域(Fig. 2h, i)。ZFAS1的“RGGAC”基序(+833 ~ +869)与IMP2 蛋白序列的KH3-4结构域(+198 ~ +249)具有显著的交互倾向性(值= 206)和识别能力(100%),其交互强度为98% (Fig. 2h)。
MOE软件分析了识别 ZFAS1的RGGAC/RRACH基序与IMP2 KH3-4氨基酸结构域交互(Fig. 2i)。采用ISH和免疫荧光(IF)进行共定位,证实ZFAS1和IMP2的表达分布一致,在HCT116和SW620细胞中都显示主要分布在细胞质中,部分分布在细胞核中(Fig. 2j)。此外,RIP实验发现,m6A抗体孵育得到了富集的ZFAS1 (Fig. 2k)。此外,作者合成了包含RGGAC/ rach识别motif (ZFAS1 m6A-WT)以及含有相应的突变序列(ZFAS1 m6A-Mut)的具有生物素标记的ZFAS1探针(Fig. 2m)。然后通过RNA-down实验证实IMP2蛋白结合的是ZFAS1 m6A-WT,但不是ZFAS1m6A -Mut,而这种富集在IMP2敲低之后会消除(Fig. 2m),表明m6A识别基序与IMP2蛋白特异性结构域直接结合相互作用。
为了确认ZFAS1是否由IMP2 KH3-4结构域识别m6A基序,用IMP2 KH3-4 WT或Mut载体处理HEK-293 T细胞后进行qPCR检测,用IMP2 KH3-4 Mut载体处理后,ZFAS1表达明显减少(Fig. 2l)。随后,我们对ZFAS1上的m6A位点(+833 ~ +869)进行突变,检测ZFAS1的稳定性,其稳定性也显著降低(Fig. 2n)。到目前为止,已经证实了IMP2通过KH3-4直接与ZFAS1的m6A位点结合,增强了ZFAS1的稳定性(Fig. 2a)。
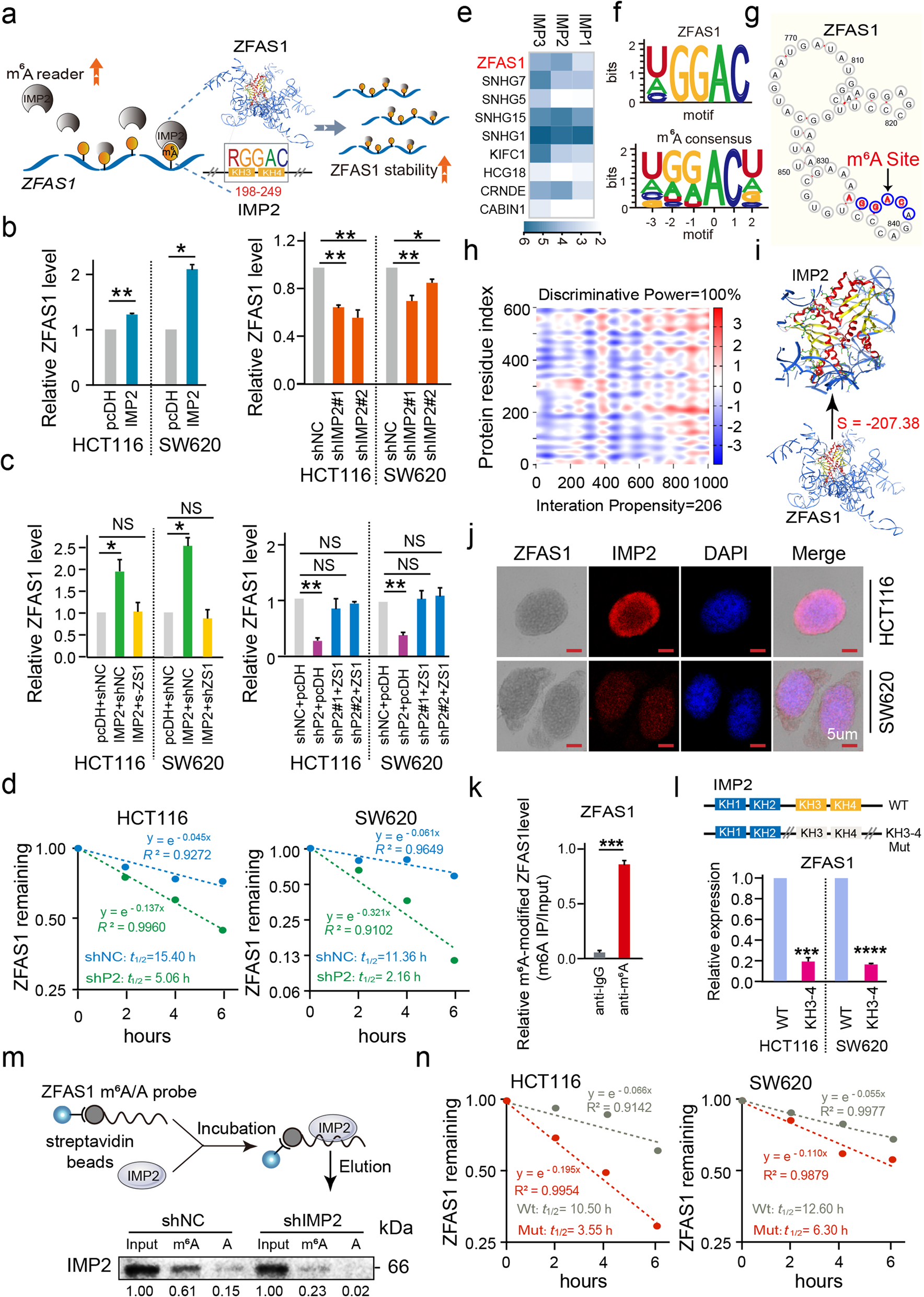
Fig2 IMP2通过直接与ZFAS1的m6A位点结合来提高ZFAS1的稳定性
3 IMP2通过调节ZFAS1在结直肠癌细胞中的表达进而调节生物学特性
在本研究中,为进一步阐明IMP2和ZFAS1在CRC细胞中了调控模式,通过MTT检测在HCT116 和SW620 CRC细胞系中分析了干扰IMP2表达后细胞的增殖能力(Fig. 3b)和集落形成能力(Fig. 3C)。不出所料,异位表达的IMP2显著促进了HCT116和SW620细胞的细胞生长和菌落形成能力,IMP2缺失抑制了这两种类型的结直肠癌细胞的增殖能力和结肠能力(Fig. 3b, c)。此外,通过Trans-well实验检测其侵袭能力,结果显示当沉默IMP2时,迁移细胞被显著抑制。相反,IMP2过表达显著提高了HCT116和SW620 CRC细胞的侵袭能力(Fig. 3d)。此外,IMP2敲除增加了细胞凋亡率。然而,经过流式细胞PE / 7 AAD双重染色后检测显示,在HCT116和SW620 CRC细胞中,IMP2过表达显著抑制了细胞凋亡率(Fig. 3e)。
为进一步确立IMP2是否影响ZFAS1在CRC细胞中的表达及其可能的生物学功能,通过在IMP2敲低的CRC细胞中增强ZFAS1的表达进行挽救实验。结果显示ZFAS1过表达逆转了HCT116和SW620 的分子特征包括细胞增殖能力、细胞集落形成能力、细胞迁移能力和凋亡率(Fig. 3f)。因此,这些结果表明IMP2通过促进ZFAS1的稳定性和表达,促进CRC细胞增殖,抑制CRC细胞凋亡,促进细胞侵袭转移,而IMP2可以通过调节ZFAS1的表达来恢复其对细胞表型的影响。
Fig3 IMP2通过调节结直肠癌细胞中ZFAS1的表达介导生物学特性
4 在CRC细胞中,IMP2通过OLA1作为稳定ZFAS1的关键靶点
为挖掘ZFAS1下游影响CRC细胞表型和功能的靶点,对结直肠癌细胞进行相关功能研究。首先,通过热图聚类分析,富集了与ZFAS1过表达呈正相关的潜在下游靶点(Fig. 4b) 并且通过结合GSE128435和TCGA数据集进一步扩展CRC样本(Fig. 4a)。发现线粒体能量代谢相关基因OLA1恰好出现在这些共表达靶点的交叉部位(Fig. 4a)。进一步检测发现与HIEC对照相比,OLA1在7个CRC细胞株中显著过表达,包括SW480、HT29、LOVO、CACO2、SW48、HCT116和SW620(Fig. 4c)。通过qPCR检测发现,与癌旁组织相比,CRC组织中OLA1水平升高(Fig. 4d)。
采用TMA和IHC检测OLA1表达水平,如预期的那样,标记的OLA1水平在CRC组织与那些匹配的肿瘤邻近对照相比,显示了一个致癌基因的特性(Fig. 4e, f)。OLA1表达量与ZFAS1表达量呈线性正相关(Fig. 4g)。同样,在TCGA中,OLA1和ZFAS1在CRC组织中的表达高度一致,呈线性正相关(R2 = 0.27, P < 0.0001)。临床病理参数的相关性分析证实,OLA1低表达的患者在存活的患者中比例较高(Fig. 4h)。而OLA1的高表达显著缩短了患者无病生存期以及总生存期(Fig. 4i)。为了验证OLA1确实是被IMP2稳定的ZFAS1的下游靶点,我们检测了干扰IMP2后OLA1的mRNA和蛋白表达情况。有趣的是,IMP2沉默/过表达不仅降低/增加了OLA1 mRNA的表达,同时也降低或增加了OLA1的表达。然而,IMP2对OLA1的影响可以被ZFAS1完全逆转(Fig. 4j–l)。因此,这些发现表明在人结直肠癌细胞和组织中,m6A修饰和m6A稳定的ZFAS1表达正调控OLA1。进一步的预后评估表明,OLA1可以作为预测CRC临床结局的潜在生物标志物。
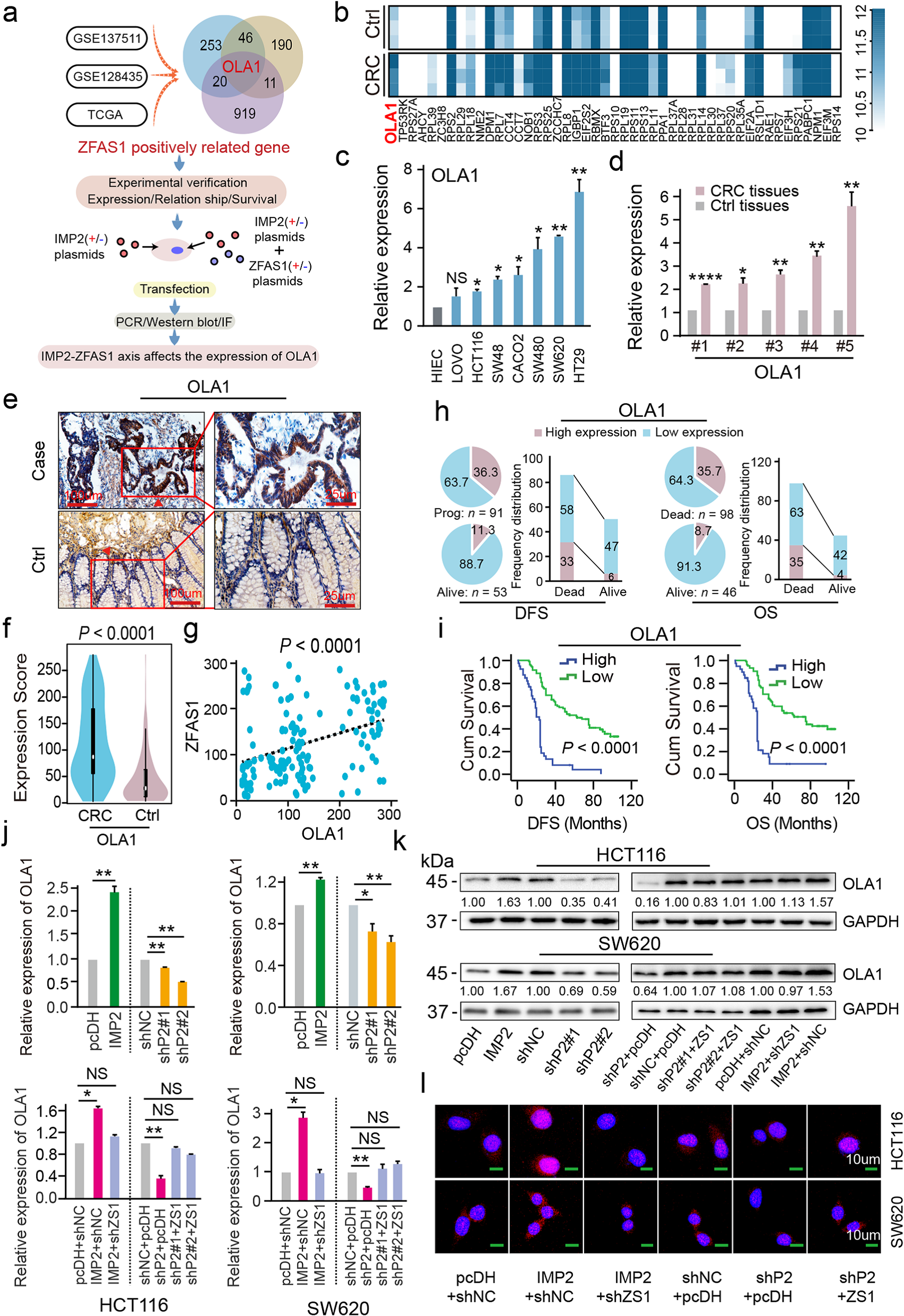
Fig4 在CRC细胞中,OLA1是经IMP2稳定的ZFAS1的下游关键靶点
5 ZFAS1通过与OLA1 OBG型功能域结合,增强OLA1活性并激活糖酵解
在之前的研究中,我们已经确定ZFAS1与OLA1的表达呈正相关。然而,依然未明确ZFAS1与OLA1的相互作用途径。于是作者通过ISH和IF进行检测,细胞共定位显示,OLA1和ZFAS1不仅在HCT116和SW620 CRC细胞的细胞质中分布一致,而且在细胞核中分布一致(Fig. 5b)。为了确定ZFAS1与OLA1是否有直接的结合位点,并检测ZFAS1中关键m6A位点对OLA1的影响,作者将ZFAS1中的3个A碱基(+833 ~ +869)替换为U碱基,并重新预测ZFAS1的三级结构。结果发现ZFAS1-WT和ZFAS1-Mut都与OLA1 OBG型功能域结合,然而,ZFAS1-WT和OLA1的结合强度远远高ZFAS1-Mut和OLA1的结合。此外,ZFAS1-WT与OLA1结合充分暴露OLA1的ATP结合位点(NVGKST, 32-37) (Fig. 5c)。
此后,Pull down实验表明,是ZFAS1-WT探针,但非ZFAS1- mut与OLA1结合,当ZFAS1上的m6A位点(+833 ~ +869)发生突变时,ZFAS1- wt探针不能再拉下OLA1 (Fig. 5d)。当ZFAS1的关键m6A位点发生突变时,ZFAS1对OLA1 atp酶活性的恢复效果消失(Fig. 5e)。这也证明了ZFAS1对OLA1 ATP酶活的促进作用取决于ZFAS1与OLA1结合暴露OLA1的ATP结合位点。
为了探讨OLA1 ATP酶活性变化对CRC细胞能量代谢的影响,作者检测了HCT116和SW620细胞中乳酸和ATP含量。结果发现,OLA1表达的降低不仅可以减少结直肠癌细胞中乳酸积累,还可以降低细胞中ATP含量;然而,ZFAS1 -WT能恢复OLA1不足带来的影响 (Fig. 5f, g)。这一结果与OLA1的ATP水解功能相矛盾,于是推测ATP产生的主要途径是否被阻断了。为了验证这一推测,作者进行了细胞外酸化率实验,以检测OLA1的变化对CRC细胞糖酵解能力的影响。结果发现,降低OLA1的表达可显著降低CRC细胞的糖酵解能力,而ZFAS1-WT而可以恢复OLA1表达减少对CRC细胞糖酵解能力降低的影响(Fig. 5h)。
综上所述,ZFAS1可以直接与OLA1的OBGtype功能域结合,暴露OLA1上的ATPbinding位点,从而增强OLA1的ATP水解能力。OLA1增强ATP水解能力,促进乳酸的积累和ATP合成原料的释放,从而激活CRC细胞的糖酵解途径,最终促进CRC中能量的释放。
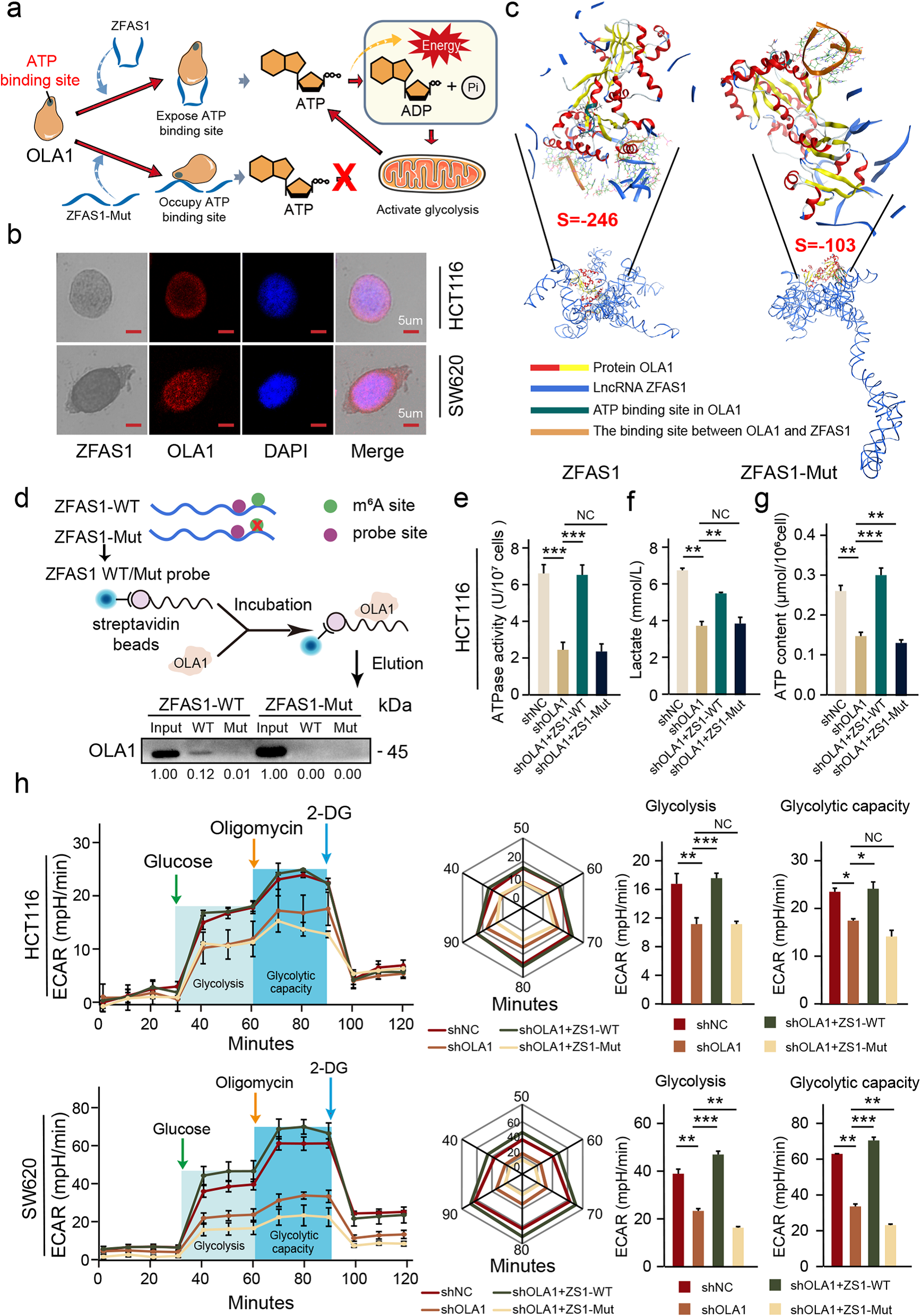
Fig 5 ZFAS1通过与OLA1 OBG型结构域结合增强OLA1活性并激活糖酵解
6 线粒体能量代谢受IMP2-ZFAS1-OLA1信号转轴的影响
为了进一步阐明在CRC进展过程中参与线粒体能量代谢的IMP2稳定信号轴的关键功能,首先在电子显微镜下观察了IMP2沉默后线粒体的形态学变化。结果显示,在CRC细胞中,IMP2沉默后,线粒体明显肿胀和受损,线粒体形态恢复正常(Fig. 6b)。也就是说,在CRC中,大多数细胞只能依赖糖酵解提供能量,而IMP2沉默后,CRC细胞的糖酵解能量比例会显著降低。为了验证我们的猜想,我们首先用IMP2进行干预,检测HK2(糖酵解的关键蛋白质)和PDHA1(氧化磷酸化的关键蛋白)的表达。结果显示,IMP2过表达促进HK2表达,抑制PDHA1表达(Fig. 6c)。IMP2沉默可显著降低HCT116和SW620 CRC中HK2的表达,增加PDHA1的表达(Fig. 6c)。此外,在CRC细胞中,ZFAS1沉默/过表达及IMP2过表达/沉默后,HK2和PDHA1的表达水平恢复(Fig. 7d)。IMP2过表达显著促进乳酸释放,提高ATP含量,然而,敲低IMP2导致乳酸和ATP含量的释放显著减少,而ZFAS1可以完全逆转IMP2的作用(Fig. 6e, f)。细胞能量代谢检测进一步表明,IMP2沉默降低了细胞的糖酵解能力,而ZFAS1可以逆转IMP2沉默对这两种类型的CRC细胞糖酵解水平降低的影响。综上所述,这些发现揭示了在CRC发生和发展的过程中,IMP2通过ola1调节ATP水解和糖酵解介导线粒体能量代谢促进m6A表达。
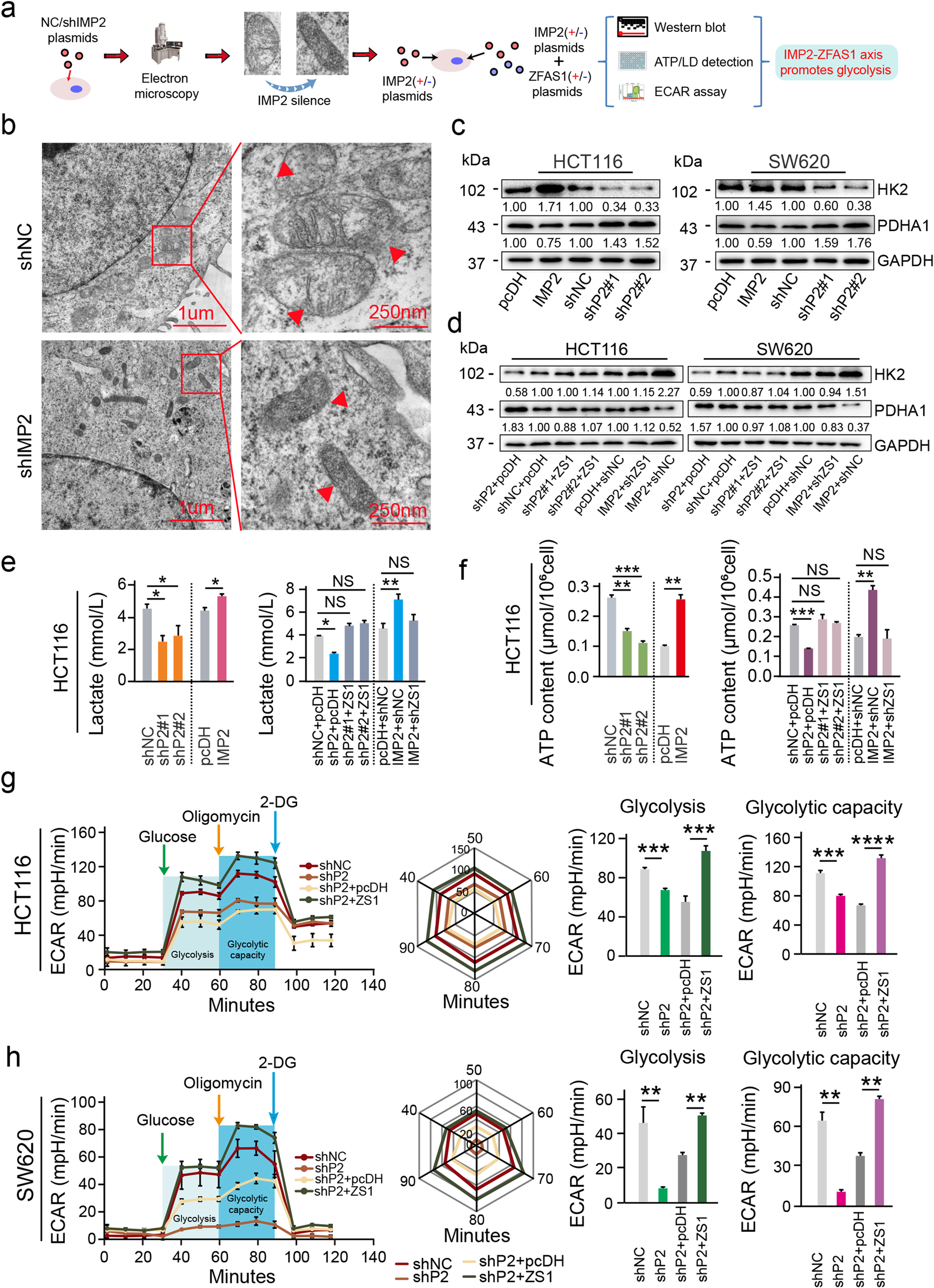
Fig6 线粒体能量代谢受IMP2-ZFAS1-OLA1信号转轴的影响
7 IMP2在体内通过稳定ZFAS1促进细胞增殖
为确认IMP2-ZFAS1-OLS1轴在体内的生物学功能,将4周龄BALB/c裸鼠腋窝皮下接种4种稳定共转染HCT116细胞(5 × 106细胞) 建立异种移植模型,分别为shNC组、shIMP2组、shIMP2 + pcDH组、shIMP2 + ZFAS1组(Fig. 7a)。在这项研究中,移植后10天出现了一个明显的异种移植瘤,在第40天切除异种移植瘤或随访至死亡(Fig. 7a)。预后评估显示,在shIMP2和ZFAS1载体共转染后,异种移植小鼠的生存时间显著缩短(Fig. 7b),提示IMP2与ZFAS1在CRC预后评估中具有协同作用。此外,转染了shIMP2载体的异种移植小鼠的肿瘤体积、大小和重量均显著降低,然而,与shIMP2和ZFAS1共转染后,观察到显著增加(Fig. 7c–e)。结果表明,在异种移植小鼠模型中,ZFAS1过表达显著逆转了IMP2沉默对肿瘤生长的抑制作用。同样,在第0、10和40天采集的具有代表性的异种移植物进行研究也得到了相同的结论(Fig. 7f)。
ISH和IHC检测证实,在异种移植瘤中,shIMP2组和shIMP2 + pcDH组的ZFAS1和OLA1表达较NC组明显降低;而shIMP2 + ZFAS1组与NC组无显著差异(Fig. 7g)。同样,qPCR和WB检测也得到相同的结论,包括在异种移植瘤中与shIMP2和ZFAS1载体共转染后的ZFAS1和OLA1(图7 h-j)。总之,体内实验表明敲低IMP2通过诱导m6A稳定性,能促进 IMP2与ZFAS1/OLA1轴的相互作用,抑制异种移植物的肿瘤生长。
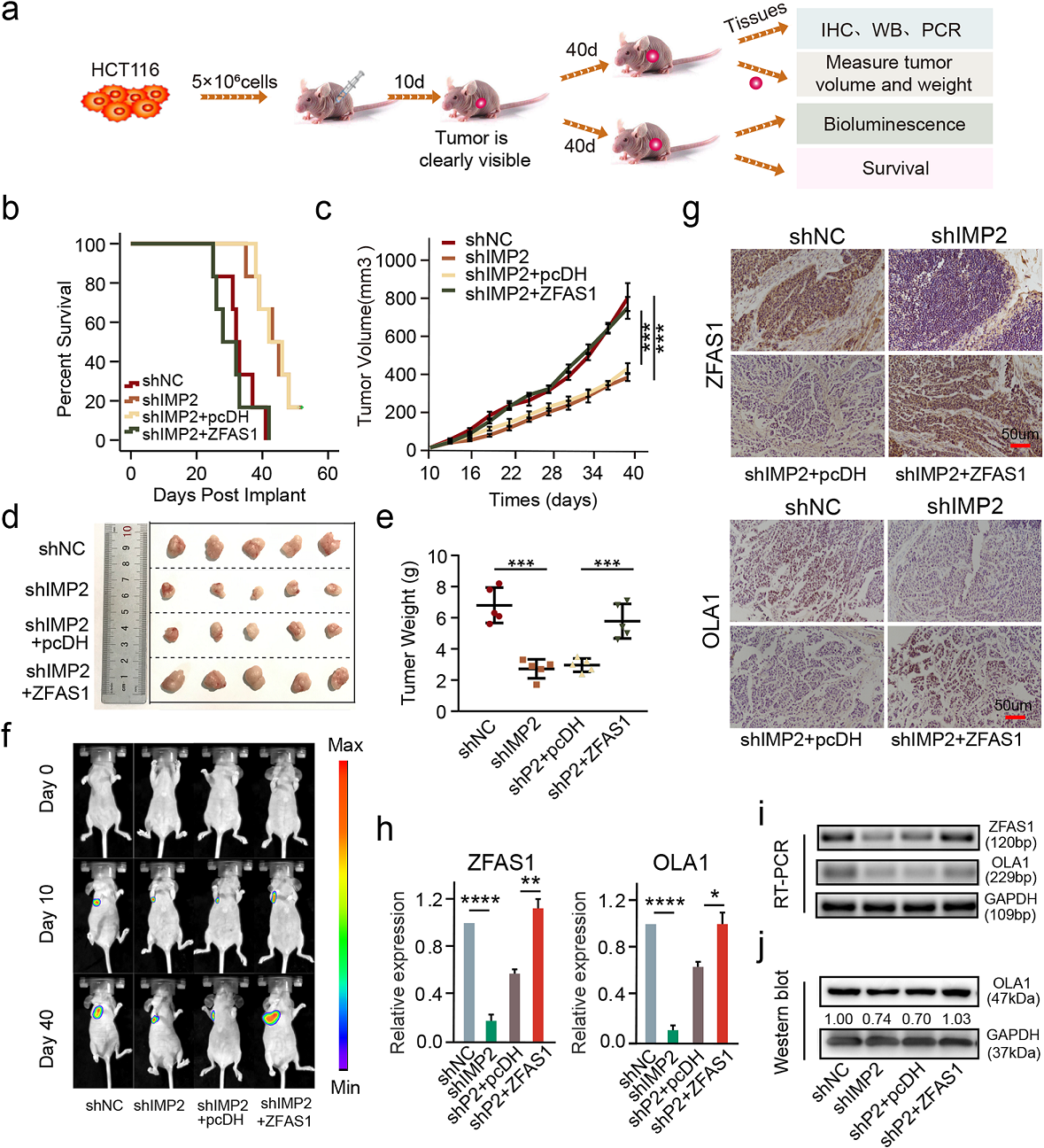
Fig7 IMP2在体内通过稳定ZFAS1促进细胞增殖
本文发现在CRC增殖和进展过程中,m6A 阅读器IMP2与长链非编码RNA (lncRNA) ZFAS1以m6A调节依赖的方式进行调控,随后增加了Obg-like ATPase 1 (OLA1)的募集以及三磷酸腺苷(ATP)水解和糖酵解。
Lu, S., et al., N6-methyladenosine reader IMP2 stabilizes the ZFAS1/OLA1 axis and activates the Warburg effect: implication in colorectal cancer. J Hematol Oncol, 2021. 14(1): p. 188.






