糖尿病皮肤中m6A reader YTHDC1靶向SQSTM1调节自噬
在糖尿病皮肤中,巨噬细胞/自噬的失调有助于伤口愈合的延迟。N6-甲基腺苷(m6A) RNA修饰在调节自噬中发挥重要作用。本研究揭示了YTHDC1通过调节糖尿病角质细胞中SQSTM1核mRNA的稳定性来调节自噬的功能最终作用于皮肤伤口愈合。本文于2021年10月发表在《Autophagy》IF:16.016期刊上。
技术路线:

主要实验结果:
近来研究发现糖尿病患者的皮肤表皮组织明显薄于对照组(Figure 1A,B)。为了寻找糖尿病皮肤表皮变薄的机制,用高糖处理角质细胞系HaCaT细胞。考虑到高糖会对细胞产生额外的渗透压力,甘露醇用于高糖的渗透控制对照。对两组细胞进行转录组测序,获得差异表达基因,其中与正常糖+甘露醇组比较,高糖组SQSTM1显著下调 (Figure 1C, D)。为了挖掘关键基因,通过Cytoscape软件的cyto-Hubba插件分析,发现SQSTM1是高糖处理HaCaT细胞中调控其他重要基因的潜在关键靶基因,具有较高的相关性(Figure 1E)。通过PPI获得了包括SQSTM1在内的得分最高的基因模块(Figure 1F)。此外,一部分可见通路与表皮、细胞因子和凋亡紧密连接的通路在KEGG网络图中展示了(Figure 1G)。以上表明SQSTM1是高糖处理的HaCaT细胞的关键基因。
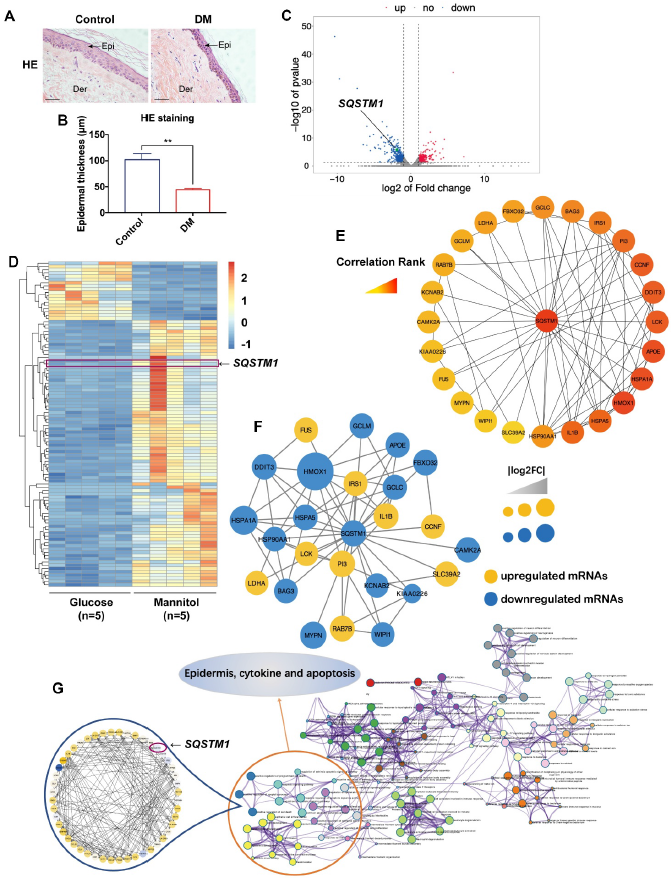
图1 SQSTM1是高糖处理的角质细胞的关键基因
2、高糖诱导SQSTM1下调并抑制角质细胞自噬
如Figure 2A所示,SQSTM1的mRNA表达以时间依赖的方式逐渐降低。由于SQSTM1是自噬关键基因,所以检测了高糖对自噬的影响。结果表明,高渗应激对SQSTM1表达水平、MAP1LC3B/LC3B-II:-I比值、MAP1LC3B/LC3B-II:TUBB(微管蛋白β I类)的比值均无明显影响。相比之下,短期高糖处理导致SQSTM1表达水平、MAP1LC3B/LC3B-II:-I比值和MAP1LC3B/LC3B-II: TUBB比值显著降低(Figure 2B, C)。然后,通过串联转染mRFP-GFP-MAP1LC3B /LC3B检测自噬通量。结果显示高糖处理后自噬小体和自噬溶酶体的形成都显著减少,表明自噬通路受损(Figure 2D-F)。为进一步验证该结论,在其余角质细胞系NHEK中重复实验,如Figure 2G-2K,结果得出一致的结论。随后用投射电子显微镜观察自噬水平,发现HaCaT细胞自噬活性在高血糖的短期慢性作用下受到明显抑制(Figure 2L)。糖尿病病人和非糖尿病人皮肤样本的免疫组化显示,在长期糖尿病皮肤表皮中发现SQSTM1和MAP1LC3B/ LC3B的表达均减少(Figure 2M,N)。综上,短期和长期高血糖均可诱导角化细胞中SQSTM1表达水平降低和自噬抑制。
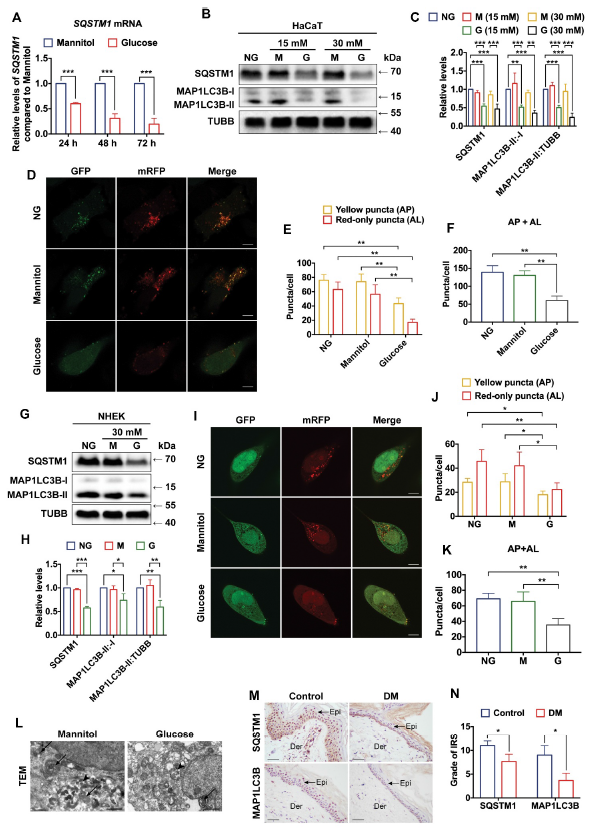
图2高糖诱导角化细胞SQSTM1下调和自噬通量受损
用siRNA构建SQSTM1敲除HaCaT细胞系(Figure 3A,B)。根据文献,作者决定研究SQSTM1对HaCaT细胞KEAP1-NFE2L2通路的影响。结果显示,敲除SQSTM1后HaCaT细胞中KEAP1表达上调,NFE2L2表达下调(Figure 3B,C),高糖处理后期表达趋势也如此(Figure 3D,E)。此外,敲除SQSTM1也导致自噬体形成抑制和自噬通量受损(Figure 3F-H)。这些结果表明SQSTM1在角质细胞自噬中的关键基因。

图3减少SQSTM1阻断角质细胞自噬通量
4、m6A reader蛋白YTHDC1与SQSTM1 mRNA的相互作用在高糖诱导的角质细胞中下降
随后检测发现高糖处理后SQSTM1 mRNA水平在细胞质和细胞核中都显著下降(Figure 4A)。前期研究表明,m6A参与了细胞核中转录后基因的调控,因此,采用RNA点杂交方法检测HaCaT细胞中m6A水平。观察发现,短期高糖处理后,HaCaT细胞中m6A水平显著降低(Figure 4B)。然后,细胞总RNA用于免疫沉淀m6A抗体,发现SQSTM1 mRNA被m6A抗体显著下拉(Figure 4C)。
在各种m6A阅读器中,核阅读器YTHDC1被认为具有多种作用,包括调节mRNA剪接、加速mRNA输出和加速转录本的衰退。因此,本研究假设YTHDC1参与了HaCaT细胞中SQSTM1表达的调控。首先,检测YTHDC1蛋白是否与SQSTM1 mRNA相互作用。RIP-qPCR实验表明,YTHDC1蛋白可与SQSTM1 mRNA相互作用(Figure 4D)。为了进一步证实这一结果,进行RNA亲和分离,验证了SQSTM1 mRNA与YTHDC1蛋白相互作用(Figure 4E)。然后,考虑YTHDC1的异常调节是否有助于HaCaT细胞中高糖诱导的SQSTM1的减少。为了研究这一假设,在HaCaT细胞中评估不同浓度的葡萄糖和甘露醇(渗透控制)处理48和72 h后YTHDC1的表达。与正常葡萄糖组和渗透对照组相比,短期中高糖和高糖处理组YTHDC1表达水平明显下调(Figure 4F,G)。同样,短期高糖处理导致NHEK细胞中YTHDC1下调(Figure 4H,I)。免疫组化染色结果显示,慢性高血糖作用下,糖尿病皮肤表皮中YTHDC1水平降低(Figure 4J,K)。这些结果表明,在短期和长期高血糖状态下,角化细胞中与SQSTM1 mRNA相互作用的m6A reader YTHDC1均降低。
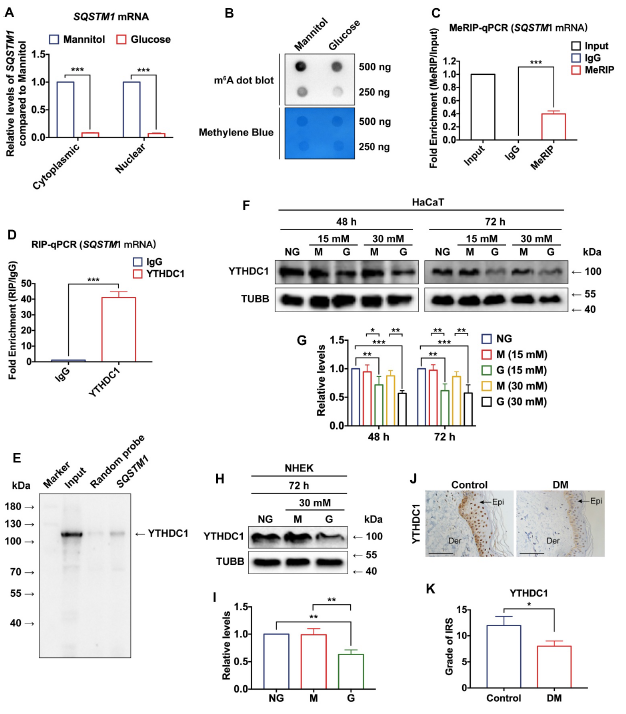
图4 m6A reader蛋白YTHDC1与角化细胞中的SQSTM1 mRNA相互作用
5、YTHDC1调节高糖处理的角质细胞中SQSTM1的表达和自噬通量
为了检测YTHDC1对胶质细胞的生物学功能的影响,用siRNA敲除HaCaT中其表达(Figure 5A,B)。敲除YTHDC1表达导致细胞的凋亡比例增加,伤口愈合能力下降(Figure 5C-F)。表明YTHDC1影响角质形成细胞的生物学功能。
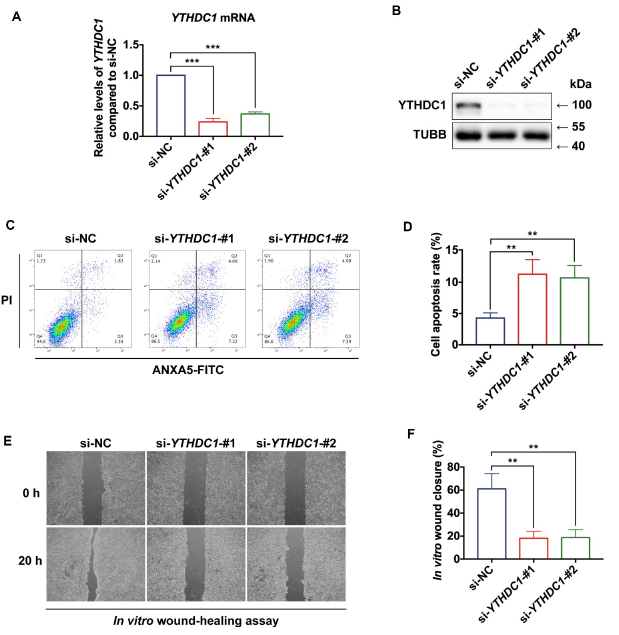
推测YTHDC1可能在调控SQSTM1表达中发挥作用。为了进一步阐明二者的关系,研究YTHDC1对SQSTM1的影响。发现YTHDC1基因敲低导致SQSTM1 mRNA和蛋白表达水平和MAP1LC3B/LC3B-II:-I比率显著降低,自噬体和自噬溶酶体的数量显著减少(Figure 6A-C),表明敲除YTHDC1损害了自噬通量。随后探究YTHDC1在高糖处理的角质细胞中对SQSTM1表达的调控作用。结果显示高糖处理导致的角质细胞中YTHDC1和SQSTM1表达以及MAP1LC3B/LC3B-II:-I比率下降可以被YTHDC1过表达挽救(Figure 6G,H)。此外,高糖诱导导致的自噬通量减少也可以被YTHDC1过表达挽救(Figure 6I-K)。以上表明YTHDC1调节高糖处理的角质细胞中SQSTM1的表达和自噬通量。

图6 YTHDC1的敲除降低了SQSTM1的表达和自噬通量
6、敲除YTHDC1可加速SQSTM1 mRNA的降解并抑制自噬通量
据报道,YTHDC1介导m6A修饰的mRNA的核输出。因此,评价了SQSTM1 mRNA的表达水平。令人惊讶的是,结果显示,敲除YTHDC1后,细胞核和细胞质中SQSTM1 mRNA均减少,但不影响ACTB和RNU6 1 mRNA在细胞核和细胞质中的相对表达水平(Figure 7A-C)。所以进一步检测敲除YTHDC1是否影响细胞核和细胞质中SQSTM1 mRNA的稳定性。用放线菌素D抑制HaCaT细胞的转录。敲除YTHDC1可促进细胞核中SQSTM1 mRNA的降解,但不影响细胞质中SQSTM1 mRNA的稳定性(Figure 7D, E)。这些数据揭示了YTHDC1在维持细胞核中m6A修饰的mRNA的稳定性方面的新作用。
已知ELAVL1是一种RNA稳定蛋白,可与含有m6A修饰的mRNA相互作用。因此,本研究探究YTHDC1是否与ELAVL1协同调控SQSTM1的表达。免疫共沉淀结果显示ELAVL1可与YTHDC1亲和分离,反之亦然(Figure 7F,G),提示YTHDC1可与ELAVL1相互作用。此外,RNA亲和分离和RIP-qPCR结果表明,ELAVL1与SQSTM1 mRNA相互作用(Figure 7H,I)。敲除ELAVL1基因导致SQSTM1 mRNA表达水平降低(Figure 7L)。这些数据表明,YTHDC1与ELAVL1相互作用并协同调节角质形成细胞中SQSTM1的表达。
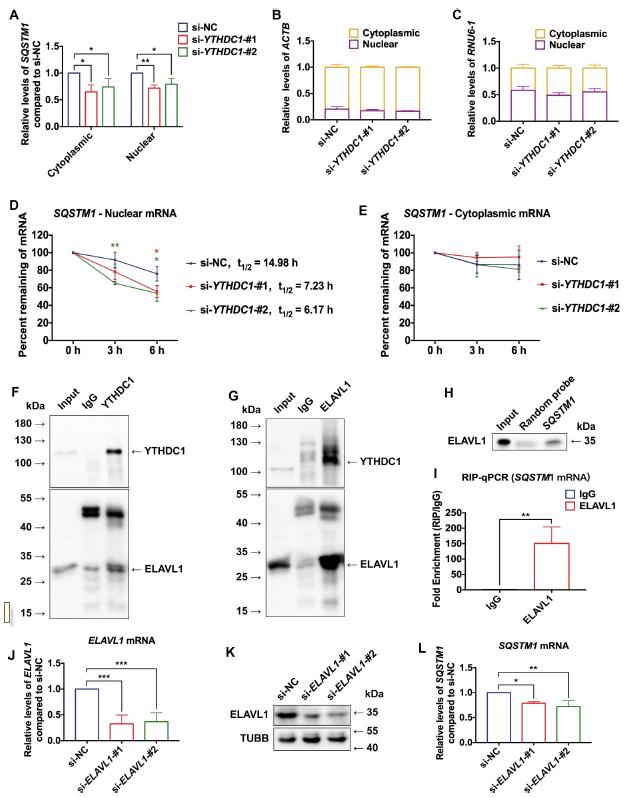
图7 YTHDC1协同ELAVL1调控SQSTM1的表达
7、下调YTHDC1可减少小鼠角质细胞的自噬并延迟伤口愈合
为了给YTHDC1和SQSTM1在高血糖慢性作用下糖尿病伤口愈合中的作用提供体内证据,对BKD-Leprem2Cd479/Nju (db/db)小鼠、糖尿病小鼠模型和年龄匹配的野生型(WT)小鼠进行研究。如免疫组化染色所示,与年龄匹配的WT小鼠相比,在db/db小鼠中检测到YTHDC1, SQSTM1和MAP1LC3B/LC3B的下调(Figure 8A,B)。并且db/db小鼠的创面愈合率明显延迟(Figure 8C,D)。为了研究YTHDC1和SQSTM1在皮肤创面愈合中的功能作用,采用siRNA的策略敲除小鼠皮肤中的内源性YTHDC1和SQSTM1基因(Figure 8E)。与WT-si-NC组相比,WT-si-Ythdc1组注射siRNA后YTHDC1、SQSTM1和MAP1LC3B/LC3B蛋白表达水平下调(图8F,G)。在WT-si-Sqstm1组中,与WT-si-NC组相比,注射si-Ythdc1组或si-Sqstm1组的SQSTM1和MAP1LC3B/LC3B蛋白表达水平都下调(Figure 8F,G)。还观察到注射si-Ythdc1或si-Sqstm1的小鼠皮肤创面愈合延迟(Figure 8H,I)。以上表明,在体内下调YTHDC1可减少小鼠角质细胞SQSTM1表达和自噬并延迟伤口愈合。
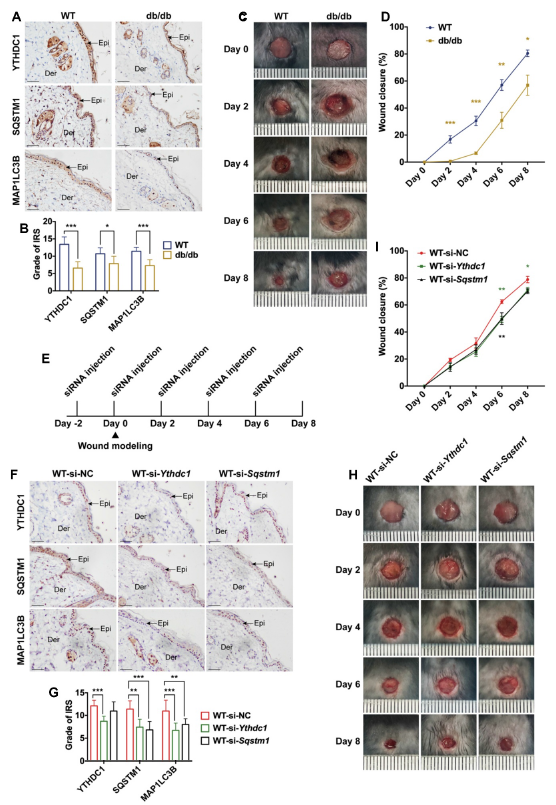
图8降低YTHDC1表达抑制角质细胞的自噬和延迟糖尿病小鼠伤口愈合
参考文献:
Liang Diefei., Lin Wei-Jye., Ren Meng., Qiu Junxiong., Yang Chuan., Wang Xiaoyi., Li Na., Zeng Tingting., Sun Kan., You Lili., Yan Li., Wang Wei.(2021). mA reader YTHDC1 modulates autophagy by targeting SQSTM1 in diabetic skin. Autophagy, undefined(undefined), 1-20. doi:10.1080/15548627.2021.1974175






