CircRNA-DOPEY2增强食管癌细胞的化疗敏感性
以顺铂为基础的化疗是晚期食管鳞癌(ESCC)的主要系统治疗方法,而顺铂耐药并不少见,是改善患者预后的主要障碍。circRNAs是一种新型非编码RNA,与癌症进展有关,但它们在ESCC中调节顺铂反应的作用尚不清楚。我们提供的证据表明,cDOPEY2通过促进CPEB4的泛素化和降解来抑制CPEB4介导的Mcl-1翻译,从而缓解顺铂耐药,表明cDOPEY2可能在ESCC中作为有价值的生物标志物和潜在的治疗靶点。本文于2021年11月发表在“Journal of Experimental & Clinical Cancer Research”(IF: 11.161)期刊上。
技术路线

结果
1)cDOPEY2在顺铂耐药ESCC细胞中下调及其特性
为了探索ESCC细胞顺铂耐药的分子机制,我们首先建立了两种顺铂耐药ESCC细胞系(Eca109-CR和TE1-CR)。如图1A所示,两种顺铂耐药细胞株在顺铂处理后的存活率均高于亲本细胞。我们分析了来自GEO数据集(GSE131969)的circRNA在ESCC中的表达谱(图1B)。在5个上调最高和5个下调最高的circRNA中,根据RNase R处理结果显示7个是真实的circRNA (图1 C)。我们进一步通过qRTPCR验证了这些circRNAs在Eca109-CR/Eca109和TE1-CR/TE1细胞中的表达,发现与顺铂耐药细胞相比,只有来自DOPEY2基因的hsa_circ_0008078在顺铂耐药细胞中一致且显著下调(图1D)。因此,我们进一步研究了hsa_ circ_0008078,命名为cDOPEY2,在ESCC细胞顺铂耐药中的作用。来自circBase的注释揭示了cDOPEY2起源于DOPEY2基因在第20 ~ 24外显子之间的反向剪接(图1E)。接下来,我们利用几种方法来描述cDOPEY2的性质。我们首先通过Sanger测序确定了cDOPEY2的反向剪接位点(图1F),然后使用不同的引物从cDNA中扩增cDOPEY2,而不是从gDNA中扩增(图1 G)。接下来,进行放线菌素D处理,证实cDOPEY2比其亲本宿主基因更稳定(图1H)。此外,与oligo (dT)引物反转录的样品相比,cDOPEY2在随机六聚体反转录的样品中显著富集(图1I)。亚细胞片段的qPCR和FISH分析显示cDOPEY2主要位于细胞质中(图1 J-K)。此外,对ESCC细胞株中cDOPEY2表达的评估显示,与正常食管鳞状上皮细胞株HECC和Het-1a相比,cDOPEY2在顺铂耐药细胞中不仅显著下调,而且在ESCC细胞株中也显著降低(图1 L)。这些结果揭示了一种新的环状RNA (cDOPEY2)在顺铂耐药的ESCC细胞中下调,表明cDOPEY2在介导顺铂耐药中有潜在的抑制作用。

2)cDOPEY2通过增强顺铂诱导的ESCC细胞凋亡来降低顺铂耐药
我们通过在顺铂耐药细胞中过表达cDOPEY2,并在顺铂敏感细胞中沉默cDOPEY2,研究了cDOPEY2对ESCC顺铂耐药的影响。细胞活力和集落形成试验显示,cDOPEY2高表达可使顺铂耐药ESCC细胞对顺铂治疗明显敏感,而cDOPEY2耗尽则对亲代ESCC细胞产生相反的影响(图2 A-B),表明cDOPEY2在缓解顺铂耐药中发挥重要作用。我们进一步通过Annexin-V/PI染色评估顺铂诱导的凋亡,清楚地显示cDOPEY2过表达在顺铂耐药细胞中促进了顺铂介导的凋亡(图2 C-D)。一致地,cDOPEY2在顺铂处理的细胞中增强了caspase-3活性(图2E)。由于顺铂通过诱导复制叉停止杀死肿瘤细胞,并随后引起复制应激,我们下一步通过γ-H2AX染色研究cDOPEY2是否影响肿瘤细胞的DNA损伤。虽然与亲代细胞相比,顺铂耐药细胞的γ-H2AX染色明显降低,但cDOPEY2并不影响顺铂诱导的DNA损伤(图2F)。我们通过测定DNA损伤修复(DDR)通路的激活获得了类似的结果(图2G)。WB进一步检测Bcl-2家族抗凋亡调节蛋白的丰度,发现cDOPEY2上调可显著降低抗凋亡Mc1-1的表达。然而,其他抗凋亡蛋白,Bcl-xL和Bcl-2,在cDOPEY2改变后没有变化(图2H)。这些结果表明,cDOPEY2在缓解ESCC对顺铂的耐药中发挥了重要作用,这种作用可能是通过增加顺铂诱导的凋亡过程而发挥的。接下来,我们通过检测食管鳞癌患者临床样本中cDOPEY2的表达来探索其临床意义。与邻近的非肿瘤组织相比,81%的ESCC样本中cDOPEY2显著下调(图2I)。在第二组接受顺铂治疗的晚期ESCC患者中,与cDOPEY2肿瘤高表达患者相比,肿瘤样本中cDOPEY2低表达与较低的缓解率和较差的无进展生存期(PFS)显著相关(图2J-K)。这些发现表明cDOPEY2有潜力成为预测ESCC患者顺铂反应性疗效的合适标志物。
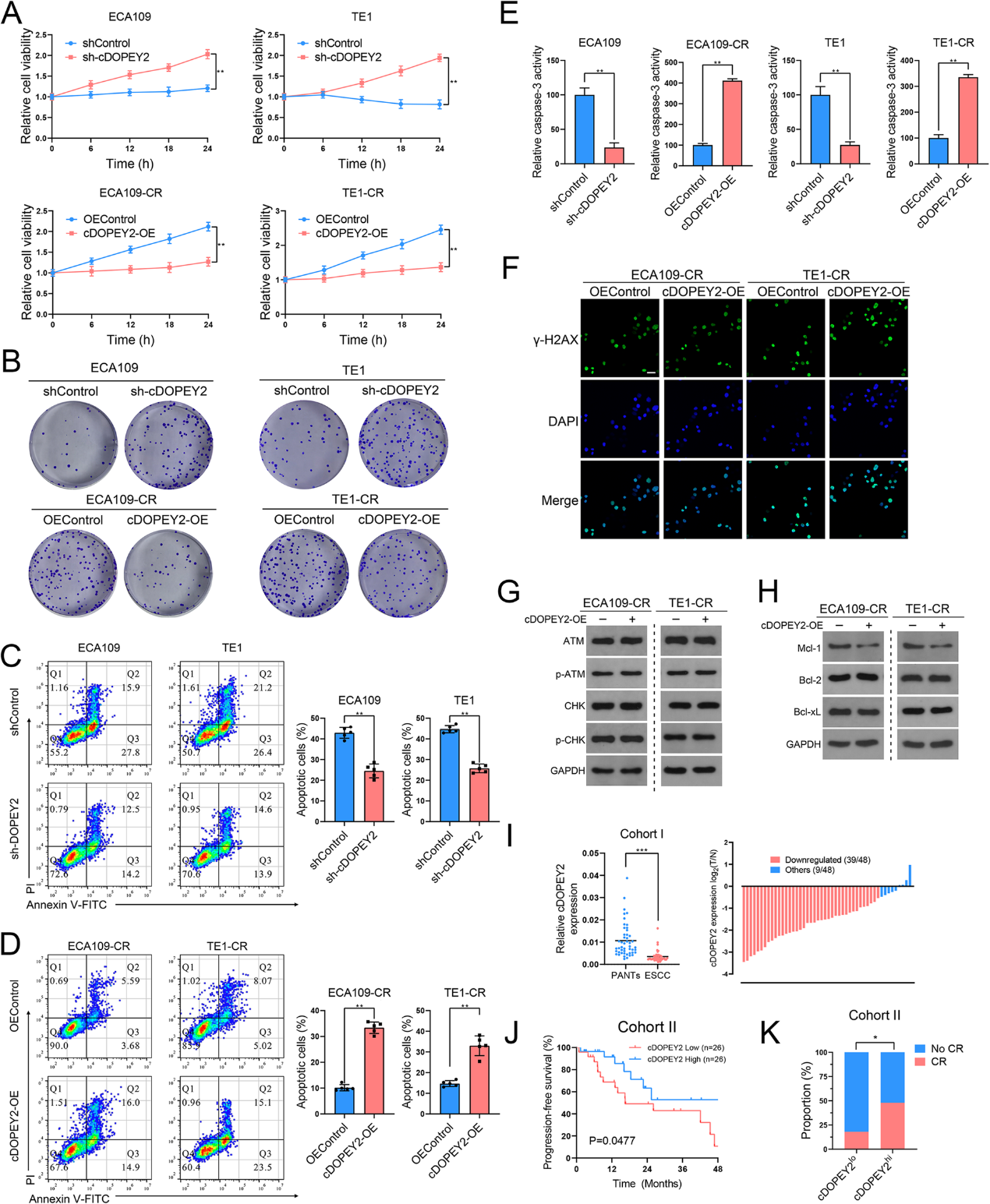
3)cDOPEY2与RNA结合蛋白CPEB4发生物理作用
我们进一步剖析了cDOPEY2减轻ESCC细胞顺铂耐药的机制。首先,我们确定cDOPEY2主要定位于细胞质,如图1 J-K所示。然而,AGO2 RIP显示cDOPEY2没有与AGO2共免疫沉淀,这表明它可能不作为竞争性RNA。第二,cDOPEY2未发现潜在的开放阅读框或内部核糖体进入位点序列。第三,cDOPEY2不能影响其宿主基因DOPEY2的表达。综上所述,我们假设cDOPEY2在细胞质中起蛋白质支架的作用。为了验证我们的假设,我们进行RNA下拉实验和质谱分析(图3A-B)。我们对cDOPEY2过表达的Eca109-CR细胞提取物进行质谱分析,并与对照细胞比较,共鉴定出39个异常蛋白(图3D)。GO分析显示,这些蛋白与药物响应和凋亡调控显著相关(图3C)。在cDOPEY2富集量最高的10个蛋白中,只有CPEB4受到cDOPEY2的显著调控(图3E)。cDOPEY2具有CPEB4的结合序列(UUUUA)(图3 F)。此外,CPEB4在cDOPEY2过表达后表现出最显著的差异表达(图3D)。这些结果强烈提示CPEB4不仅与cDOPEY2结合,而且受cDOPEY2调控。因此,我们通过RNA下拉和RIP实验证实了cDOPEY2和CPEB4之间的相互作用(图3G-H)。此外,RNA FISH免疫荧光分析显示cDOPEY2与细胞质中的CPEB4蛋白共定位(图3I)。CPEB4的RNA识别基序(RRMs)是CPEB4与含有UUUA序列的RNA相互作用所必需的。为了进一步阐明CPEB4和cDOPEY2之间的结合机制,我们构建了一些缺失RRM1、RRM2或两者都缺失的CPEB4的截短片段(图3J)。RIP证明CPEB4和cDOPEY2的结合需要两个RRMs,因为RRM1和RRM2的删除降低了cDOPEY2和CPEB4的结合水平,同时删除两个RRMs完全丧失了它与cDOPEY2的结合能力(图3K)。为了确认cDOPEY2是否通过其UUUUA序列与CPEB4相互作用,我们将cDOPEY2 UUUUA序列突变为GACCG,这显著减少了CPEB4与cDOPEY2的相互作用(图3 L)。这些数据证实了CPEB4与cDOPEY2物理结合。
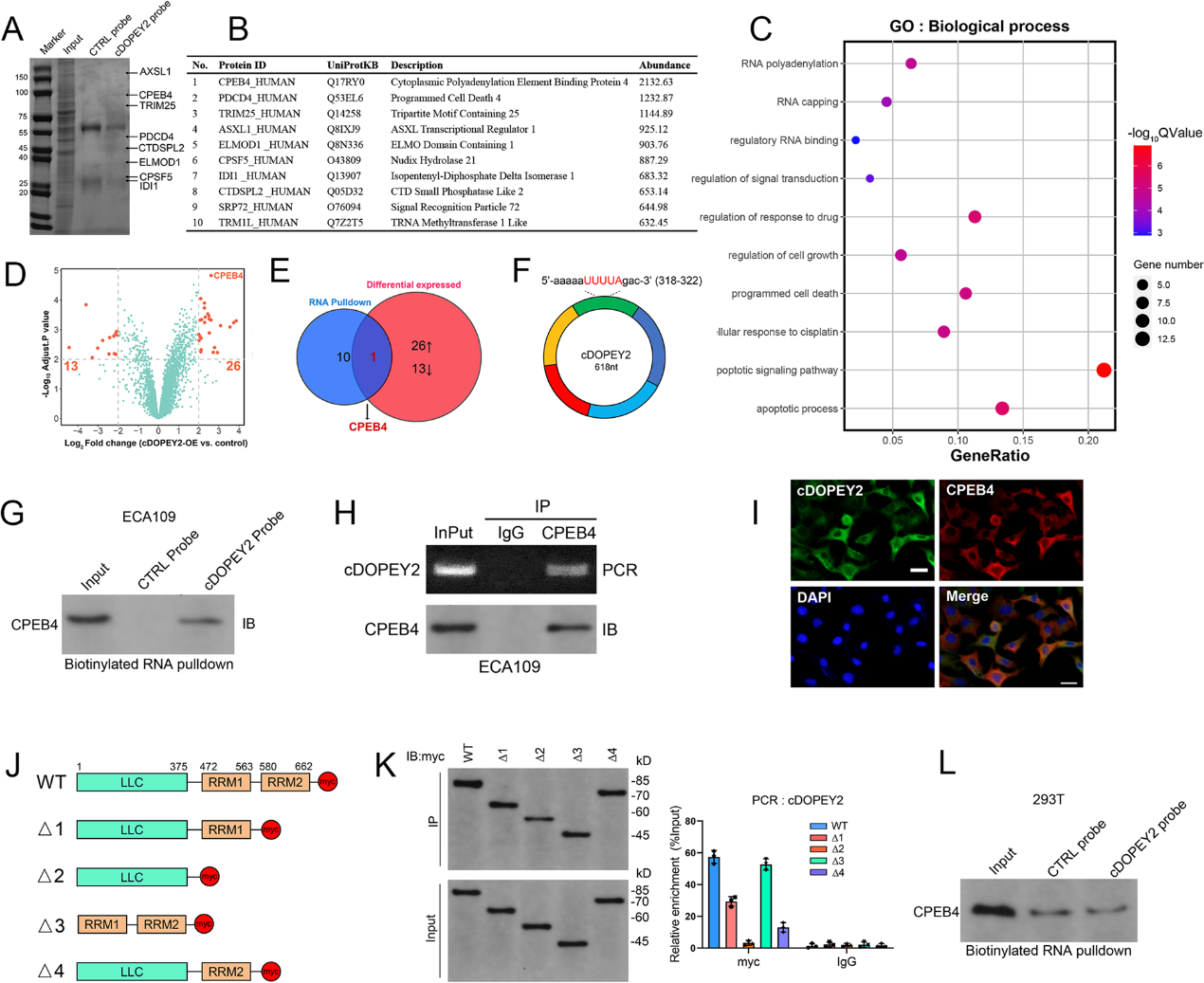
4)CPEB4是一种癌基因,可增强ESCC细胞中的顺铂耐药,并被cDOPEY2靶向
TCGA数据集的生存分析证实了CPEB4在ESCC中的致癌作用(图4A)。此外,ESCC样本中的CEPB4蛋白水平远高于邻近的非肿瘤组织(图4B)。为了确定CPEB4的耗尽是否介导cDOPEY2的化疗敏感效应,我们首先检测了CPEB4在顺铂耐药细胞中的表达。WB结果显示,与亲代细胞相比,顺铂耐药细胞中CPEB4的表达显著增加,而cDOPEY2过表达降低了CPEB4的表达。而cDOPEY2沉默增加了CPEB4的表达(图4C)。我们进一步在顺铂耐药的ESCC细胞中过表达CPEB4,并在亲代细胞中沉默CPEB4。cDOPEY2在亲代Eca109细胞中敲低显著增加了顺铂治疗后的细胞活力和克隆形成能力,而cDOPEY2沉默诱导的化疗耐药性在敲低CPEB4后几乎受损。相反,TE1-CR细胞过表达cDOPEY2后对顺铂敏感性的增强在很大程度上被CPEB4的过表达所挽救(图4D-E)。在顺铂诱导的细胞凋亡方面,通过Annexin-V/PI FACS分析和caspase-3活性可以看出,cDOPEY2缺失导致亲本ECA109细胞获得顺铂耐药,而这些作用在CPEB4敲低后基本被消除。我们在TE1-CR细胞中观察到类似的结果,过表达CPEB4极大地恢复了过表达cDOPEY2细胞的顺铂耐药(图4F-G)。CPEB4敲低后,cDOPEY2耗尽诱导的抗凋亡蛋白Mcl-1的表达明显被阻断,而CPEB4过表达则完全逆转了cDOPEY2抑制的Mcl-1的表达(图4 H)。这些数据提示cDOPEY2通过抑制CPEB4使ESCC细胞对顺铂致敏。

5)cDOPEY2通过增强CPEB4蛋白的泛素化来降低其稳定性
如图4C所示,虽然cDOPEY2负调控CPEB4的蛋白表达,但cDOPEY2对CPEB4的mRNA表达没有显著影响(图5A)。我们还发现沉默cDOPEY2提高了CPEB4蛋白的稳定性(图5B)。此外,在过表达cDOPEY2的细胞中,CPEB4蛋白表达的降低被蛋白酶体抑制剂MG132完全逆转(图5C)。因此,我们推测cDOPEY2可能通过增强CPEB4泛素/蛋白酶体依赖性的降解而降低CPEB4的稳定性。与我们的假设一致,cDOPEY2过表达强烈促进了CPEB4的泛素化,而cDOPEY2敲低则显著抑制了这一现象(图5E)。这些数据表明cDOPEY2通过诱导CPEB4的泛素化而抑制CPEB4。
我们进一步探索了E3连接酶,负责cDOPEY2介导的CPEB4的泛素化。在MS检测到的与cDOPEY2共沉淀的所有蛋白中,只鉴定到一种E3连接酶TRIM25(图3 A-B,5D)。此外,TRIM25在蛋白水平上负调控CPEB4的表达,而不在mRNA水平上负调控(图5F)。据报道,TRIM25的RNA结合活性对其靶向蛋白的有效泛素化至关重要。RNA FISH免疫荧光分析显示cDOPEY2与TRIM25在细胞质中共定位(图5G), RIP和RNA下拉实验证实了cDOPEY2与TRIM25的结合(图5 H)。cDOPEY2过表达显著增强了TRIM25对CPEB4降解的影响。而TRIM25的敲除在很大程度上逆转了cDOPEY2介导的效应(图5I)。这些结果表明cDOPEY2可能作为支架增强TRIM25与CPEB4之间的相互作用。然后我们探究TRIM25对CPEB4的泛素连接酶活性是否依赖于cDOPEY2。为了实现这一目标,我们构建了一个myc标记的TRIM25片段,其中一部分RBD被删除(ΔRBD, 470-508 aa删除,图5 L)。IP分析证实,RBD的删除严重削弱了TRIM25与CPEB4结合的能力,而RNase A(一种阻断cDOPEY2与TRIM25相互作用的RNA外切酶)处理和cDOPEY2沉默也削弱了TRIM25与CPEB4之间的相互作用(图5 K)。值得注意的是,转染缺乏RBD的TRIM25、RNase A处理和cDOPEY2敲除均削弱了TRIM25对CPEB4降解和泛素化的影响(图5 J,M)。总的来说,cDOPEY2作为支架增强TRIM25和CPEB4之间的相互作用,从而增强TRIM25依赖的泛素化和蛋白酶体降解。

6)CPEB4通过促进抗凋亡蛋白Mcl-1的翻译上调其表达
如图2H所示,cDOPEY2降低了抗凋亡蛋白Mcl-1的表达。因此,我们想知道cDOPEY2对Mcl-1的抑制作用是否通过其下游靶基因CPEB4的表达减少来介导。重要的是,CPEB4过表达或沉默后Mcl-1蛋白表达的上调或下调并未在mRNA水平上被证实,这表明CPEB4介导的Mcl-1调控是在转录后水平上被调控的(图6A-B)。CPEB4促进细胞质多聚腺苷酸化和含有细胞质多聚腺苷酸化元件(CPE)的mRNA的翻译激活。值得注意的是,由于我们在Mcl-1 mRNA的3'UTR中发现了几个CPE(图6 C),我们推测CPEB4通过促进Mcl-1的翻译上调了Mcl-1的表达。为了支持这种可能性,RIP分析证实了CPEB4和Mcl-1 mRNA之间的相互作用(图6D-E)。此外,虫草素(一种已知的CPEB4介导的聚腺苷酸化抑制剂)处理降低了Mc1-1的蛋白表达,并伴有cleaved caspase-3的表达增加,这些效应是剂量依赖的(图6f)。FISH免疫荧光检测证实CPEB4与ESCC组织中的Mc1-1 mRNA共定位(图6G)。我们通过核糖体富集实验验证CPEB4对Mcl-1翻译的调控作用。与对照细胞相比,在过表达CPEB4的细胞中,Mcl-1 mRNA的分布从轻聚体转移到重聚体,而CPEB4沉默将含有Mc1-1 mRNA的部分从轻聚体转移到单聚体(图6 H),证实了CPEB4通过促进Mcl-1的翻译上调了Mcl-1的表达。通过细胞活力、菌落形成和凋亡检测,Mcl-1过表达显著挽救了CEPB4沉默对顺铂耐药的影响(图6I-K)。此外,消耗Mcl-1完全消除了CPEB4诱导的增强化疗耐药性(图6 K-M)。我们还分析了临床样本中CPEB4、cDOPEY2和Mcl-1的共表达模式,发现在队列I中,CPEB4蛋白水平与cDOPEY2 RNA水平呈负相关,但与Mcl-1蛋白丰度呈正相关(图6O)。综上所述,这些结果表明cDOPEY2通过抑制CPEB4诱导的Mcl-1翻译而增加了ESCC中的顺铂耐药。
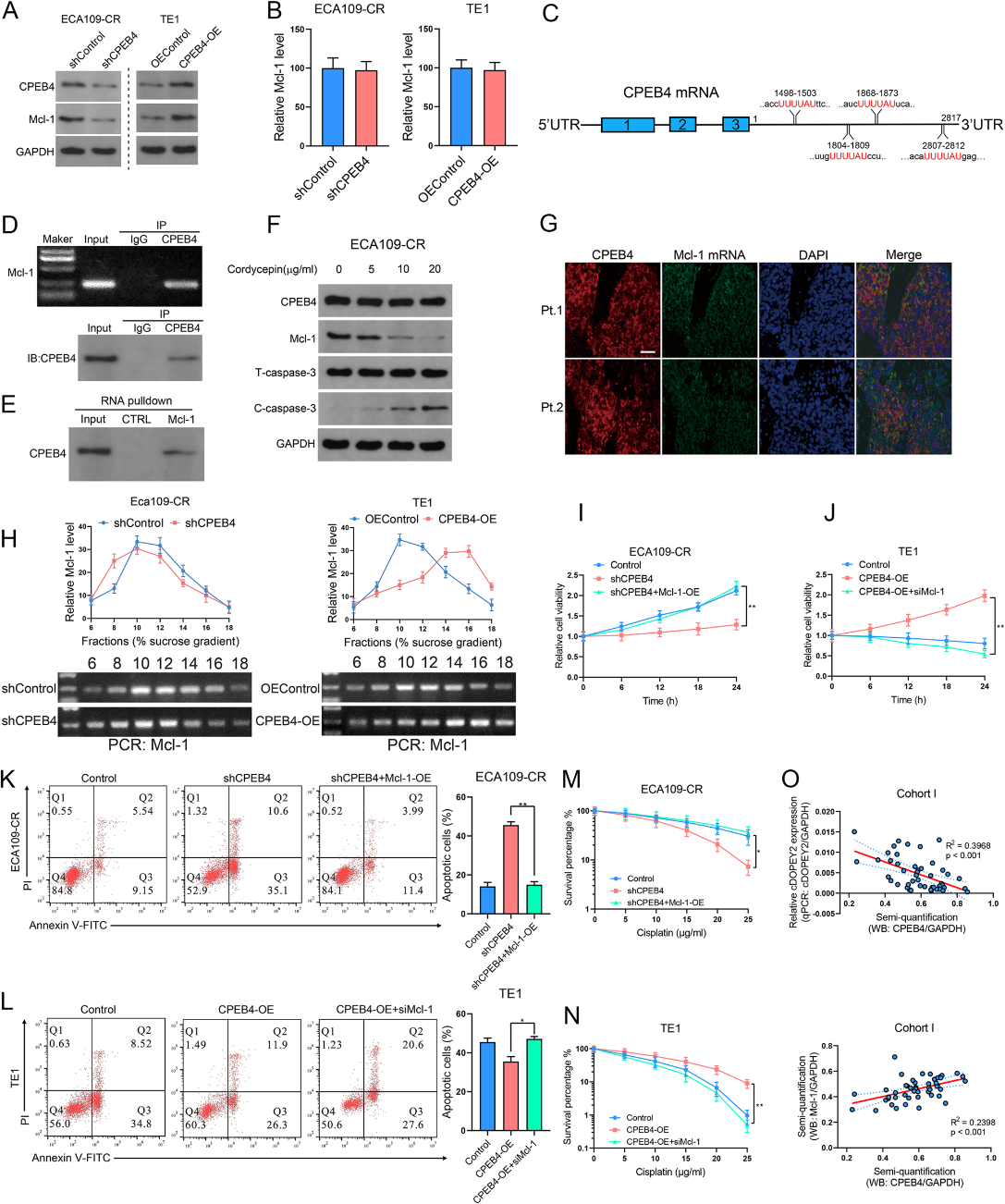
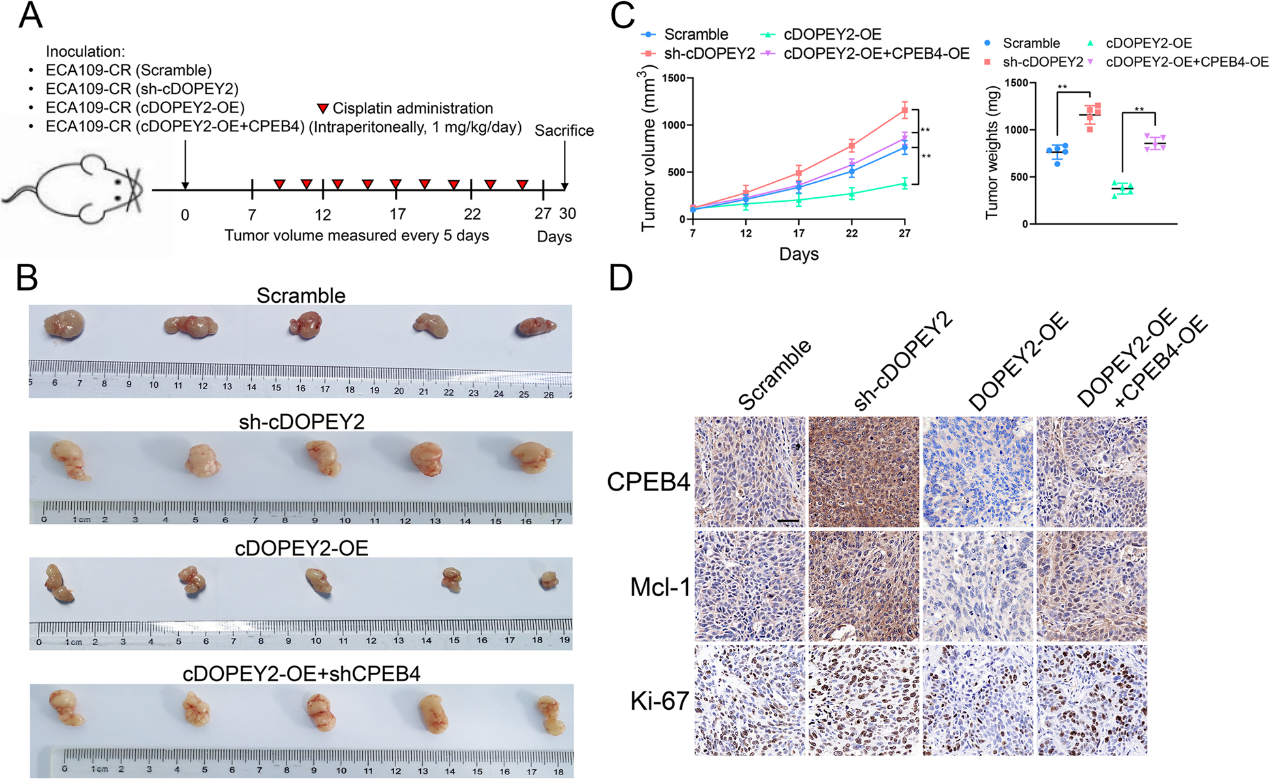
7)cDOPEY2抑制ESCC异种移植细胞的致瘤性并提高顺铂敏感性
我们验证了cDOPEY2在体内对ESCC的生物学影响。小鼠每2天腹腔注射顺铂(图7A)。结果表明,沉默cDOPEY2进一步增强了Eca109-CR细胞的耐药能力。相反,接种cDOPEY2过表达细胞的裸鼠对顺铂耐药表现出明显的敏感性,而在cDOPEY2过表达细胞中重新表达CPEB4则完全消除了cDOPEY2介导的效应(图7B-C)。与体外结果一致,免疫组化证实与scramble组相比,sh-cDOPEY2组Mcl-1和CPEB4表达增加,过表达cDOPEY2组表达减少(图7D)。总的来说,我们的结果显示,cDOPEY2作为支架,以TRIM25依赖的方式促进CPEB4的泛素化和降解,从而通过抑制CPEB4促进Mcl-1翻译,减轻ESCC细胞中顺铂耐药从而促进顺铂诱导的凋亡(图8)。
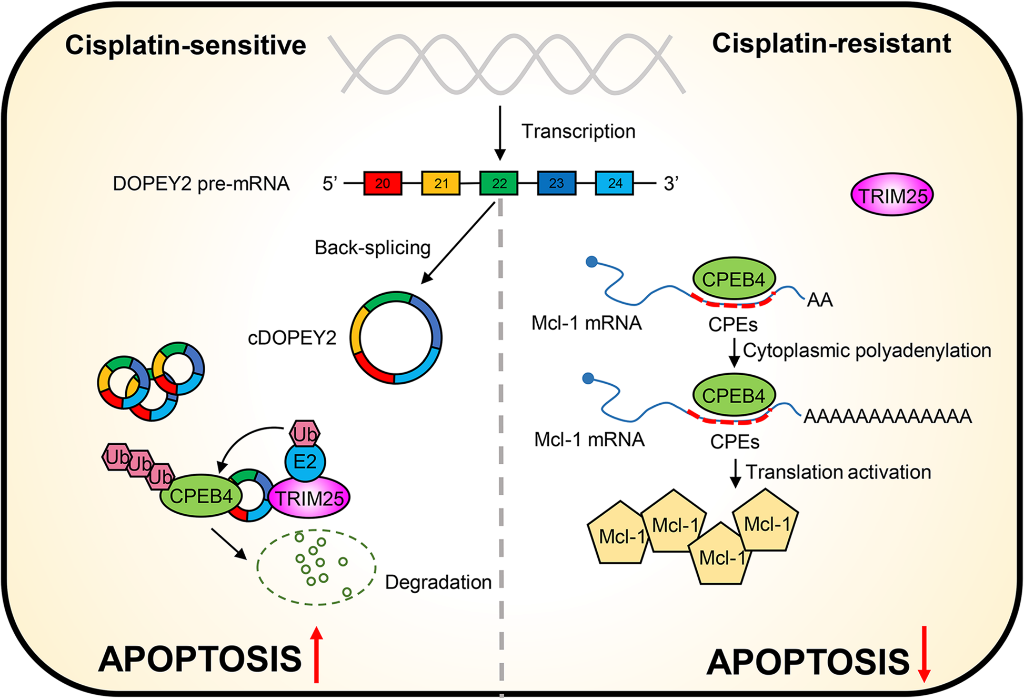
结论:我们提供了第一线综合证据,证明cDOPEY2是维持顺铂敏感性的关键circRNA,也是ESCC的诊断/预后生物标志物。cDOPEY2通过形成CPEB4/cDOPEY2/TRIM25三元复合物,促进CPEB4的泛素化,进而拮抗CPEB4介导的Mcl-1翻译,从而增强顺铂诱导的细胞凋亡和化疗敏感性。我们的研究提供了一个潜在的靶点cDOPEY2,以拓宽管理策略,提高顺铂干预ESCC患者的临床疗效。
参考文献:
Liu Z, Gu S, Wu K, Li L, Dong C, Wang W, Zhou Y. CircRNA-DOPEY2 enhances the chemosensitivity of esophageal cancer cells by inhibiting CPEB4-mediated Mcl-1 translation. J Exp Clin Cancer Res. 2021 Nov 15;40(1):361. doi: 10.1186/s13046-021-02149-5. PMID: 34781999; PMCID: PMC8591801.






