SNRK对circ-SNRK的负反馈调节心肌梗死后心功能
心力衰竭(Heart failure,HF)作为一种慢性疾病威胁着人们的健康。作者认为预防心肌梗死后心肌细胞(CMs)丢失的研究可能会降低HF的发生率,从SNRK(蔗糖非发酵1相关激酶,可增加心脏线粒体效率)中鉴定出一个与HF相关的circRNA ,circ-SNRK,并阐明其调节机制。
技术路线:

主要结果:
采用左冠状动脉前降支结扎法建立大鼠心衰模型,并通过超声心动图及心脏大体形态确保模型构建成功(Fig. 1A)。根据超声心动图结果将大鼠分为对照组、补偿(Comp)组、失代偿性(Decomp)组。术后4周(Ctrl + Comp组)及6周(Decomp组)采集心脏,样品处理后进行高通量测序。在Ctrl vs Decomp和Comp vs Decomp分别筛选出923,1710个差异表达circRNA(fold change >2.0和p < 0.05)。此外,3组中存在507 个共有的circRNA,其中有498个circRNA在对照组和补偿组表达丰度相似(Fig 1B)。将其进行GO及KEGG分析发现其中有43个circRNA参与了缺血相关通路(Fig 1C)。最后,通过FACS实验检测细胞凋亡,circ-SNRK在心肌细胞中表现出相对高的表达,并且与细胞凋亡密切相关(Fig. 1D)。
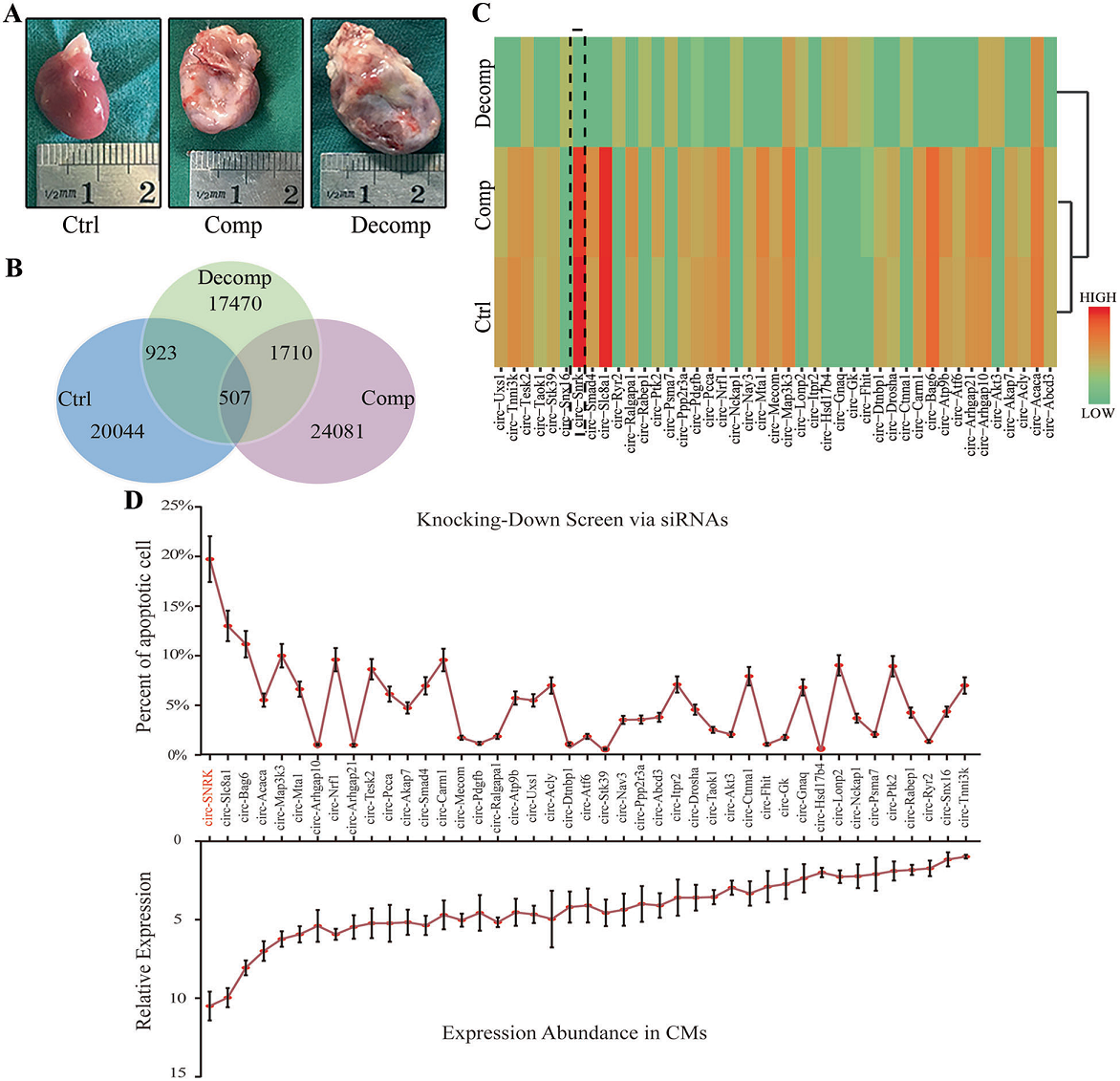
图1 circ-SNRK的鉴定
2. circ-SNRK的特性及其对心肌细胞的影响
Sanger测序及RNase R实验证实了circ-SNRK存在于心肌细胞中(Fig. 2A–C)。作者还发现,circ-SNRK在不同的器官中均有表达,在细胞质中有残基,且不随年龄变化(Fig. 2D, E)。qRT-PCR显示,circ-SNRK在衰竭大鼠心脏中显著降低,这与RNA-seq数据一致。心脏缺血对心肌细胞的主要影响是会造成氧、葡萄糖不足。我们的数据显示在低氧处理下的乳鼠心肌小鼠的线性SNRK(mRNA)和pre-SNRK (precursor mRNA) 呈先上升后下降的趋势,而circ-SNRK仅呈下降趋势。而低血糖(<1 g/L)对其无明显影响(Fig. 2A/F)。
为进一步研究其生理功能,作者分别用pGV486、siRNA来上调、下调circ-SNRK。Northern blot和RT-PCR结果显示pGV486-circ-SNRK转染HEK293细胞后可检测circ-SNRK,只有circ-SNRK(而不是前SNRK或线性SNRK)被si-circ-SNRK下调。转染后24 h,circ-SNRK 达到峰值(~25%),且其降解率低于线性SNRK。此外,我们发现circ-SNRK可以增加能量产生(Fig. 2G–I),能改善细胞凋亡,但对细胞自噬和焦亡无明显作用。已有研究发现,circ-SNRK能通过SNRK蛋白作为能量调节器抑制细胞凋亡,于是作者主要关注其生理功能。

3. MiR-33通过SNRK介导circ-SNRK与ATP合成
之前在细胞质中发现circ-SNRK的残基,暗示它可能通过其翻译的多肽或作为miRNAs海绵发挥其功能。在发现它包含一个开放阅读框后,作者将重构的带有His标签的circ-SNRK克隆到pGV486中。线性化ORF加上His标签作为阳性控制。免疫印迹和免疫染色均未观察到肽(~32 kDa),提示circ-SNRK在心肌细胞中不能转化为肽。
接下来,作者推测miR-33可能是circ-SNRK的靶向的基因(Fig 3A)。双荧光素酶报告基因和FISH检测证实circ-SNRK可直接与miR-33结合(Fig. 3B)。同时,我们对AGO2进行RIP检测,发现与对照组相比,circ-SNRK表达量明显升高,进一步表明circ-SNRK可直接与miR-33 结合(Fig. 3C)。
接下来,作者发现miR-33可以降低心肌细胞中ATP和金属蛋白酶(MMP)的合成,而miR-33抑制剂则有相反的作用(Fig. 3D)。此外,mut-circ-SNRK(没有miR-33结合位点)对ATP合成和MMP的影响与pGV486-NC相似,而circ-SNRK的降低作用能被miR-33抑制剂挽救(Fig. 3E)。这些结果表明,miR-33介导circ-SNRK影响心肌细胞。
接下来,作者检测了circ-SNRK是否通过SNRK调节能量代谢。结果发现,在小鼠中,circ-SNRK过表达会增加SNRK蛋白,circ-SNRK低表达会降低的SNRK蛋白的表达。同时, circ-SNRK引起的SNRK上调可以通过miR-33改善,而miR-33抑制剂可以挽救降低的SNRK。因此,circ-SNRK通过miR-33影响SNRK表达。然后,将缺氧处理的小鼠心肌细胞。通过转染pGV486-circ- SNRC和si-SNRK或者si-circ-SNRK 和Ad-SNRK,作者发现,circ-SNRK过表达对ATP产生的影响被SNRK敲低所抑制,而circ-SNRK低表达的影响被SNRK过表达所回避(Fig. 3G)。说明circ-SNRK可以通过受miR-33 -SNRK轴,进而影响ATP合成。
Fig3 MiR-33通过SNRK连接环状SNRK与ATP合成
4. NOVA1促进circ-SNRK的形成,并直接与侧翼内含子结合
鉴于miR-33可以提高circ-SNRK水平,而蛋白SNRK是miR-33的靶点,推测SNRK可能影响circ-SNRK的环化形成。qRT-PCR结果显示,在心肌细胞中,circ-SNRK被si-SNRK上调,被Ad-SNRK下调,暗示SNRK在circ-SNRK的形成中起作用。
考虑到SNRK与circ-SNRK呈反向变化模式,它不应该直接连接到pre-circ-SNRK上,因为直接的相互作用会增加circ-SNRK的形成。为了识别连接SNRK和circ-SNRK的蛋白,通过侧翼分析找到3个可能连接SNRK和circ-SNRK的RNA结合蛋白。进一步检测,qRT-PCR结果显示,只有si-NOVA1能降低Lnc-SNRK水平(图4 b)。此外,我们检测到在心肌细胞中过表达NOVA1会提高circ-SNRK表达水平 (图4C)。以上结果表明,与SNRK蛋白不同,NOVA1可以促进circ-SNRK的形成。
通过分析pre-circ-SNRK的侧翼内含子,作者在5 '内含子中发现了1个NOVA1的潜在结合位点,在3 '内含子中发现了3个NOVA1的潜在结合位点(Fig 4 d)。为了验证相互作用,作者使用NOVA1的RIP,检测了所有预测位点的序列(Fig 4E)。用生物素标记的RNA作为诱饵,检测是否可以拉下NOVA1,结果所有位点均显示阳性结果(Fig 4F)。表明NOVA1可以绑定到pre-circ-SNRK侧翼,并对circ-SNRK有影响。
为了解NOVA1是否影响circ-SNRK的形成,作者将带有NOVA1结合位点(wt或mut)的pre-circ-SNRK克隆到质粒(pCMV-wt-pre-circ-SNRK, pCMV-mut-pre-circ-SNRK)中,然后将其转染到si-NOVA1处理过的HEK293中。两种情况下均未观察到circ-SNRK。然而,NOVA1过表达仅挽救了转染了pCMV-wt-pre-circ-SNRK的HEK293的circ-SNRK,提示了NOVA1在circ-SNRK形成中的必要性(Fig. 4G)。
在PDB蛋白结构数据库中观察NOVA1结构,发现了NOVA1有超过两个相似的RNA结合基序。此外,native PAGE的结果显示,NOVA1可以在NRCMs中形成二聚体(图4H)。于是推断NOVA1具有促进circ-SNRK形成的能力。最后,作者发现蛋白NOVA1在缺氧状态下没有明显变化,提示NOVA1在上述情况下能够发挥其功能(Fig. 4I)。

Fig. 4 NOVA1促进circ-SNRK的形成,并直接与侧翼内含子结合
5. SNRK的55 kDa肽段能与NOVA1连接并影响circ-SNRK的形成
通过qRT-PCR实验发现过表达NOVA1可以挽救circ-SNRK的下降,而Ad-SNRK的低表达则有相反的作用,提示SNRK通过NOVA1影响circ-SNRK的形成(Fig 5A)。进一步研究发现NOVA1 mRNA不受SNRK蛋白的影响(Fig 5B)。接下来进行SNRK的免疫共沉淀实验,发现NOVA1被下拉(Fig 5C),NOVA1的下拉肽分子量为55 kDa,可被SNRK抗体所识别,说明它是SNRK蛋白的一部分(Fig 5D)。构建pCMV-N-His-SNRK和pCMV-SNRK-C-His探索其肽端,通过液相色谱串联质谱分别发现了约30 kDa和55 kDa肽段(Fig 5E),进一步分析SNRK的结构(Fig 5F),最终发现这个55kDa的肽段属于SNRK的C端。
已有研究表明,SNRK与细胞死亡有关,两个结构域的连接包含Asp残基(Caspases的底物),这都表明SNRK可能被Caspases降解。用Z-vad (Caspases的全局抑制剂)培养NRCMs 48小时,发现其55kda肽显著下调(Fig 5G),进一步利用SNRK作为诱饵来鉴定哪些Caspase (Caspase 3/6/7)在这里发挥作用,发现只有Caspase 3参与其中和SNRK结合(Fig. 5H)。最后,作者通过 si-Caspase 3降低了NRCMs中的Caspase 3,发现55kda肽水平随时间的增加而降低;然而,整体SNRK增加(图5I)。综上所述,SNRK可以被激活的Caspase 3降解分为两个肽段,其中的55kda肽段直接与NOVA1相互作用。
此外,在Z-vad处理后,将pCMV-SNRK或pCMV-55kDa转染新生大鼠心肌细胞48小时,探索55kDa肽能否影响circ-SNRK的形成,qRT-PCR显示circ-SNRK仅受55 kDa肽影响(Fig 5J)。免疫荧光实验显示C端肽位于细胞质和细胞核中,而N端肽仅残基在细胞质中,表明只有55 kDa肽能进入细胞核(Fig 5K)。研究SNRK如何调节NOVA1对circ-SNRK形成的影响,用放线菌素D处理在NACM中上调或下调55 kDa肽,发现NOVA1蛋白没有明显变化,提示55 kDa肽对NOVA1的稳定性没有影响(图5L)。转染和qRT-PCR实验推测NOVA1与55 kDa肽的相互作用可以抑制NOVA1与内含子的结合(Fig 5M)。综上实验表明SNRK通过NOVA1影响circ-SNRK的形成。

图5 SNRK的55 kDa肽段能与NOVA1连接并影响环状SNRK的形成
6. 缺氧通过NF-κB通路增加SNRK的转录
低氧诱导了心肌细胞内SNRK、线性SNRK和circ-SNRK 的变化。为了阐明其机制,于是作者对缺氧相关转录因子进行分析,包括HIF(低氧诱导因子)、NF-κB(核因子NF-kappa- b)或AP-1(激活蛋白-1)。分别通过抑制剂进行处理,发现仅在JSH-23处理下,缺氧条件下的心肌细胞pre-SNRK显著降低(Fig. 6A)。此外,生物信息分析提示在SNRK的启动子中NF-κB有三个可能的结合位点(Fig. 6B)。因此,作者推测缺氧可能通过NF-κB通路影响SNRK转录。然后,利用NF-κB复合体中最丰富的元素pCMV-P65上调P65水平。
免疫荧光显示在pCMV-P65转染的新生大鼠心肌细胞中,P65的核表达增加(Fig.6C)。新生大鼠心肌细胞中pre-SNRK的显著增加表明NF-κB复合物可以激活SNRK转录(Fig 6D);在si-P65转染的新生大鼠心肌细胞中pre-SNRK的减少进一步支持了这一观点(Fig 6E)。接下来,作者针对预测位点在P65启动子中设计了三种引物 (Fig 6B)。采用染色质免疫沉淀法检测P65的相互作用。结果发现可以检测到第二个位点的序列(Fig 6F)。作者进一步将SNRK的wt或mut启动子克隆到pGL4.27载体中,显示心肌细胞中共转染pCMV-P65和pGL 4.27-wt-SNRK启动子的荧光强度明显高于对照组(Fig. 6G)。最后,发现在缺氧治疗的心肌细胞或心肌梗死后P65升高,表明pre-SNRK过表达与心脏中的P65相关(Fig.6 h)。综上所述,缺氧可以通过NF-κB通路激活SNRK转录。
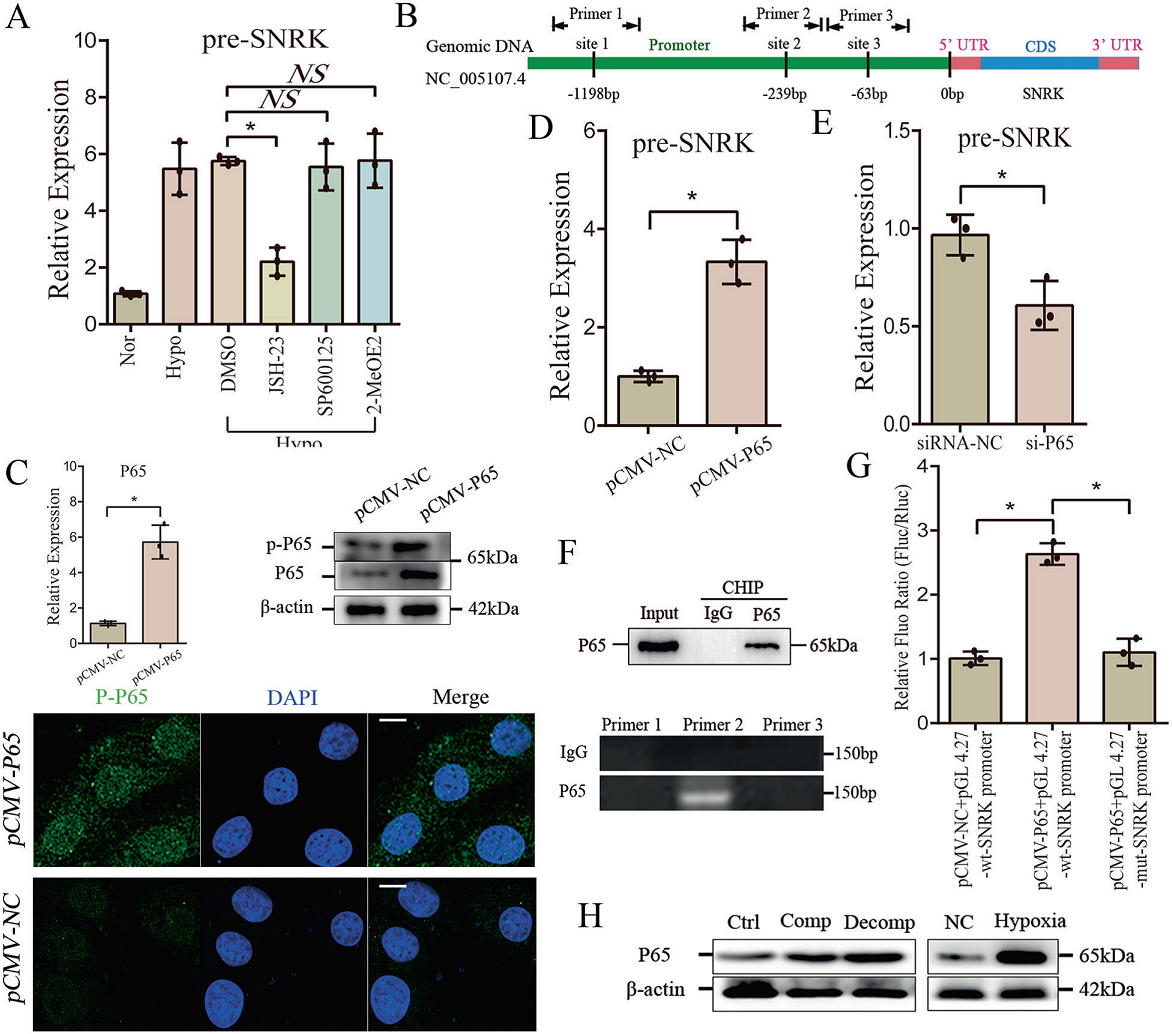
图6 缺氧通过NF-κB通路促进SNRK的转录
7. Circ-SNRK改善心肌梗死大鼠心功能
作者接下来研究了circ-SNRK是否能在体内改善心肌梗死后心功能。通过病毒载体(AAV9)建立了过表达(MI-circ-SNRK 组)或不表达circ-SNRK (MI对照组)的HF大鼠模型。qRT-PCR结果显示MI-circ-SNRK组circ-SNRK显著上调(Fig 7A)。三色染色显示SNRK组心肌梗死面积显著降低(Fig 7B)。MI-circ-SNRK组超声心动图指标(LVEF、FS、LVPW)均较高,提示circ-SNRK过表达大鼠心功能较好(Fig 7C, D)。MI-circ-SNRK组ATP和ATP/ADP比值的升高表明其在能量代谢中的有益作用(Fig 7E,F)。Caspase 3/Parp-1免疫印迹和Tunel实验表明circ-SNRK可以改善细胞在体内的死亡(Fig 7G-H)。研究circ-SNRK在体内是否通过SNRK发挥其功能,研究数据显示SNRK和相关蛋白的表达与预期一致且不同组间miR-33无变化,这些与体外实验结果一致(Fig 7I-J)。这些结果表明circ-SNRK可以通过miR-33 -SNRK轴保护心脏免于能量耗尽,进而改善心肌梗死后的心功能。
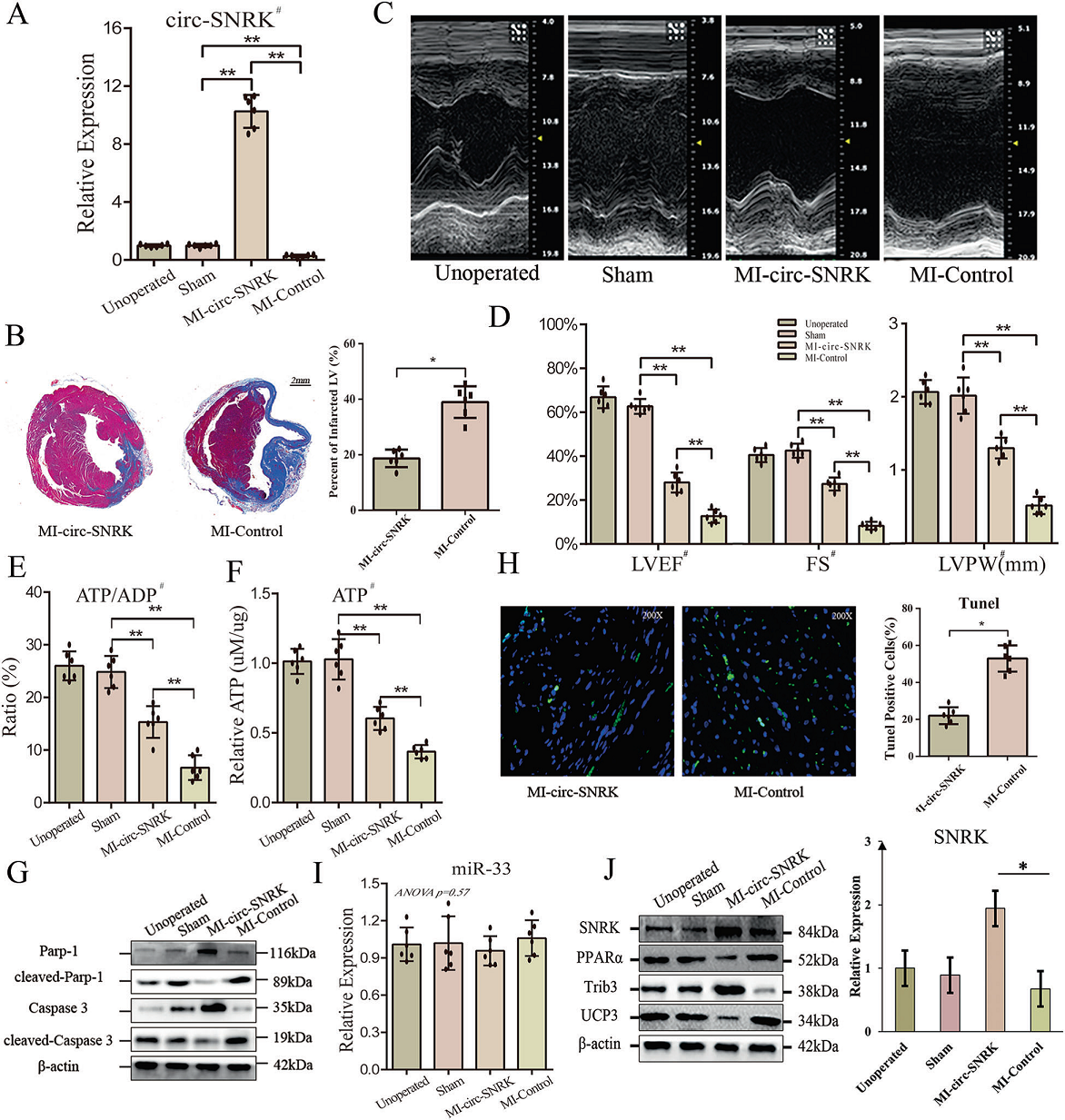
Fig. 7 Circ-SNRK可改善大鼠心肌梗死后心功能
circ-SNRK与SNRK的负循环调节了能量代谢,可能是治疗心力衰竭的一个潜在靶点。
参考文献: Wang ZY, Liu XX, Deng YF. Negative feedback of SNRK to circ-SNRK regulates cardiac function post-myocardial infarction. Cell Death Differ 2021.






