脑出血后CCR5激活通过CCR5/PKA/CREB途径促进NLRP1依赖性神经元焦亡

神经元性焦亡是一种由促炎信号触发的调节性细胞死亡。CCR5(C-C趋化因子受体5)介导的炎症参与各种神经系统疾病的病理过程。目前有研究探讨了实验性脑出血(ICH)后CCR5激活对神经元焦亡的影响以及涉及cAMP依赖的PKA /CREB /NLRP1通路的潜在机制。该研究2021年11月发表在《Stroke》,IF:7.9.
技术路线:
主要研究结果:
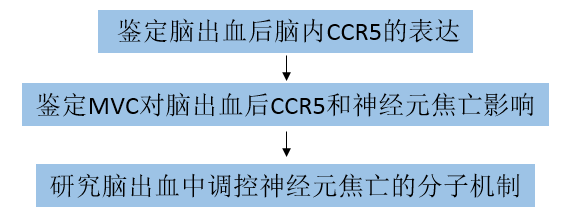
1. 脑出血后脑内CCR5的时空表达
采用ELISA和Western blot检测脑出血后0、3、6、12、24和72小时同侧(右侧)大脑半球CCL5、CCR5、PKACα、p-CREB和NLRP1的表达。与Sham组相比,在3小时时检测到CCL5水平显著升高,经ELISA测定,24小时时CCL5水平相对较高。CCR5水平在脑出血后3小时显著升高,在24小时达到峰值,并在72小时开始下降(图1A)。脑出血后,CCR5的潜在下游蛋白PKACα和p-CREB也以与CCR5相似的模式暂时升高。与Sham组相比,脑出血后6小时NLRP1炎症体表达显著上调,72小时达到峰值(图1A)。双免疫荧光染色显示脑出血后24小时CCR5主要表达于同侧基底皮质的神经元、小胶质细胞和星形胶质细胞(图1B)。
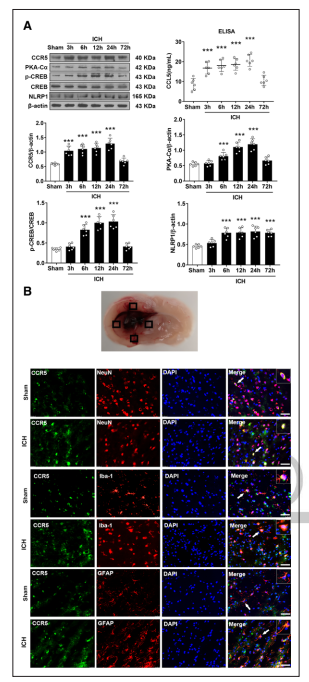
图1 ICH后CCL5、CCR5、PKA-Cα、p-CREB、CREB和NLRP1蛋白水平的时空表达
2. 用MVC抑制CCR5可减轻脑出血后24和72小时的神经行为缺陷
在ICH后24小时,与Sham组相比,ICH+vehicle组有明显的神经损伤(图2A)。与载体治疗ICH组相比,每天150和450 μg/kg剂量的MVC治疗在ICH后24小时的改良Garcia试验、前肢放置试验和转角试验中显著改善了神经功能(图2A)。
根据这一结果,确定150μg/kg/天的剂量为MVC的最佳剂量,并在随后的实验中使用。与ICH+载体组相比,在ICH后72小时,MVC治疗显著降低ICH小鼠的神经行为缺陷(图2B)。相反,与ICH+载体组相比,ICH后72小时首次给药MVC并没有显著减少ICH小鼠的神经行为缺陷(图2C)。
图2 MVC对ICH后24和72小时神经行为结果的影响
3. MVC介导的CCR5抑制降低了脑出血后24小时内神经元焦亡细胞的死亡
TUNEL染色和Fluoro-Jade C染色分别用于评估MVC治疗是否减少了神经细胞死亡。在脑出血24小时后,用cleaved caspase-1标记的神经元核来评估神经元焦亡。脑出血后24小时,与Sham组相比,脑出血大鼠的TUNEL阳性神经元和Fluoro-Jade C阳性变性神经元显著增加(图3A和3B)。MVC介导的CCR5抑制显著减少TUNEL阳性神经元和Fluoro-Jade C阳性退化神经元数量(图3A和3B)。与ICH+治疗组相比,在ICH后24小时,MVC治疗显著减少了血肿周围区域cleaved caspase-1阳性神经元的数量(图3C)。

图3 ICH后24小时,用MVC抑制CCR5对神经元损伤、焦亡的影响
4. MVC改善了脑出血后的长期感觉运动协调、空间学习和参考记忆功能,并减少了海马氨角1(CA1)神经元的丢失
与Sham组相比,ICH+载体组在足部缺陷试验中有更多的左前肢足部缺陷,在ICH后的第一、第二和第三周,在rotarod试验中下降的潜伏期更短(图4A)。而MVC治疗显著减少了左侧前肢的足部缺陷(图4A),但增加了ICH小鼠的下降潜伏期(图4A)。在Morris水迷宫实验中,ICH+载体组的游泳距离和逃避潜伏期明显长于Sham组。然而,与ICH+载体组相比,MVC治疗显著降低了第3-5区的逃避潜伏期和游泳距离(图4A)。在探测象限试验中,与Sham组相比,ICH+载体组在目标象限花费的时间更少。然而,与ICH+载体组相比,MVC治疗显著增加了在探测象限花费的时间(图4A)。在ICH后第25天进行Nissl染色以评估海马CA1区的神经元丢失。结果显示,ICH+载体组海马CA1区存活的神经元数量少于Sham组,但与ICH+载体组相比,MVC治疗显著增加了存活的CA1神经元数量(图4B)。

图4 MVC改善了ICH后的长期神经行为功能
5. 脑出血后24小时,CREB抑制剂逆转MVC对神经行为缺陷和CCR5/PKA Cα/CREB/NLRP1介导的焦亡的神经保护作用
ICH后24小时,用CREB抑制剂666-15预处理,可显著逆转MVC对改良Garcia、前肢放置和转角测试的神经行为益处(图5A)。此外,MVC显著增加同侧脑出血后脑组织中PKA-Cα和p-CREB的蛋白水平,但降低NLRP1、ASC、C-caspase-1、N-GSDMD、IL-1β和IL-18的表达(图5B)。与MVC治疗的ICH小鼠相比,666-15一致逆转了MVC对细胞死亡和CCR5/PKA-Cα/CREB/NLRP1信号通路的影响,这与NLRP1、ASC、C-caspase-1、N-GSDMD、IL-1β和IL-18的蛋白水平升高有关(图5B)。
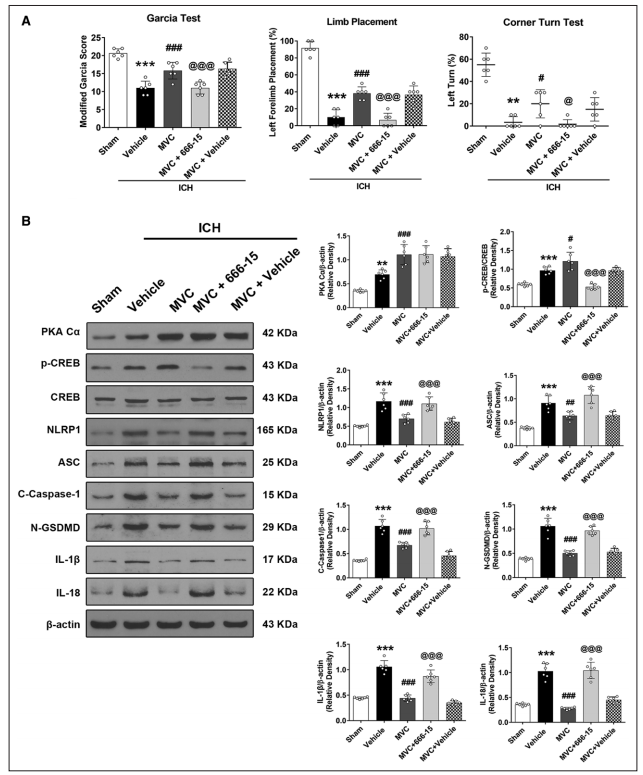
图5 666-15对CREB的抑制消除了MVC对ICH小鼠的神经功能益处和抗神经性过敏作用
6. 在注射rCCL5后24小时,通过rCCL5激活CCR5,通过CCR5/PKA Cα/CREB/NLRP1信号通路导致幼稚小鼠出现神经功能缺损和焦亡
侧脑室注射rCCL5显著降低了幼稚小鼠改良Garcia、肢体放置和转角试验的神经评分(图6A),并导致同侧脑组织中NLRP1、ASC、C-caspase-1、N-GSDMD、IL-1β和IL-18的蛋白水平显著升高(图6B)。相反,与naive + rCCL5 +载体组相比,PKA激活剂8-溴-cAMP通过显著增加naïve + rCCL5 + 8-Bromo-cAMP中PKA-Cα的表达,逆转了rCCL5的作用(图6B)。
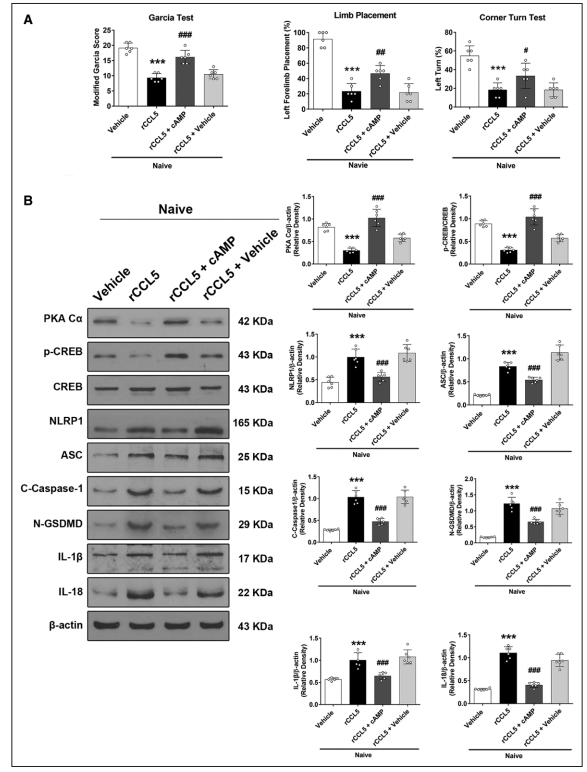
图6 rCCL5通过激活CCR5/PKA-Cα/CREB/NLRP1信号通路对幼稚小鼠的有害影响
主要结论:
该研究表明,小鼠实验性脑出血后,CCR5激活至少部分通过CCR5/PKA/CREB信号通路促进NLRP1依赖性神经元焦亡和神经功能缺损。使用MVC抑制CCR5可能在ICH患者的治疗中提供一种有希望的治疗策略。
参考文献:
Yan J, Xu W, Lenahan C, Huang L, Wen J, Li G, Hu X, Zheng W, Zhang JH, Tang J. CCR5 Activation Promotes NLRP1-Dependent Neuronal Pyroptosis via CCR5/PKA/CREB Pathway After Intracerebral Hemorrhage. Stroke. 2021, 52(12):4021-4032. doi: 10.1161/STROKEAHA.120.033285.






