SNHG7促进肿瘤耐药和巨噬细胞M2极化
小核仁RNA宿主基因7 (small nucleolar RNA host gene 7,SNHG7) 的衍生lncRNA在包括肺腺癌(LUAD)在内的多种癌症中已被广泛报道。然而,lncRNA SNHG7是否参与LUAD的多西他赛耐药尚不清楚。本文发现外泌体介导SNHG7的转移增强了肺腺癌的多西他赛耐药。本文于2021年10月发表在《Cancer Letter》IF:8.679杂志上。
技术路线:

主要实验结果:
首先检测SNHG7是否和LUAD细胞抵抗多西他赛有关,结果显示与相应的亲代细胞相比,SNHG7在多西他赛耐药的LUAD细胞系(H1299/DTX and SPC-A1/DTX)中高表达(图1A)。敲除SNHG7后,H1299/DTX and SPC-A1/DTX对多西他赛的耐药性显著降低(图1B-C),表明SNHG7增强LUAD细胞对多西他赛的抗性。此外,SNHG7在耐药细胞和相应的亲代细胞中都主要分布于细胞质中,表明其增强耐药性是通过转录后调控。
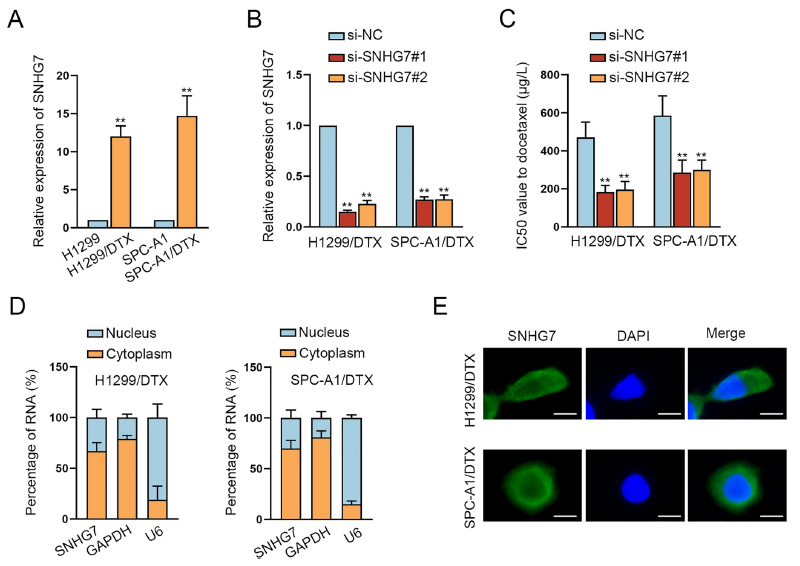
图1 SNHG7增强LUAD细胞对多西他赛的抗性
2、SNHG7增强LUAD细胞的多西他赛抗性,诱导巨噬细胞M2极化
为了研究SNHG7是否影响多西他赛对LUAD细胞的生物学功能,在有无多西他赛处理下进行功能实验。如图2A-C所示,陈曼SNHG7降低了0或100μg/L多西他赛暴露后的H1299/DTX and SPC-A1/DTX细胞的增殖,但增加了细胞凋亡。在小鼠体内,多西他赛抑制肿瘤生长,减小肿瘤体积和重量,而这种作用在SNHG7敲除后进一步被放大(图2D-F)。因此,SNHG对多西他赛在LUAD细胞中的抗肿瘤作用有负面影响。
众所周知M2极化的肿瘤相关巨噬细胞会促进肿瘤进展和化学抗性。所以作者想知道SNHG7是否会影响巨噬细胞M2极化。结果显示IL-3处理巨噬细胞增加了M2标志物的表达,包括CD206和ARG1,但是敲除SNHG7会反转这种趋势(图2G-H)。此外,IL-3处理增加了CD11b+CD206+标记的巨噬细胞比例,但敲除SNHG7会反转这种作用(图2I)。这些结果表明SNHG7正向调节巨噬细胞M2极化。
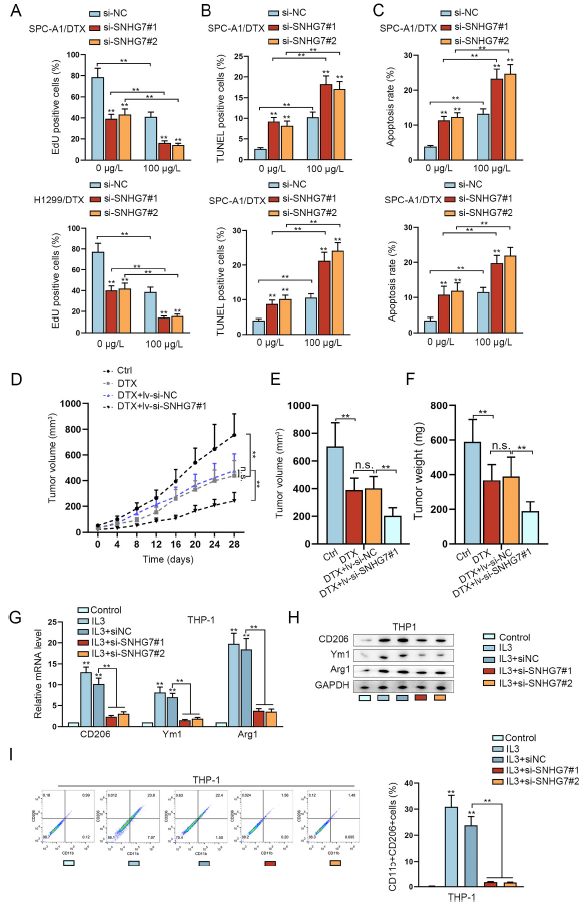
图2 SNHG7增强LUAD细胞的多西他赛抗性,诱导巨噬细胞M2极化
3、SNHG7通过调节ATG5和ATG12诱导多西他赛耐药的LUAD细胞自噬
自噬在调控肿瘤细胞耐药中发挥着重要作用,所以作者猜测SNHG7可能通过自噬促进耐药,于是检测了敲除SNHG7后耐药细胞H1299/DTX和SPC-A1/DTX中自噬相关基因的表达。如图3A所示,WB表明敲除SNHG后暴露0或100μg/L多西他赛 H1299/DTX and SPC-A1/DTX细胞中LC3I/II, ATG5, ATG12的表达显著降低,但不影响ATG7和ULK1;100μg/L多西他赛处理显著降低了H1299/DTX and SPC-A1/DTX细胞中LC3-II/LC3-1, ATG5, ATG7, ATG12, and ULK1水平,但同时敲除SNHG7只增强了多西他赛导致的LC3I/II, ATG5, ATG12的表达降低作用。这表明SNHG7正调节自噬通过ATG5和ATG12。此外,免疫荧光显示敲除SNHG7可以减少自噬小体和ATG5和ATG12蛋白水平,但是没有改变其mRNA水平,并且荧光素酶实验显示SNHG7不能改变ATG5和ATG12的启动子荧光素酶活性(图3B-D),表明SNHG7不是在转录水平调控ATG5和ATG12。
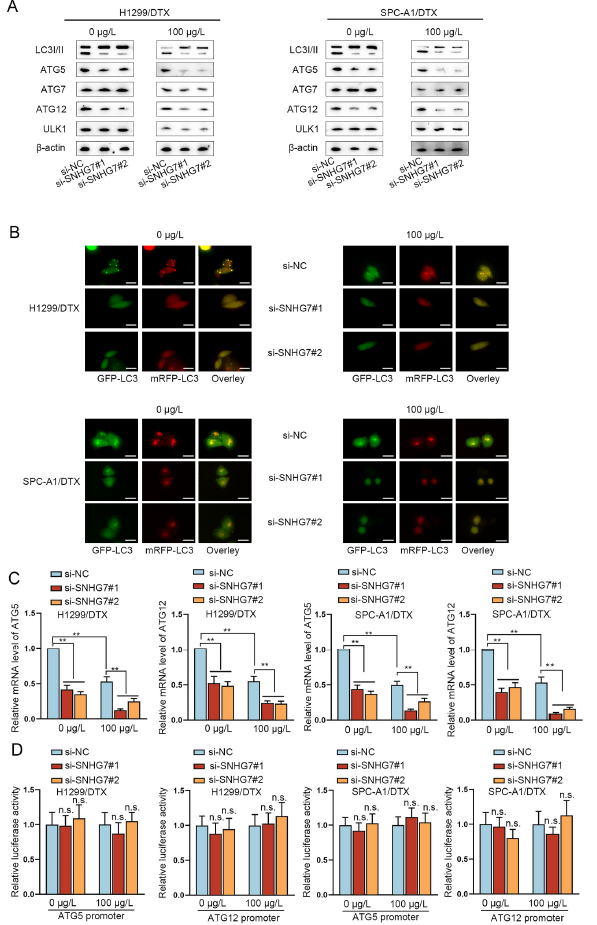
图3 SNHG7通过调节ATG5和ATG12诱导多西他赛耐药LUAD细胞自噬
4、SNHG7招募HuR以稳定ATG5和ATG12从而影响LUAD细胞的增殖、凋亡和多西他赛耐药
接下来,研究SNHG7如何调控ATG5和ATG12。首先进行RNA pulldown实验获得与antisense比较在,senseSNHG7中差异的蛋白条带,然后用MS识别差异条带,获得与SNHG7相互作用的蛋白,结果发现CUL4A和HuR在senseSNHG7中显著富集(图4A-B)。RIP证实SNHG7可以被HuR抗体富集沉淀(图4B-C)。RIP证明HuR和ATG5和ATG12有结合作用(图4D-E),并且,敲除SNHG7减少了ATG5和ATG12和HuR的结合(图4F)。此外,敲除SNHG7或HuR的表达都会显著降低ATG5和ATG12的mRNA稳定性(图4G-H)。以上结果表明SNHG7招募HuR以稳定ATG5和ATG12。
之后作者通过拯救实验证明SNHG是通过 ATG5和ATG12影响LUAD细胞的增殖、凋亡和多西他赛耐药性的(结果未展示)。
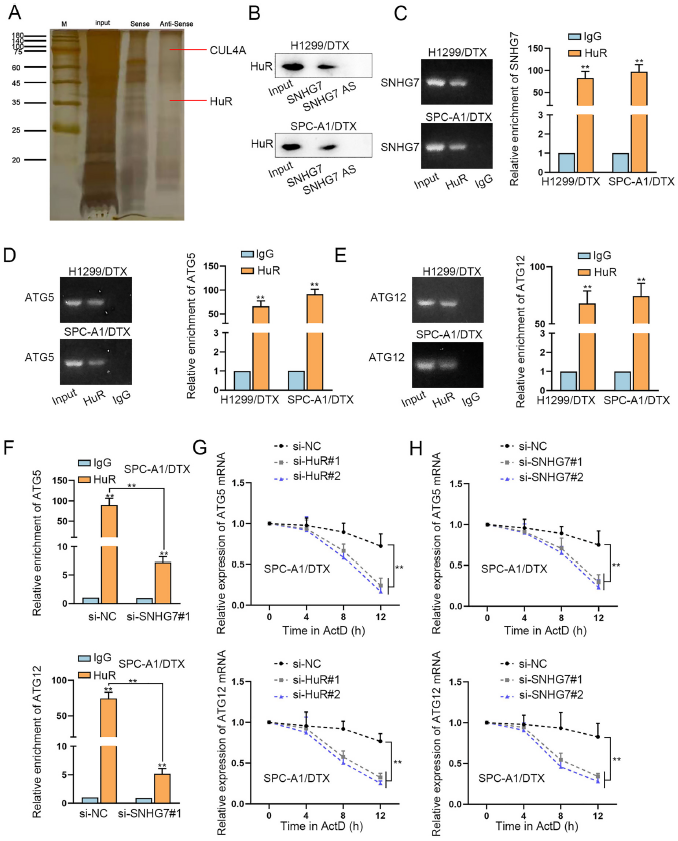
图4 SNHG7招募HuR稳定ATG5和ATG12
5、多西他赛耐药LUAD细胞分泌的外泌体SNHG促进LUAD的耐药性和巨噬细胞M2极化
如图5A-D所示,分离获得了耐药性LUAD细胞系H1299/DTX and SPC-A1/DTX的外泌体,随后这些被PKH67标记的外泌体显示分布在H1299/DTX and SPC-A1/DTX的细胞质中。之后,将这些外泌体和SNHG7敲除或未敲除的巨噬细胞共孵育。结果发现外泌体处理组M2标志物显著上调,但是当同时敲除SNHG7后,这种上调作用被减弱(图5E-F)。类似的,CD11b+CD206+巨噬细胞比例在外泌体处理组显著上调,在SNHG7+外泌体组显著回落(图5G)。表明耐药性LUAD细胞来源外泌体SNHG7促进LUAD细胞的耐药性和巨噬细胞M2极化。
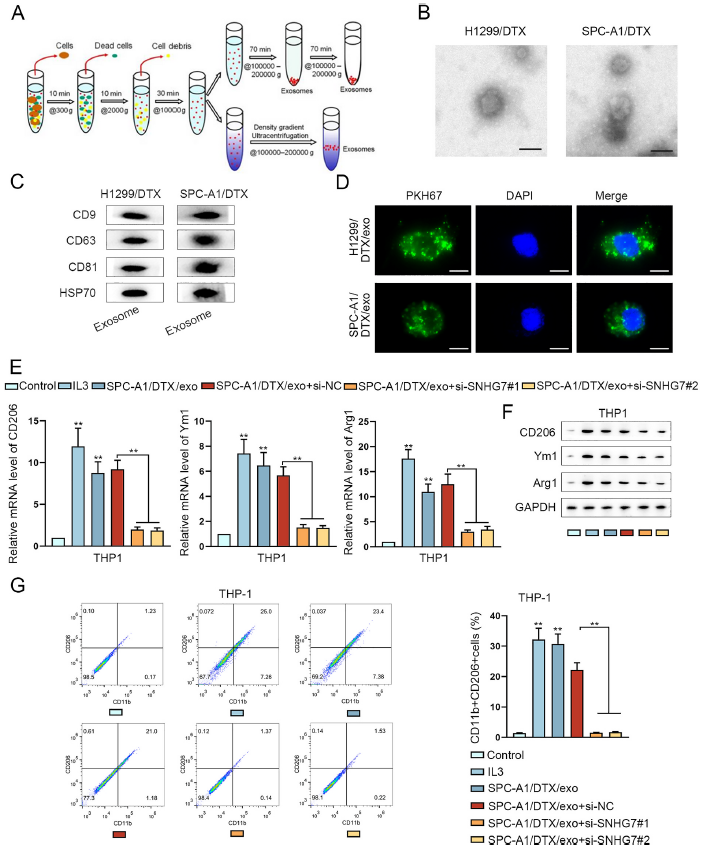
图5来自多西他赛耐药LUAD细胞的外泌体SNHG7促进LUAD细胞的多西他赛耐药和巨噬细胞M2极化
6、SNHG7通过招募CUL4A增加PTEN泛素化水平,激活PI3K/AKT通路介导巨噬细胞M2极化
随后探究SNHG7调控M2极化的机制。作者首先筛选了9条常见的信号通路,并进行荧光素酶实验,发现只有PI3K/AKT信号通路的荧光素酶信号在SNHG敲除后显著下降(图6A)。随后WB验证表明敲除SNHG7会显著抑制外泌体处理的巨噬细胞AKT的磷酸化,但对其mRNA的表达无影响(图6B-C)。亚细胞定位也显示外泌体处理的巨噬细胞中SNHG7主要定位与细胞质(图6D)。之后过表达SNHG7的同时用蛋白合成抑制剂CHX处理外泌体孵育后的巨噬细胞,发现过表达SNHG7后PTEN蛋白稳定性下降,并且外泌体处理的巨噬细胞中PTEN的泛素化增加了,而MG132阻断了这种SNHG过表达对PTEN泛素化的抑制作用(图6E)。
此外,之前的MS鉴定到的CUL4A是一个泛素化相关蛋白。所以作者推测SNHG7可能通过招募CUL4A调控PTEN的泛素化。FISH-IF共染证明了CUL4A和SNHG7之间的共定位(图6F),RIP和RNA pulldown证实了两者间的结合关系(图6G-H)。此外,co-IP实验结果表明PTEN可以被CUL4A富集沉淀,而这种富集在过表达SNHG7之后显著上调。以上表明SNHG7是通过招募CUL4A调控PTEN的泛素化。
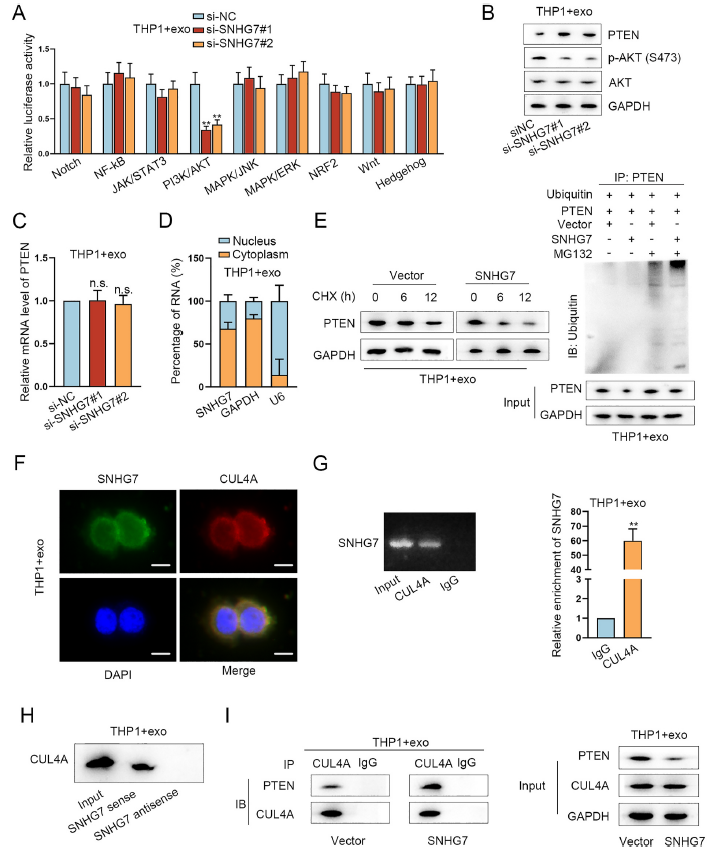
图6 SNHG7通过招募CUL4A促进PTEN泛素化激活PI3K/AKT通路
综上所述,本研究表明外泌体SNHG7通过诱导LUAD细胞自噬和促进巨噬细胞M2极化促进LUAD细胞多西他赛耐药。机制上,SNHG7招募HuR稳定ATG5和ATG12,诱导LUAD细胞自噬。同时,耐多西他赛的LUAD细胞分泌外泌体SNHG7,促进亲代LUAD细胞耐多西他赛。此外,外泌体SNHG7通过招募CUL4A促进PTEN泛素化,激活PI3K/AKT通路,触发巨噬细胞M2极化。
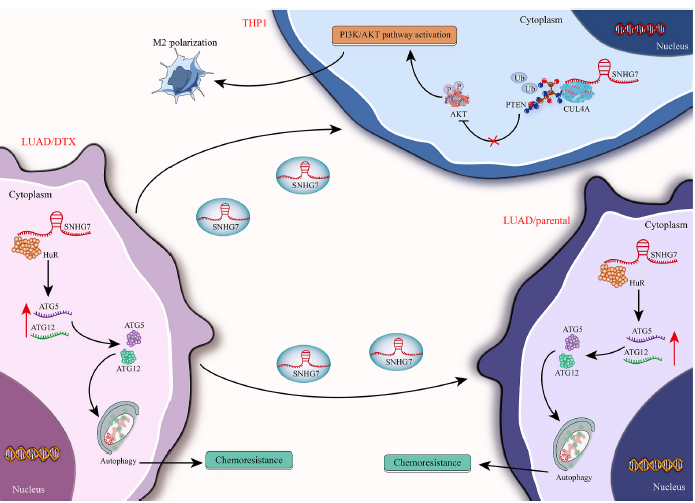
图7 SNHG7诱导LUAD细胞多西他赛耐药和巨噬细胞M2极化的分子机制
参考文献:
Zhang Kai., Chen Jing., Li Chen., Yuan Yuan., Fang Surong., Liu Wenfei., Qian Yingying., Ma Jiyong., Chang Ligong., Chen Feifei., Yang Zhenhua., Gu Wei.(2021). Exosome-mediated transfer of SNHG7 enhances docetaxel resistance in lung adenocarcinoma. Cancer Lett, undefined (undefined), undefined. doi:10.1016/j.canlet.2021.10.029






