自然杀伤细胞来源的外泌体miR-1249-3p可减轻2型糖尿病小鼠模型的胰岛素抵抗和炎症反应
2型糖尿病(T2D)是最常见的代谢性糖尿病,其特征是高血糖(也称为高血糖)及胰岛素抵抗。自然杀伤细胞(NK)被认为能通过调节全身炎症进而影响T2D。然而,NK细胞调节胰岛素敏感性的机制尚不清楚,本研究探讨NK调控T2D的分子机制。本文于2021年10月发表在《Signal Transduction and Targeted Therapy》,IF= 12.818。
本文技术路线:

1、来自瘦小鼠的自然杀伤(NK)来源的外泌体可减轻肥胖诱导的胰岛素抵抗
为探讨NK来源外泌体在胰岛素抵抗中的作用,采用高脂饲料(HFD)联合低剂量链脲佐菌素(STZ)建立T2D小鼠模型,对照组饲喂正常鼠粮(NCD)。HFD小鼠体重显著增加,空腹血糖(Fig 1a)、OGTT(Fig 1b)、ITT(Fig 1c), HOMA-IR指数(Fig 1d)结果显示, HFD小鼠产生了胰岛素抵抗。
通过流式细胞术从脾淋巴细胞中分离NK细胞,并用超离心法从NK细胞条件培养基中分离纯化外泌体。电子显微镜(Fig 1e)和NanoSight分析(Fig 1f)显示,从条件培养基中分离的NK细胞颗粒含有丰富的外泌体,其直径为30 – 150nm。此外,作者从中检出了HSP70,CD63、TSG101、CD9外泌体标志物,此外,内质网蛋白GRP94的缺失进一步证实分离的颗粒主要是外泌体(Fig 1g)。
为了确定NK来源外泌体的生物学功能,NCD小鼠和HFD小鼠分别通过NCD小鼠NCD来源性外泌体(NCD- exos)或HFD小鼠NK源性外泌体(HFD- exos)进行处理。NCD-Exos将HFD小鼠体重降至正常水平。空腹血糖、OGTT、ITT和HOMA-IR结果表明,NCD-Exos治疗后HFD小鼠全身胰岛素敏感性显著提高(Fig. 1h–k)。然而,在其他组没有显著影响。因此,主要关注的是NCD-Exos和HFD小鼠的HFD- exos。为了观察NK来源地外泌体在体内的分布情况,通过小鼠尾静脉用红色荧光PKH26染色的NCD-Exos处理小鼠。结果表明,NK来源的外泌体主要集中在内脏脂肪组织(VATs)、皮下脂肪组织(sat)、胰岛和肝脏,而在肌肉组织(Fig. 1l)。此外,HFD小鼠体内肝甘油三酯水平和VAT的重量均显著增加,但注射了NCD-Exos后,情况就大大缓解了(Fig. 1m, n).。此外,HFD小鼠在内脏脂肪组织和肝脏中注射NCD-Exos促炎因子基因表达明显下调。
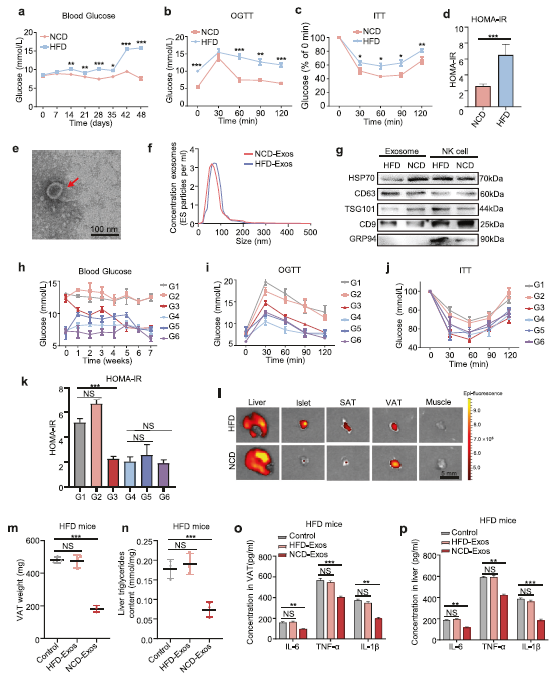
Fig 1 来自瘦小鼠的自然杀伤(NK)来源的外泌体可减轻肥胖诱导的胰岛素抵抗
2. 脂肪少的NK来源的外泌体增强细胞胰岛素敏感性
在NCD-Exos处理的3T3-L1脂肪细胞和AML12细胞中,p-Akt和PPARγ的表达增加,3T3-L1脂肪细胞中GLUT4表达也上调,然而,通过HFD-Exos处理则无明显影响(Fig 2c-i)。
此外,NCD-Exos处理后,3 t3-l1脂肪细胞和AML12细胞中促炎因子IL-6、IL-1β和TNF-α显著下调 (Fig2j, k)。体外实验结果结表明,NCD-Exos可提高脂肪细胞和肝细胞的胰岛素敏感性,减轻炎症反应,这与体内实验结果一致。
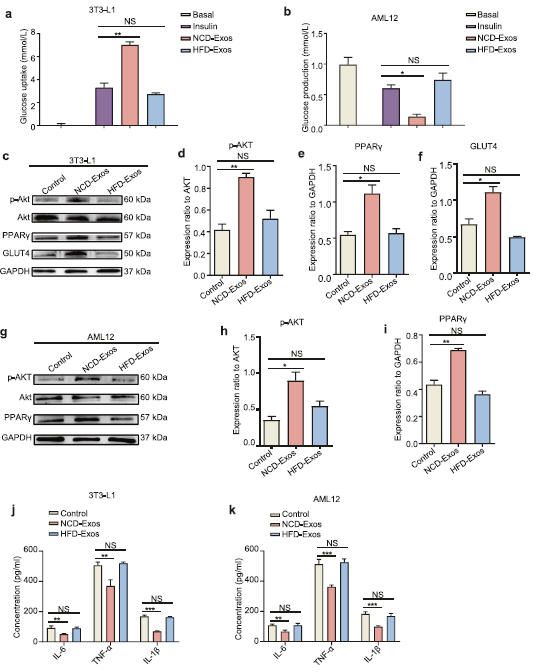
Fig 2脂肪少的NK来源的外泌体增强细胞胰岛素敏感性
3. NK来源的外泌体miR-1249-3p介导细胞胰岛素敏感性和炎症
越来越多的证据表明,大量的miRNAs被封装在外泌体中,并在细胞-细胞通信中发挥重要作用。因此,作者假设NK来源的外泌体miRNA参与调节脂肪细胞和肝细胞的胰岛素敏感性。为了识别所涉及的特定miRNA,作者首先进行了微阵列生成NCD-Exos和HFD-Exos的miRNA表达谱(Fig 3A)。通过单通道芯片计算差异表达miRNA的比较,发现1249-3p在NCD-Exos中增加最显著(Fig 3B))。GO和KEGG分析显示miR-1249-3p直接参与代谢通路。此外,miR-1249-3p表达水平在NCD小鼠肝和肝中显著升高。
接下来,为了验证了外泌体miRNAs是否由NK细胞分泌并运输到靶细胞。转染荧光cy3标记的拟态miR-1249-3p后,NK细胞与3T3-L1脂肪细胞或AML12细胞在Transwell TM平板中进行共培养(Fig 3c)。 Cy3染料在3T3-L1脂肪细胞和AML12细胞中的出现,表明拟态Cy3- mir -1249-3p能从Transwell TM上部的NK细胞传递到下部的受体脂肪细胞和肝细胞。Cy3染料伴在3T3-L1脂肪细胞以及AML12细胞中随着miR-1249-3p丰度的增加而增加 (Fig 3c)。在对照实验中,作者单独使用Cy3染色(未与miR-1249-3p结合)处理NK细胞,再与3T3-L1脂肪细胞与AML12细胞共培养后并没有检测到Cy3染色。此外,NCD小鼠外泌体中miR-1249-3p的表达明显高于NFD小鼠,这可能是由于外泌体通过循环系统从脾NK细胞迁移到靶细胞 (Fig 3b)。总之,外泌体miR-1249-3p可由NK细胞分泌,并被脂肪细胞和肝细胞摄取。
此外,还检测了miR-1249-3p对胰岛素功能的影响。将拟态MiR-1249-3p、抑制剂和阴性对照分别转染至3T3-L1脂肪细胞和AML12细胞,结果显示,过表达MiR-1249-3p显著增加了3T3-L1脂肪细胞胰岛素刺激下的葡萄糖摄取(Fig 3d),同时伴有促炎症因子表达下调(Fig 3e)。在AML12细胞中,转染拟态MiR-1249-3p促进胰岛素对葡萄糖产生抑制作用(Fig 3f),同时促炎因子表达降低(Fig3g)。综上所述,上述结果提示NCD小鼠NK来源的外泌体miR-1249-3p可促进细胞胰岛素敏感性,减轻炎症反应。

Fig 3 NK来源的外泌体miR-1249-3p介导细胞胰岛素敏感性和炎症
4. 外泌体miR-1249-3p直接靶向SKOR1介导胰岛素敏感性
为了确定外泌体miR-1249-3p的靶点,作者先使用了两种生物信息学工具(miRDB和TargetScan)来预测,发现一组共同的靶点基因,并证实SKI家族转录共抑制因子1 (SKOR1)是miR-1249 - 3 - p的直接靶点 (Fig 4a)。在3T3-L1脂肪细胞和AML12细胞中,SKOR1蛋白表达被miR-1249-3p下调 (Fig 4b)。然而,SKOR1 mRNA水平基本没有变化。随后,miR-1249-3p与SKOR1全长之间的序列比对显示SKOR1的3'UTR可能是miR-1249-3p的潜在靶点(Fig 4c)。然后将野生型和突变的miR- 1249-3p结合位点克隆到荧光素酶载体中。发现与野生型结合位点载体共转染miR-1249-3p的3T3-L1脂肪细胞中,荧光素酶活性显著降低。然而,含有突变结合位点载体的细胞没有表现出这种抑制(Fig 4d)。 此外, 在HFD小鼠的内脏脂肪组织和肝脏中,NCD-Exos能降低了SKOR1蛋白的表达(Fig. 4e)。这些结果表明SKOR1是脂肪细胞和肝细胞中miR-1249-3p的直接靶点。
此外,作者发现,敲低SKOR1增加了3T3-L1脂肪细胞中胰岛素刺激的葡萄糖摄取,并促进了胰岛素对AML12细胞中葡萄糖产生的抑制作用,同时两个细胞中的促炎因子减少(Fig 4f-i),这被miR-1249- 3 p抑制剂中和(Fig. 4j–q)。综上所述,这些发现表明SKOR1是miR-1249-3p的直接下游靶点,并介导葡萄糖稳态。
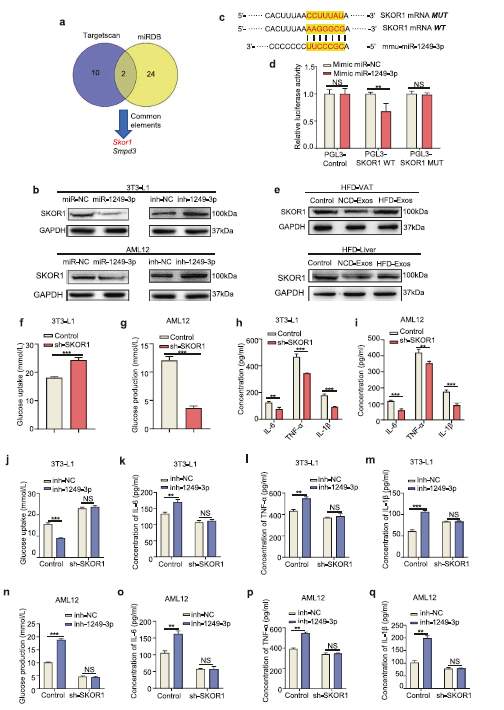
Fig4外泌体miR-1249-3p直接靶向SKOR1介导胰岛素敏感性
作者通过蛋白互作预测工具评估SKOR1与蛋白的相互作用,并找到了LBX1和SMAD 6 (Fig 5a)。进一步探索SKOR1和SMAD6之间的关系。由于SKOR1没有改变 3T3-L1脂肪细胞和AML12细胞中SMAD6的表达(Fig. 5b–d), 于是假设SKOR1可能通过TLR4/NF-κB通路与SMAD6相互作用调节炎症反应。通过免疫沉淀反应发现SKOR1-IP细胞裂解液中检测到SMAD6 (Fig. 5e)。然后,SMAD6-IP抗体细胞裂解液中检测到检测SKOR1SMAD6-IP片段(Fig5e)。总的来说,这些结果表明SKOR1在脂肪细胞和肝细胞中与SMAD6相互作用。
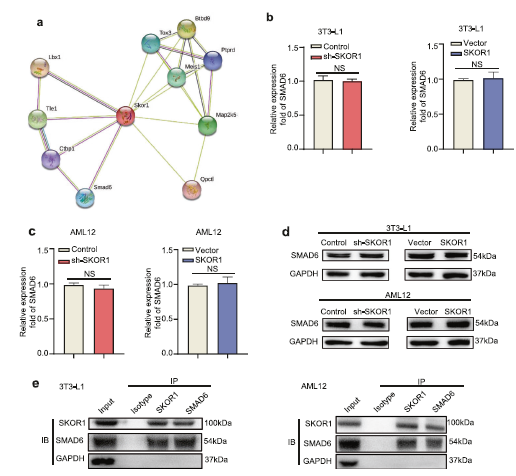
Fig 5 SKOR1在脂肪细胞和肝细胞中与SMAD6相互作用
6. MiR-1249-3p通过SKOR1-SMAD6-TLR4-NF-κB轴调节炎症反应和胰岛素抵抗
以上结果表明,miR-1249-3p抑制3T3-L1脂肪细胞和AML12细胞中IL-1β、IL-6、TNF-α等促炎因子的表达,SKOR1是miR-1249-3p的直接靶点,SKOR1与SMAD6相互作用。之前的研究已经阐明SMAD6与SMURF1结合以及MyD88形成SMAD6/ MyD88/SMURF1三元复合物,进而抑制TLR4信号转导的证据;TLR4与相应配体结合,进一步激活NF-κB,从而促进a中多种炎症因子的上调。因此,作者猜想miR-1249-3p/SKOR1轴在TLR4/NF-κ b依赖的促炎信号通路中起重要作用。
首先,作者转染了拟态miR-1249-3p或siRNA -SKOR1到 3T3-L1脂肪细胞和AML12细胞中(Fig 6a, b)。免疫印迹分析及ELISA分析(Fig 6d-f)显示转染拟态miR-1249-3p或敲低SKOR1显著抑制p65磷酸化,进而下调促炎基因IL-1β、IL-6和TNF-α的表达水平。这些数据表明,miR-1249-3p/SKOR1轴通过介导NF-κB信号通路抑制促炎基因表达。SMAD6沉默时,miR-1249-3p对TLR4/NF-κB轴活化的抑制作用得到缓解,但未完全阻断(Fig. 6c, g, h),提示SMAD6在miR-1249-3p介导的胰岛素抵抗和炎症减弱中起重要作用,在此过程中可能存在其他信号通路。总之,这些结果表明,NK来源的外泌体miR-1249-3p通过SKOR1-SMAD6-TLR4-NF-κB轴缓解胰岛素抵抗和炎症(Fig 6i)。
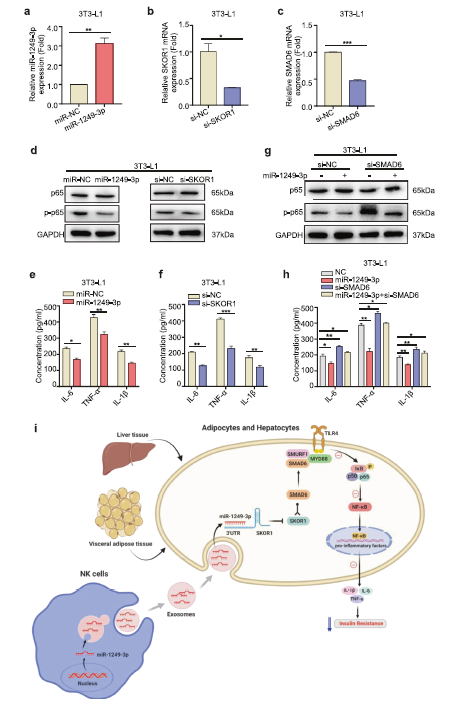
Fig 6 MiR-1249-3p通过SKOR1-SMAD6-TLR4-NF-κB轴调节炎症反应和胰岛素抵抗
综上所述,本研究揭示了nk来源的外泌体miR-1249-3p通SKOR1-SMAD6-TLR4-NF-κB轴减轻胰岛素抵抗和炎症反应,并在T2D中提供一系列潜在的治疗靶点。进一步研究miR-1249-3p和SKOR1阻滞剂在T2D小鼠中的治疗效果和临床试验。
参考文献:
Wang, Y., et al., Natural killer cell-derived exosomal miR-1249-3p attenuates insulin resistance and inflammation in mouse models of type 2 diabetes. Signal Transduct Target Ther, 2021. 6(1): p. 409.






