KIAA1429-结直肠癌预后标志物
m6A是哺乳动物中最丰富的mRNA修饰,参与了mRNA的代谢。KIAA1429被认为是最大的m6A甲基转移酶,在m6A修饰中发挥重要作用。然而,KIAA1429在结直肠癌(CRC)中的预后价值和功能尚不清楚。我们研究发现KIAA1429在结直肠癌组织中显著上调。KIAA1429高表达患者的总生存期较低表达患者短。KIAA1429在体外和体内均能促进结直肠癌细胞的增殖。KIAA1429通过与WEE1 mRNA 3′-UTR第三段结合,以m6A独立的方式降低WEE1的稳定性,从而对WEE1的表达产生负调控作用。此外,丁酸通过下调转录因子NFκB1的水平降低了KIAA1429的表达。这些结果提示KIAA1429可能是CRC潜在的预后指标。本文于2021年11月发表在“Oncogene”(IF: 9.867)期刊上。
技术路线

结果
1)KIAA1429在人CRC中表达上调
我们对TCGA数据库和GEO数据集进行分析,发现与相邻正常组织相比,结直肠癌组织中KIAA1429的mRNA表达升高(图1A)。此外,KIAA1429的高表达与临床分期进展相关(图1B)。通过TCGA数据库分析,ROC曲线下面积(AUC)为0.70(图1C)。ROC分析结果提示KIAA1429可能是CRC的诊断标志物。Kaplan Meier生存分析表明,KIAA1429表达高的CRC患者的OS比KIAA1429表达低的CRC患者的OS短(图1D)。为了证实TCGA数据库和GEO数据集中分析的结果,我们通过qRT PCR检测了43对结直肠癌组织和邻近正常组织中KIAA1429的表达,并通过IHC检测了5对结直肠癌组织和邻近正常组织中KIAA1429的表达。结果表明,在mRNA和蛋白质水平上,与相邻正常组织相比,结直肠癌组织中KIAA1429的表达显著增加(图1E、G)。通过43对CRC组织和相邻正常组织分析,AUC为0.66(图1F),这验证了KIAA1429可能是CRC的诊断生物标志物。Kaplan–Meier生存分析表明KIAA1429高表达的结肠癌患者OS和无进展生存率(PFS)较差(图1H,I)。总之,这些发现表明KIAA1429在结肠癌组织中升高,可能是结肠癌患者的预后生物标志物。

CCK-8和集落形成分析表明KIAA1429的下调抑制了结直肠癌细胞的增殖和集落形成能力(图2A,C),而KIAA1429的过表达促进了结直肠癌细胞的增殖和集落形成能力(图2B,D)。细胞周期分析表明,KIAA1429的敲除增加了G2期细胞的百分比(图2E),KIAA1429的过表达降低了G2期细胞的百分比(图2F)。此外,沉默KIAA1429表达显著抑制体内CRC肿瘤生长和肿瘤重量(图2G-I)。综上所述,这些结果表明KIAA1429可能作为癌基因在体外和体内促进结直肠癌增殖。
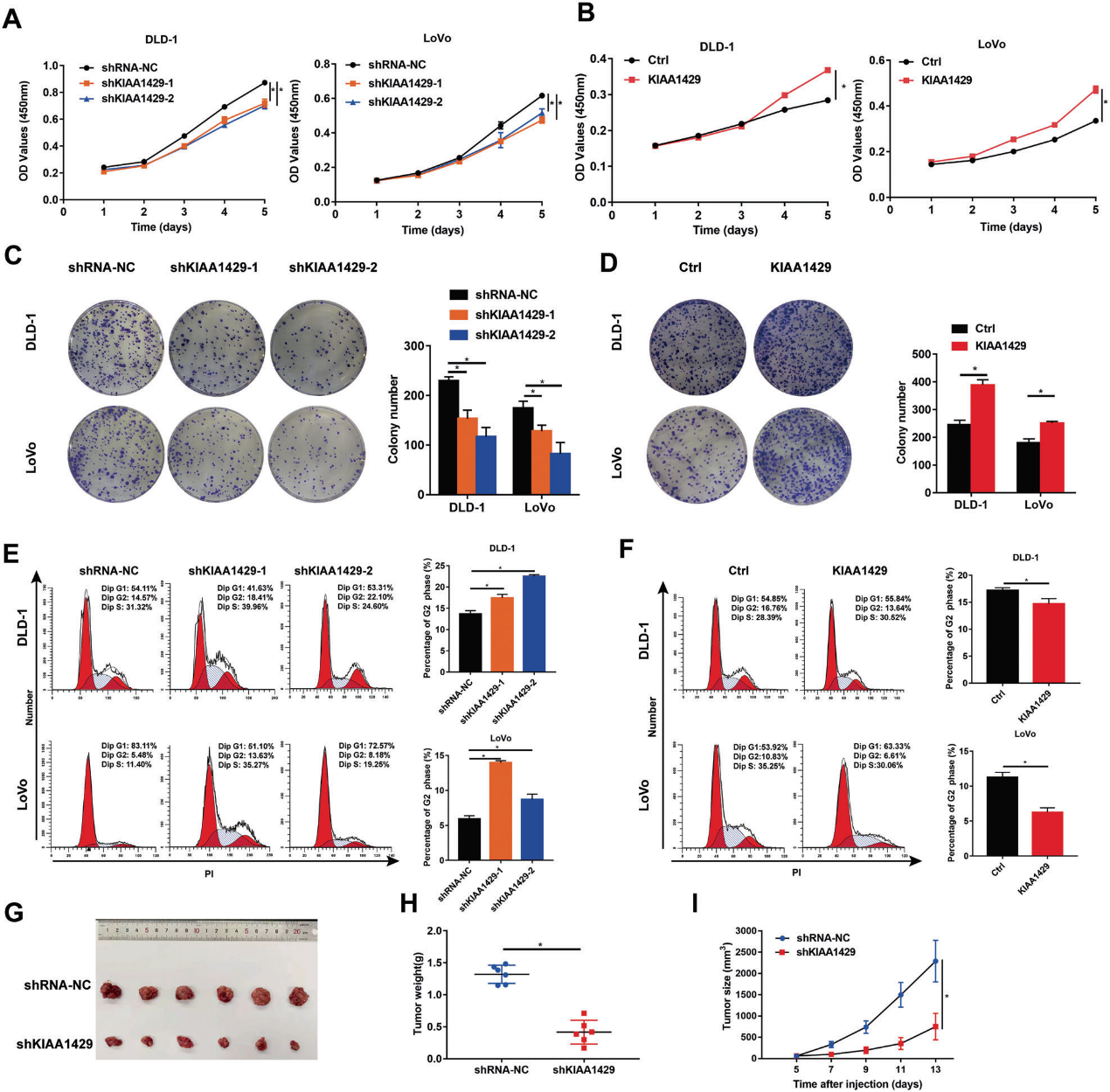
3)KIAA1429负调控WEE1表达
为了进一步探索KIAA1429促进结直肠癌细胞增殖的分子机制,我们在KIAA1429敲除细胞和相应的对照细胞中进行RNA-seq检测(图3A)。在我们之前的研究中,进行了RNA免疫沉淀和mRNA高通量测序(RIP-seq),以确定与KIAA1429蛋白相关的mRNA。在本研究中,我们通过结合RNA-seq和RIP-seq鉴定的差异表达基因进行Venn分析,结果显示63个基因重叠(图3B)。KEGG途径分析表明,细胞周期途径是最丰富的途径,主要包括WEE1、染色体1A的结构维持、转录因子Dp-1和小染色体维持复合物成分3。通过qRT PCR分析验证这些基因,结果显示WEE1在四个基因中变化最显著(图3C-F)。因此,WEE1被选为KIAA1429的候选下游目标,以供进一步研究。WEE1蛋白水平在KIAA1429敲除细胞中升高,在KIAA1429过表达细胞中降低(图3G,H)。根据IHC分析(图3I),在KIAA1429基因敲除的异种移植组织中,WEE1表达上调。此外,结肠癌组织中WEE1的mRNA水平降低(图3J),并且与结肠癌组织中KIAA1429的mRNA水平呈负相关(图3K)。这些结果表明KIAA1429对WEE1的表达具有负调控作用。

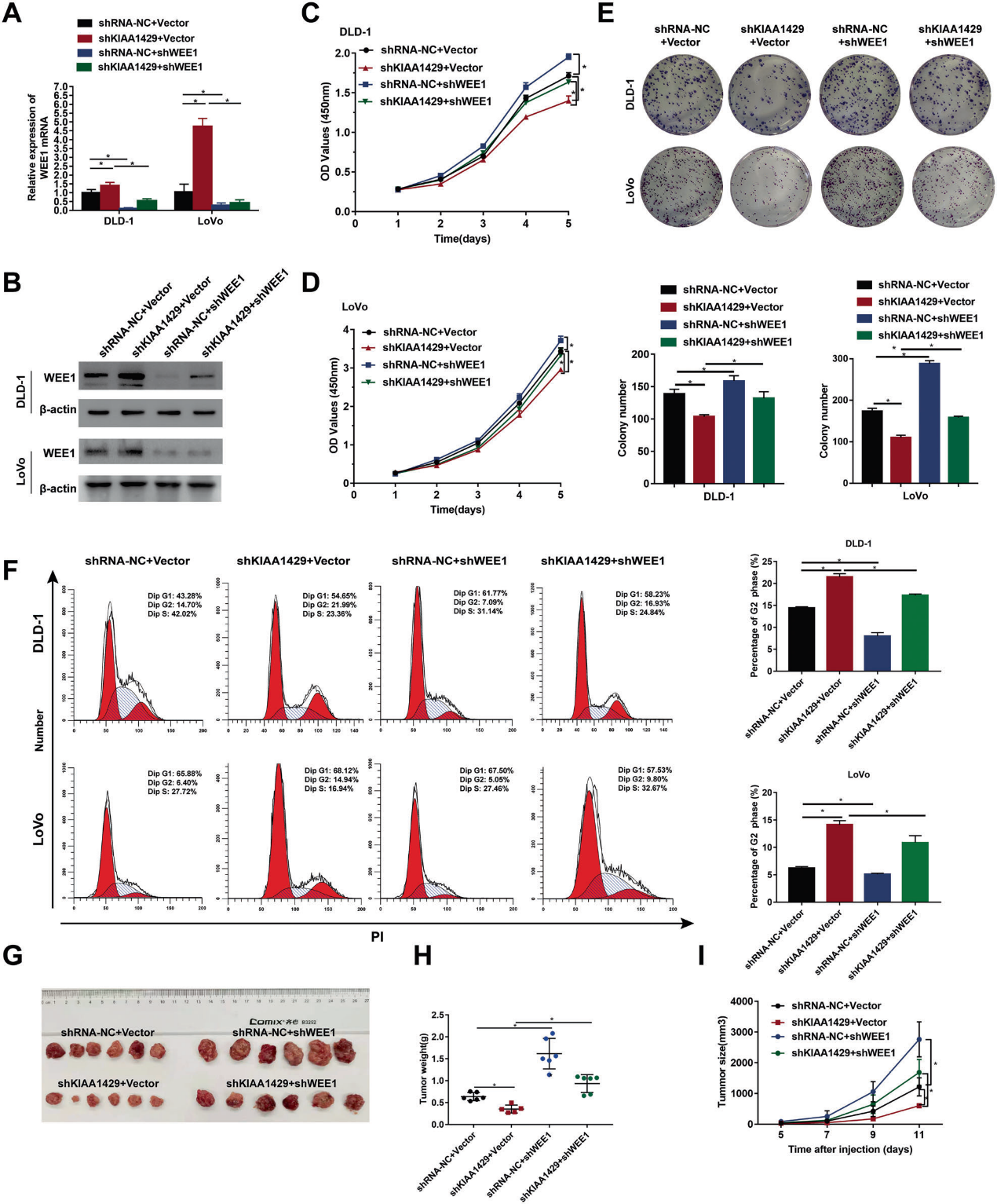
4)KIAA1429通过WEE1介导的肿瘤增殖调控促进了结直肠癌的发生
qRT-PCR和western blot检测证实沉默KIAA1429调控的增加的WEE1在WEEI敲除的DLD-1和LoVo细胞中表达明显降低(图4A,B)。WEE1的沉默逆转了DLD-1和LoVo细胞中KIAA1429基因敲除抑制的细胞增殖和集落形成能力(图4C-E)。细胞周期分析表明,敲除KIAA1429可增加G2期细胞的百分比,通过沉默WEE1可降低G2期细胞的百分比(图4F)。与这些观察结果一致,KIAA1429的敲除抑制了体内CRC肿瘤的生长,WEE1下调逆转了这种效应(图4G-I)。总之,这些发现表明KIAA1429通过调节结肠癌中WEE1的表达在促进肿瘤增殖中起着关键作用。
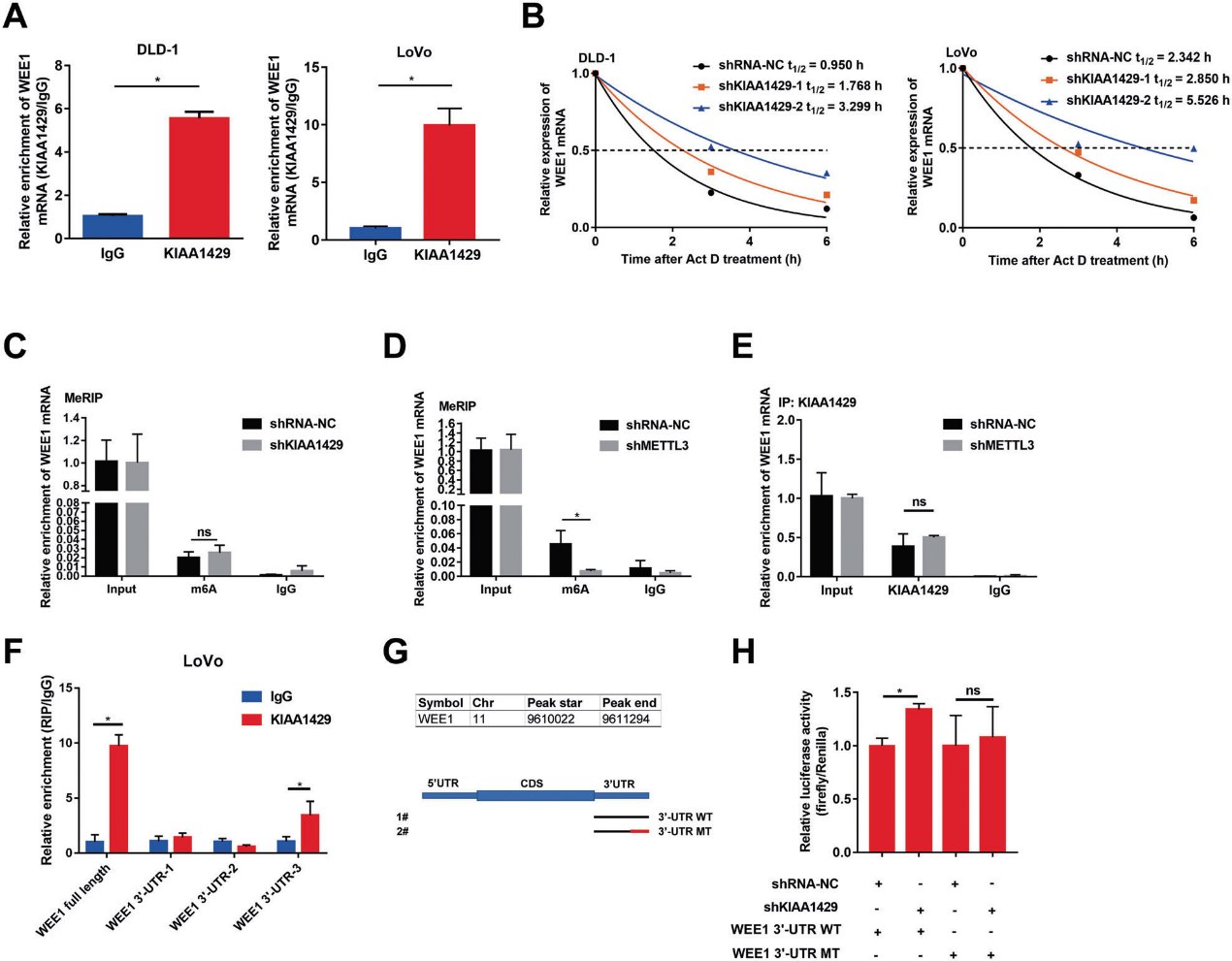
5)KIAA1429以非m6A依赖的方式调节WEE1的mRNA表达
RIP分析证实,在KIAA1429组中WEE1 mRNA显著富集,但在IgG组中未富集(图5A)。此外,在用Act D处理的DLD-1和LoVo细胞中敲除KIAA1429后,WEE1转录本的半衰期增加(图5B)。这些结果表明KIAA1429与WEE1 mRNA结合,并以转录后方式降低WEE1 mRNA的稳定性。接着,我们检测其是否以m6A依赖的方式调控WEE1的mRNA表达。结果表明,敲除KIAA1429不会改变m6A修饰的WEE1 mRNA水平(图5C)。然而,METTL3基因敲除降低了WEE1 mRNA的m6A修饰水平(图5D)。此外,METTL3敲除后,与KIAA1429相互作用的WEE1 mRNA的数量没有明显差异(图5E)。这些结果表明KIAA1429不影响WEE1 mRNA的m6A水平,并且KIAA1429和WEE1之间的相互作用不受m6A修饰的影响。接下来,我们探讨KIAA1429是否以m6A非依赖性方式降低WEE1 mRNA的稳定性。RIP序列结果显示KIAA1429与WEE1 mRNA的结合位点位于3′-UTR。为了进一步确定KIAA1429和WEE1 mRNA之间的结合位点,我们将WEE1 mRNA的预测3′-UTR分为三个片段。WEE1 mRNA中3′-UTR的第三段被抗KIAA1429抗体显著富集,但其他两段未被该抗体富集(图5F)。因此,我们对WEE1 mRNA的3′-UTR的第三段进行突变,以供进一步研究(图5G)。KIAA1429沉默后荧光素酶活性增加,经WEE1-3’-UTR MT3挽救(图5H)。综上所述,这些结果表明KIAA1429通过以m6A非依赖性方式降低WEE1 mRNA的稳定性来下调WEE1的表达。
6)丁酸通过转录因子NFκB1抑制KIAA1429的表达
我们之前的研究报告,丁酸盐是肠道菌群的代谢物,通过下调METTL3的表达抑制结直肠癌细胞增殖。因此,我们探讨了KIAA1429的表达是否也受丁酸的调控。如图6A所示,丁酸处理后KIAA1429的表达显著降低。通过生物信息学分析,我们发现转录因子NFκB1可能与KIAA1429基因的启动子区域结合。因此,我们推测丁酸可能通过降低NFκB1的表达来下调KIAA1429的表达。丁酸处理后,NFκB1和p-IKBα的mRNA和蛋白质表达水平显著降低(图6B,C)。此外,沉默NFκB1降低了KIAA1429的mRNA和蛋白质水平(图6D-F)。在敲低NFκB1后,荧光素酶活性降低,这通过KIAA1429启动子区域的突变得以挽救(图6G)。

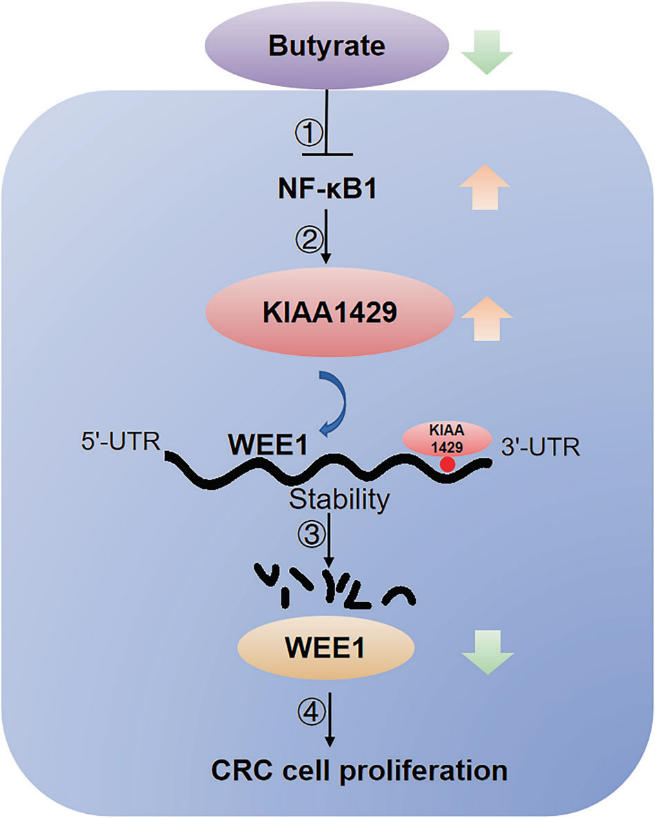
结论:我们首次报道KIAA1429是CRC中一个潜在的预后标志物,它通过m6A独立方式下调WEE1表达促进增殖。此外,KIAA1429在CRC组织中表达明显升高,与CRC患者生存率低相关。丁酸通过抑制转录因子NFκB1降低KIAA1429的表达。这些发现可能为前瞻性的多机构试验铺平道路,以测试KIAA1429作为CRC患者的潜在预后标志物和治疗靶点的临床应用。
参考文献:Ma L, Lin Y, Sun SW, Xu J, Yu T, Chen WL, Zhang LH, Guo YC, Wang YW, Chen T, Wei JF, Zhu LJ. KIAA1429 is a potential prognostic marker in colorectal cancer by promoting the proliferation via downregulating WEE1 expression in an m6A-independent manner. Oncogene. 2021 Nov 24. doi: 10.1038/s41388-021-02066-z. Epub ahead of print. PMID: 34819634.






