血管生成素通过精子tsRNA介导父系炎症引起的子代代谢紊乱
父系环境输入可影响后代的各种表型,对基础生物学、公共卫生和政策产生重大影响。然而,什么样的信号作为连接父系环境信息传递给后代的纽带仍不清楚。本研究展示了有炎症的父亲的后代表现出包括葡萄糖耐受不良和肥胖在内的代谢紊乱。并发现血管生成素(Ang)介导的5 - tsRNA在精子中的生物发生有助于父亲炎症诱导的后代代谢紊乱。本研究于2021年11月发表在《Nature Communications》IF:14.919期刊上。
技术路线:

主要研究结果:
1、父系炎症诱导子代代谢紊乱
雄性小鼠采用LPS (Inf)或生理盐水(Con)每隔1天注射4次,连续7天建立炎症模型。然后这些老鼠被允许与正常的雌性交配两天。雄性Inf F1小鼠的雄性后代体重略高于Con F1小鼠,但从8周龄开始,显著高于Con F1小鼠(Fig. 1a, b)。在13周龄时,雄性Inf F1小鼠糖耐量受损,在糖耐量试验(GTT)中血糖水平明显高于Con F1小鼠(Fig. 1c)。但是,胰岛素耐受性试验(ITT)和丙酮酸耐受性试验(PTT)结果无显著差异(Fig. 1d, e)。值得注意的是,雄性Inf F1小鼠的脂肪-肌肉比例显著升高(Fig.1f),同时脂肪细胞的平均横断面面积增加16% ( Fig. 1g, h)。在Inf F1和Con F1雄鼠之间腓骨肌的质量没有显著差异,但在跑步机试验中,通过测量最大跑步速度,Inf F1雄鼠表现出较低的运动能力( Fig. 1i)。这些结果表明,炎症父亲的后代发展为肥胖和代谢综合征样表型。
骨骼肌是葡萄糖摄取的主要部位,参与调节葡萄糖稳态。为了研究骨骼肌中葡萄糖摄取的改变是否导致Inf F1小鼠的葡萄糖耐受不良,我们采集腓肠肌,测量葡萄糖转运蛋白4 (GLUT4)的表达和分布,而GLUT4是肌肉组织中葡萄糖摄取的关键。骨骼肌的葡萄糖摄取主要依赖于GLUT4从细胞内储存库到质膜的转运。免疫组化分析表明,在雄性Con F1小鼠的肌细胞膜上表达GLUT4(Fig. 1j)。相反,雄性Inf F1小鼠肌肉表面膜中GLUT4含量明显降低,细胞质中发现GLUT4阳性小泡(Fig. 1k)。为了全面了解转录反应,对从Inf F1或Con F1小鼠肌肉样本进行RNA-seq。结果显示,差异表达基因主要富集在代谢通路(包括2型糖尿病、胰岛素信号通路和JAK-STAT信号通路)中(Fig. 1l)。
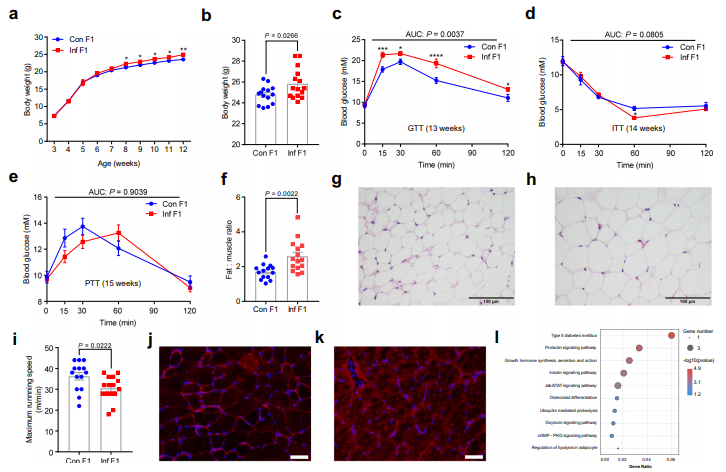
图1:父系炎症F1雄鼠体重及代谢指标
接下来,研究Ang在睾丸、附睾头和精子发育成熟的附睾尾的表达水平。LPS处理24 h后,Ang在附睾头表达上调,睾丸和附睾尾表达不上调(Fig. 2a)。在附睾头中,Ang蛋白水平也有上调(Fig. 2b)。为了研究Ang在父系炎症性代谢紊乱中的潜在作用,我们采用Ang+/+ Con、Ang+/+ Inf、Ang-/-Con和Ang-/-Inf模型,将这些小鼠与正常雌性小鼠交配,然后检测其后代的代谢参数(Fig. 2c)。Ang+/+ Inf雄性小鼠体重略有增加,但和Ang+/+ Con比显著增加(Fig. 2d)。此外,Ang+/+ Inf雄性小鼠脂肪-肌肉比例显著升高(Fig.2e),F1雄性小鼠葡萄糖显著增加(Fig.2f ,g)。但是Ang-/-Inf雄性小鼠没有表达除葡萄糖耐受性差异(Fig.2f,g)。腓肠肌质量没有显著差异(补充图3f),但在跑步试验中,Ang+/+ Inf F1小鼠显示出较低的跑步机跑步能力(Fig.2h)。然而,Ang-/-Inf雄性小鼠没有表现出任何明显的代谢异常或运动功能受损(Fig.2e-h)。以上结果表明Ang对于父亲炎症引起的后代代谢紊乱至关重要。
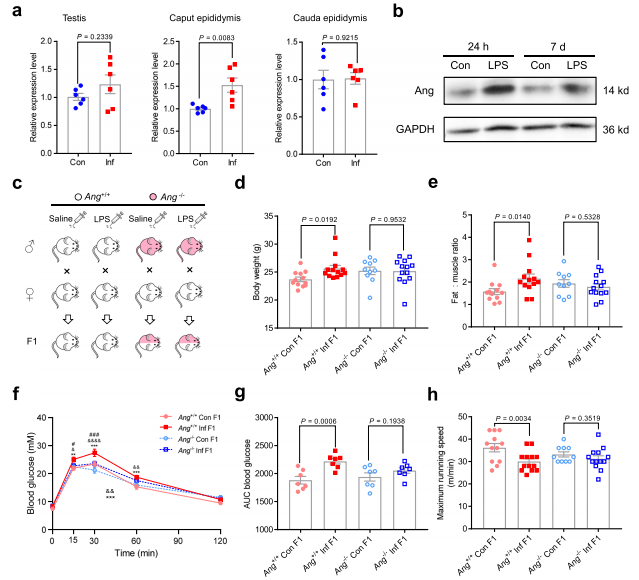
图2:Ang在炎症小鼠中的表达及炎症小鼠和Ang缺失小鼠F1雄鼠的代谢参数
3、炎症和Ang突变改变精子尾部tsRNA的表达
为了确定炎症和Ang缺失是否会影响精子中的tsRNA组成,对从Ang+/+ Con、Ang+/+ Inf、Ang-/-Con和Ang-/-Inf小鼠中分离的精子尾端进行了小RNA深度测序。根据其起源的tRNAs的区域,tsRNAs可分为4类:5’ -tsRNAs、3’ -tsRNAs、CCAtsRNAs和其他tsRNAs。4种tsRNA中,5’- tsRNA在附睾尾精子中含量最多(72.4% ~ 80.2%),3’- tsRNA、CCA - tsRNA和其他tsRNA的含量较小(Fig. 3a–h)。有趣的是,炎症和Ang缺失都会影响个体精子的5’ –tsRNAs的表达。炎症诱导5’ –tsRNAs组分微量增加,Ang缺失能导致5’ –tsRNAs组织明显减少(Fig. 3a–h)。由于30-35nt的5’- tsRNA在成熟小鼠精子中极为丰富,作者对这些RNA进行了进一步的详细分析。在30-35 nt的5’- tsRNA中,与Ang+/+ Con小鼠相比,Ang+/+ Inf小鼠中88个5’-tsRNA表达水平升高,17个基因表达水平降低(Fig. 3i)。Ang的缺失几乎完全否定了炎症对精子5’- tsRNA的影响,包括来自细胞核和线粒体编码的tRNAs (Fig. 3i-m)。炎症诱导的tsRNA的突出例子包括5’- tsRNA-Gly-GCC、5’-tsRNA-iMET-CAT和5’-MT-tsRNA-VAL-TAC,它们的丰度显示增加了2 - 3倍,而Ang缺失后又降低到基线水平(Fig. 3j-m)。令人惊讶的是,一些5’- tsRNA,如5’-tsRNA-Cys-GCA,在炎症小鼠中上调,但Ang缺失并没有逆转其表达水平(Fig. 3n)。Northern blot分析也证实了5’- tsRNA-Gly-GCC水平的变化(Fig.3o)。这些数据表明,炎症诱导的精子tsRNA组成发生显著变化,Ang缺失可以阻断炎症对精子5’-tsRNA谱的影响。
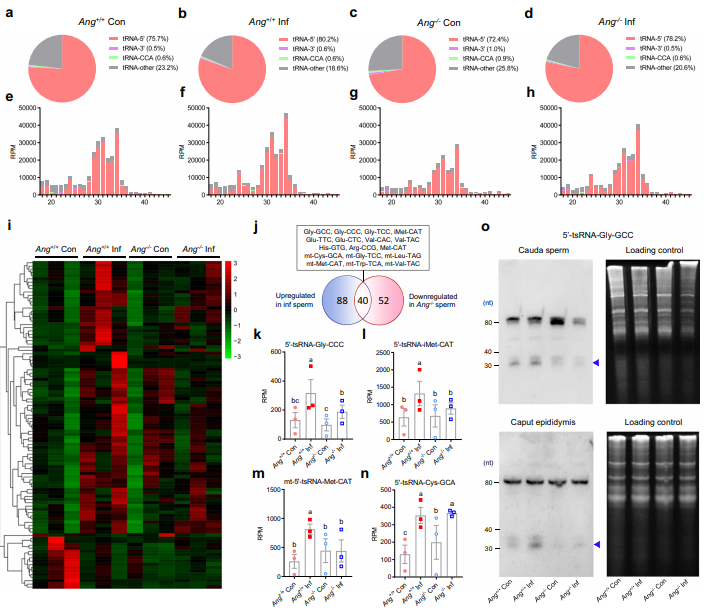
图3:炎症和Ang缺失小鼠的精子tsRNA表达
4、Ang缺失炎症男性的精子tsRNA很少引起后代的代谢紊乱
为了评估精子tsRNA是否能将父亲的信息传递给后代,作者使用Ang+/+ Con、Ang+/+ Inf、Ang-/-Con和Ang-/-Inf小鼠模型,进行合子精子RNA注射方案(Fig. 4a)。收集Ang+/+ Con、Ang+/+ Inf、Ang-/-Con和Ang-/-Inf雄性精子的30-40nt RNA片段,并进行合子注射,以水注射为对照。Ang+/+ Inf组的F1雄性后代糖耐量受损,GTT检测结果表明,与Ang+/+ Con和Ang-/-Con雄性后代以及对照组相比,葡萄糖水平明显升高(Fig. 4b-c)。相反,Ang-/-Inf组的F1雄鼠未表现出相对于Ang+/+ Inf组的代谢紊乱,而表现出与Ang+/+ Con和Ang-/-Con雄鼠及对照组相似的代谢紊乱模式(Fig. 4b-c)。Ang+/+ Inf F1雄鼠的体重微弱增加,但较Ang-/-Con组和对照组的F1小鼠显著增加(Fig. 4d)。与这些发现一致的是,与Ang+/+ Con、Ang-/-Inf和Ang-/-Con雄性后代以及对照组相比,Ang+/+ Inf子代也显示出更高的脂肪-肌肉质量比(Fig. 4e)。总之,合子注射30-40nt RNA片段的结果强烈表明,炎症雄性鼠中Ang缺失会破坏精子RNA诱导后代代谢表型的能力。
接下来,作者合成了表达最高的5’- tsRNA组合,其丰度在炎症小鼠精子中显示增加,而在精子中通过Ang缺失降低到基线水平(Fig. 3j)以研究它们是否能模拟内源性精子tsRNA的功能。精子RNA组F1雄性后代糖耐量受损,GTT检测结果表明,与重组RNA组、合成tsRNAs组及对照组相比,其葡萄糖水平明显升高(Fig. 4f, g)。引人注目的是,合成tsRNAs组的F1雄鼠与重组RNA组相比,葡萄糖水平有轻微但显著的增加(Fig. 4f, g)。此外,与重组RNA、精子RNA和对照组相比,合成的tsRNAs注射组的子代表现出更高的体重(Fig. 4h)。与这些发现一致的是,合成tsRNAs和精子RNAs组的小鼠显示出脂肪-肌肉比率升高(Fig. 4i)。总之,结果表明,合子注射一组合成的tsRNA可以部分诱导后代的代谢表型。
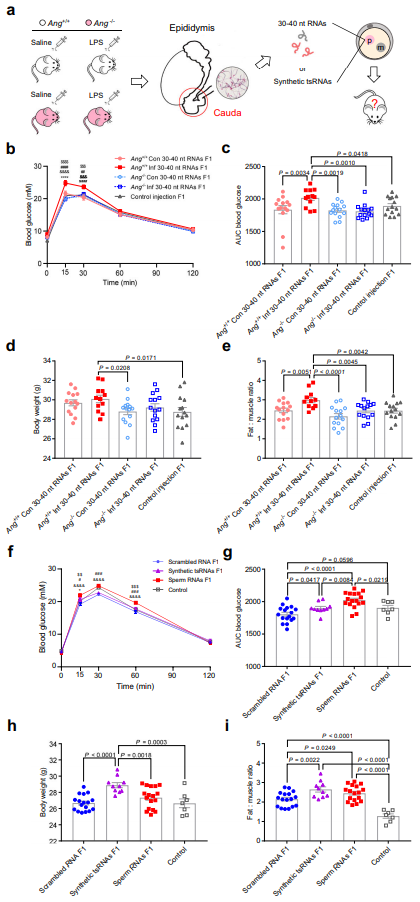
图4:精子合子注射30 ~ 40 nt RNA或合成tsRNA产生的F1雄性的体重和代谢参数
参考文献:
Zhang Yanwen., Ren Li., Sun Xiaoxiao., Zhang Zhilong., Liu Jie., Xin Yining., Yu Jianmin., Jia Yimin., Sheng Jinghao., Hu Guo-Fu., Zhao Ruqian., He Bin.(2021). Angiogenin mediates paternal inflammation-induced metabolic disorders in offspring through sperm tsRNAs. Nat Commun, 12(1), 6673. doi:10.1038/s41467-021-26909-1






