siRNA修饰的lncRNA纳米药物通过抑制心肌内皮细胞铁死亡治疗心肌肥厚
心脏微血管功能障碍与心肌肥厚相关,最终可导致心力衰竭。长链非编码RNA (lncRNAs)的异常调节被认为是心肌肥厚的关键机制之一。本文发表在《Molecular Therapy-Nucleic Acids》IF:8.886三月刊上。然而,lncRNA在心脏微血管功能障碍中的潜在作用和潜在机制尚未明确阐明。本研究结果证实心脏微血管功能障碍与心肌肥厚和心肌肥厚时心肌微血管内皮细胞(CMECs)铁死亡有关。
技术路线:

主要实验结果:
1、心肌肥厚时受损的心肌微血管发生铁死亡
不同形式的死亡,如凋亡,自噬和坏死性凋亡都已被证明和心肌肥厚相关。这些结果表明不同形式的死亡方式可以共同作用于心肌肥厚,那么一些新的细胞死亡方式可能会被忽略。铁死亡是一种铁依赖的,非凋亡性细胞死亡,部分是由致死性脂质ROS积累介导的。此外,铁死亡参与心肌损伤。基于以上作者猜想铁死亡可能也参与了心肌肥厚。检测结果发现铁死亡相关蛋白ferrostatin-1 (Ferr-1)减少了心肌肥厚模型组心脏中脂质过氧化的增加,通过检测MDA和ptgs2水平(图1A-B)。并且,Ferr-1处理减少了模型组心脏H2AX的表达(图1C-D)。此外,电子显微镜下观察到心肌微血管内皮线粒体在AAC处理大鼠中显著变形和萎缩,这是铁死亡发生的典型标志,而这些现象在Ferr-1处理后显著减少(图1E)。明胶-墨水染色显示Ferr-1显著增加了心脏微血管密度(图1F),并可以改善心肌微血管功能,表现为p-eNOS蛋白,NO含量和cGMP增加(图1G-1J)。进一步研究发现,Ferr-1处理减少了ROS、脂质过氧化、ptgs2表达的增加(图1K-1M),并增加了AngⅡ诱导的CMEC细胞活力(图1N-1O),p-eNOS的表达(图1R-1S),并增加了AngⅡ诱导的CMEC细胞中的NO含量。这些结果表明铁死亡发生在心肌微血管损伤过程中,提示Ferr-1对肥厚性心脏的保护作用可能通过抑制铁死亡来改善CMEC功能。
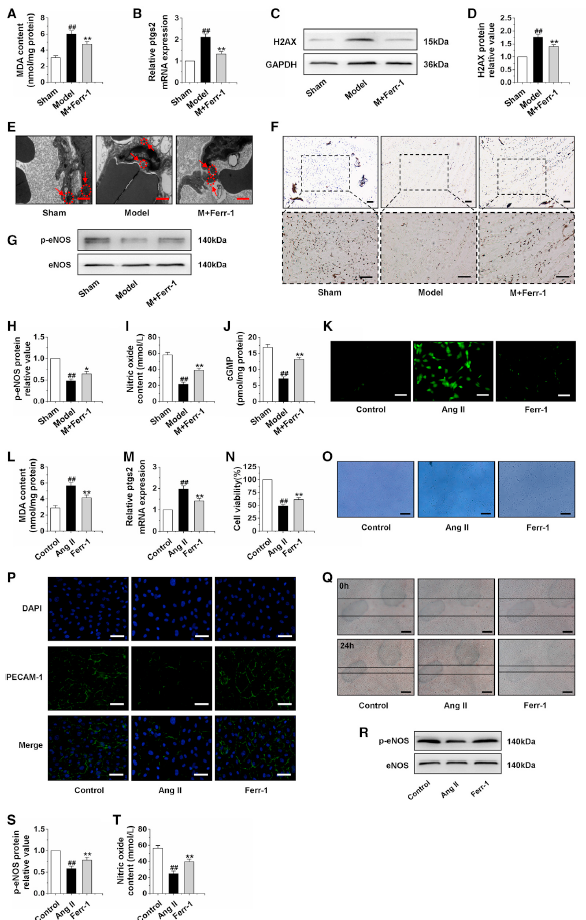
图1抑制铁死亡改善CMECs的功能
2、心肌肥厚心脏中MMP9/TIMP1比值失衡导致CMECs功能障碍
MMP9/TIMP1的失衡参与多种疾病的发生发展,作者的前期研究也发现心肌肥厚大鼠心脏和CMEC细胞中均存在MMP9/TIMP1失衡。在这里,作者证明TIMP1沉默导致MMP9表达显著增加(图2A-D),以及增加AngⅡ诱导的CMEC细胞活力(图2E-F)。为探讨MMP9/TIMP1失衡对CMECs功能的影响,采用免疫荧光和western blot检测PECAM-1的表达,结果发现在AngⅡ处理的CMECs中,PECAM-1的表达明显缺失,而TIMP1的沉默显著提高了PECAM-1的表达(图2G-2I)。此外,Ang II抑制细胞迁移和管形成能力,p-eNOS表达和NO含量,而TIMP1沉默显著反转这些作用(图2J-N)。这些结果表明MMP9/TIMP1失衡导致CMECs功能障碍。
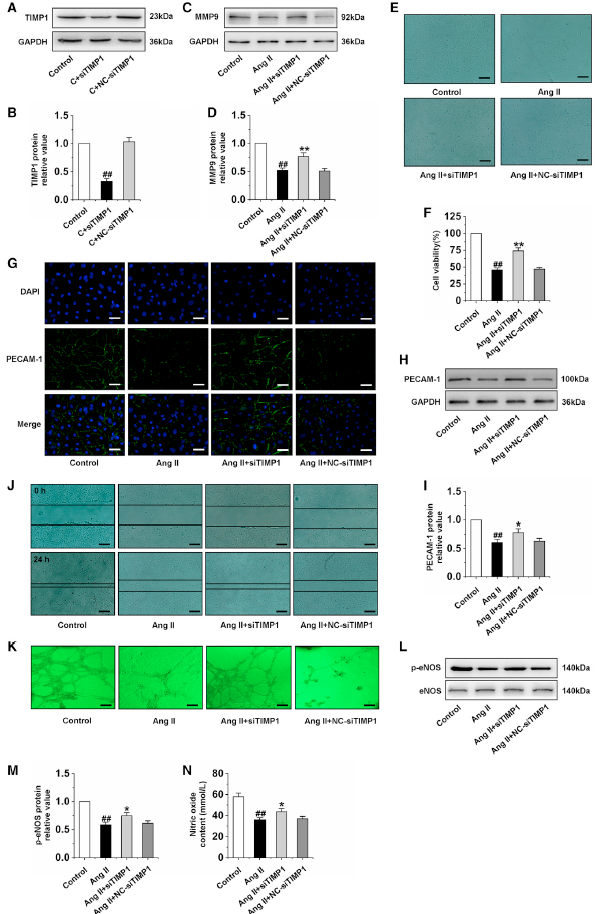
图2沉默TIMP1改善AngⅡ诱导的CMECs功能异常
3、MMP9/TIMP1比值失衡诱导CMECs铁死亡通过激活TFR-1
随后探究TIMP1沉默保护CMEC功能的机制。作者检测了铁死亡相关蛋白的表达,包括SLC7A11,GPx4,TFR-1,Fpn1,结果表明沉默TIMP1显著抑制AngⅡ诱导的TFR-1表达的增加,但对SLC7A11,GPx4,Fpn1蛋白表达没有影响 (图3A-B)。进一步研究表明,沉默TIMP1显著降低了铁离子水平,ROS和MDA的含量,以及ptgs2 mRNA的表达(图3C-3F)。图3G表明沉默TIMP1可以抑制CMECs细胞的死亡。提示MMP9/TIMP1比值的降低通过激活TFR-1导致CMEC铁死亡。
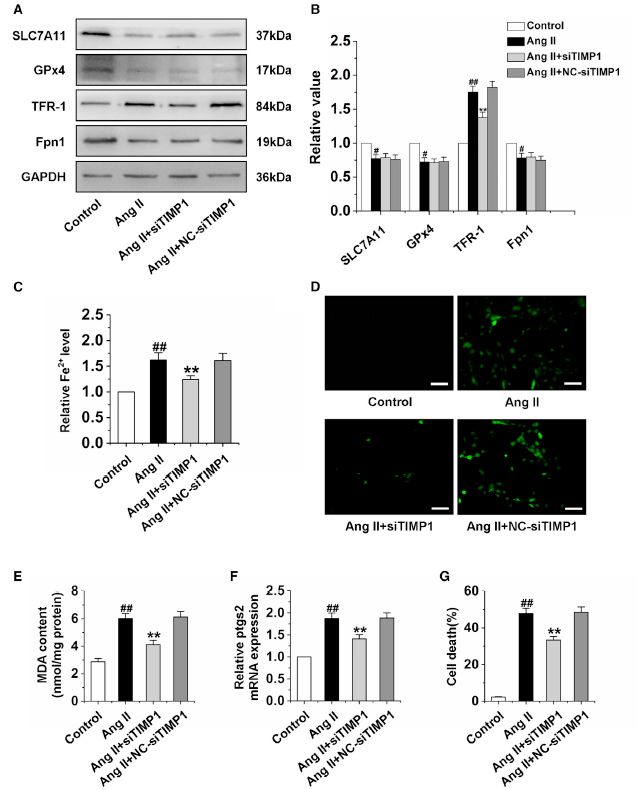
图3沉默TIMP1抑制CMEC铁死亡通过下调TFR-1
4、miR-30b-5p抑制AngⅡ诱导的CMECs的铁死亡
通过在线软件发现miR-30b-5p与TIMP1的3’UTR区域有互补配对序列(图4A)。荧光素酶实验揭示miR-30b-5p能够抑制野生型(WT) TIMP1的荧光素酶活性,而TIMP1 3’UTR的突变形式对miR-30b-5p的反应较弱(图4B)。心肌肥厚大鼠心肌组织和Ang II诱导的CMECs中miR-30b-5p降低(图4C-4D)。下一步将miR-30b-5p mimic和AMO-miR-30b-5p转染至CMECs,检测miR-30b-5p对CMECs铁死亡反应的影响(图4E)。在Ang II-induced CMECs,过表达miR-30b-5p导致TIMP1和TFR-1蛋白表达,ROS和MDA含量,铁离子浓度,ptgs2的mRNA水平显著降低,并显著提高细胞生存能力和MMP9的蛋白表达,而这些效果能被AMO-miR-30b-5p逆转(图4F-M)。表明过表达miR-30b-5p可显著抑制暴露于Ang II的CMECs的铁死亡。然而,AMO-miR-30b-5p抑制了miR-30b-5p对CMECs的保护作用(图4N)。
随后,lncRNA的ceRNA机制调控引miR-30b-5p起了作者的兴趣。作者发现有11个lncRNA与miR-30b-5p共享一个高度保守的结合位点。检测了这11个lncRNA在心肌肥厚大鼠心肌组织中的表达变化,结果显示lncRNA AC115159.2、lncRNA AABR07017145.1 (lncRNA AAB)和lncRNA AABR07030334.1的mRNA表达显著上调(图4O)。qRT-PCR检测这三种lncRNA在CMECs中对Ang II处理的响应,发现在这些lncRNA中,只有lncRNA AAB显著升高(图4P)。图4Q展示了lncRNA AAB和miR-30b-5p之间的结合位点。荧光素酶实验显示,miR-30b-5p可抑制TIMP1的荧光素酶活性,但该抑制可被lncRNA AAB逆转,AAB-mut突变形式对TIMP1的荧光素酶活性影响较小(图4R)。这些结果表明lncRNA AAB通过与miR-30b-5p相互作用,进而调控CMECs的铁死亡。
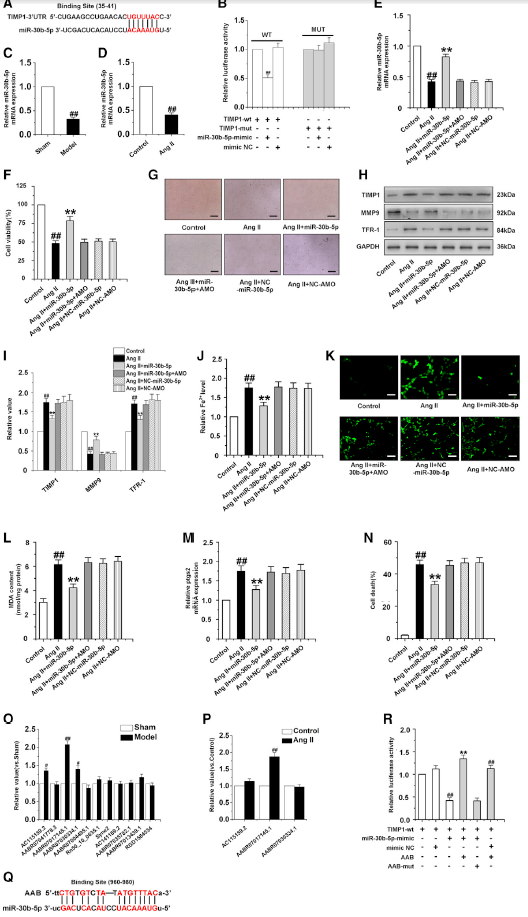
图4 miR-30b-5p抑制AngⅡ诱导的CMECs的铁死亡
5、纳米复合物的制备、表征和细胞摄取
因此,如果能够通过纳米复合物有效地传递lncRNA AAB的小干扰RNA (siRNA),就有可能抑制CMECs的铁死亡。接下来,作者展示了纳米复合物的制备和表征。如图5A所示,中性粒细胞膜(NM) + si-AAB +单聚二氧化硅纳米复合物(MSN)清楚地表现出真核细胞样结构,最外层为浅灰色的软层,厚度为10 nm,与活细胞膜的厚度一致。所得到的MSNs为均匀的纳米球,平均粒径约为100 nm,如扫描电镜图像所示(图5B-5C)。将孔径调整到适合siRNA负载的大小,表面积保证了siRNA的高负载能力。此外,MSNs可进行生物降解当在胎牛血清中孵育24 h,这对体内药物有效的释放和减少机体免疫副作用和积累具有重要意义。通过zeta电位的测定来研究MSN的表面修饰和电荷变化。当MSN上载siRNA时,zeta电位下降到-14.6±1.06 mV,这与siRNA的负电荷有关(图5D)。为了进一步证实MSNs的介孔结构,检测了MSNs纳米粒子的比表面积和孔径。值分别为519 m2 g−1和2.4 nm左右排列良好的介孔(图5E插图),可以满足后续siRNA的加载。x射线衍射(XRD)图显示,由于MSNs是无定型的,所以MSNs没有明显的峰值,但在2θ(22°)处有一个宽衍射峰(图5F)。通过SDS-PAGE凝胶电泳,观察到细胞膜和NM + si-AAB + MSN样品中LFA-1和β2整合素的条带(图5G)。LFA-1和β2整合素的存在,保证了NM + si-AAB +MSN对损伤CMECs的有效靶向作用。
为了证明Ang II可以诱导CMECs损伤和炎症,通过western blot检测了ICAM-1的水平(图5H-5I)。为了证明NM + si-AAB + MSN对CMECs的特异性识别和靶向传递,使用Ang II诱导CMs和CMECs损伤,然后和NM + si-AAB + MSN共孵育,并进行染色。在CM中观察到的FITC信号较弱,表明对NM + si-AAB + MSN的摄取较少,而在CMEM中,FITC信号增强了3.8倍(图5J-5K)。此外,细胞摄取si-AAB + MSN和NM + si-AAB + MSN的结果经过流式分析,发现NM + si-AAB + MSN组的摄取信号显著增加(图5L-5M)。以上表明NM + si-AAB + MSN可以被CMEM特异性获取。
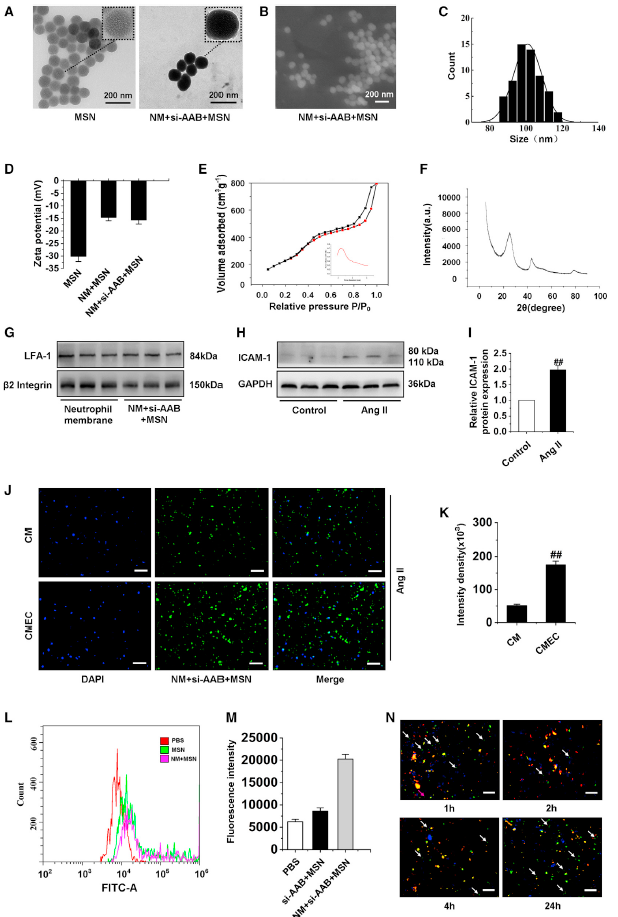
图5纳米复合物的准备和鉴定
6、NM + si-AAB + MSN抑制CMEM铁死亡通过上调miR-20b-5p
图6A展示了细胞内化和纳米复合物细胞内结构解构,包括靶向识别、细胞内化、胞内细胞膜分离,和NM + si-AAB + MSN的降解以及siRNA释放。在这种良好的减少反应下,NM + si-AAB + MSN可以有效地沉默CMECs中lncRNA AAB的表达,当siRNA剂量为30 nM时可以抑制超过70%的lncRNA AAB的表达(图6B)。图6C和图6D显示,和AngⅡ组相比,si-AAB + MSN和NM + si-AAB + MSN组的CMEM细胞活力显著增加。图6E表明AngⅡ诱导导致CMEM细胞的PECAM-1不完全染色,而si-AAB + MSN和NM + si-AAB + MSN组的外周染色均匀。进一步研究发现si-AAB + MSN和NM + si-AAB + MSN显著上调miR-30b-5p的表达和MMP9的蛋白表达,下调TIMP1和TFR-1的蛋白表达(图6F-6H)。与Ang II组相比,si-AAB组的铁离子、ROS、MDA、ptgs2水平和细胞死亡几乎没有变化,而si-AAB +MSN和NM + si-AAB +MSN组的铁离子、ROS、MDA、ptgs2水平和细胞死亡明显降低,且NM + si-AAB +MSN组最低,表明NM + si-AAB +MSN可以有效抑制铁死亡(图6I-6M)。这些结果表明,NM + si-AAB + MSN通过上调miR-30b-5p对Ang II暴露的CMECs的铁死亡抑制作用最有效。
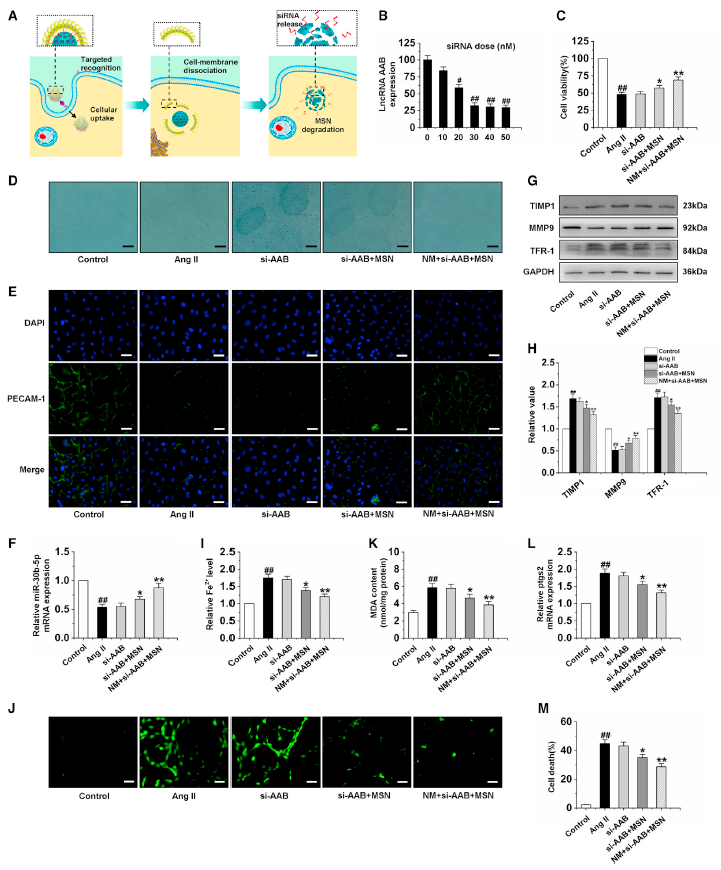
图6通过NM+si-AAB+MSN沉默lncRNA AAB反转CMEC的铁死亡
7、NM+si-AAB+MSN修复心肌肥厚的心肌微血管内皮的损伤
在AAC处理建立心肌肥厚动物模型后,将心肌肥厚大鼠随机分为4组。24 h后,心肌肥厚大鼠分别经尾静脉注射PBS、si-AAB、si-AAB +MSN、NM + si-AAB +MSN,每2 d注射1次,连续4周(图7A)。为了确保NM + si-AAB + MSN始终能够靶向心脏,在AAC后的第3天、第9天和第27天测定了心肌组织中ICAM-1的蛋白水平。结果显示,ICAM-1在这些不同时间点的蛋白表达明显高于假手术组(图7B和7C)。然后,通过定量MSN荧光信号的生物成像研究了纳米复合物在心脏的分布。si-AAB + MSN组心脏出现轻微荧光信号;在NM + si-AAB + MSN组中,心脏中观察到明显信号,表明纳米复合物对受损的内皮细胞具有良好的靶向特异性(图7D)。观察NM + si-AAB +MSN对肥厚心脏微血管铁死亡的体内治疗作用。电镜观察结果显示,PBS处理模型组CMEC细胞线粒体萎缩(图7E)。si-AAB组和si-AAB +MSN组的铁离子水平变化不明显,而NM + si-AAB +MSN组的铁离子水平明显下降,说明NM + si-AAB +MSN对心肌微血管具有良好的抗铁死亡作用。此外,NM + si-AAB + MSN可增加心肌微血管密度(图7F),并在恢复LVEF和LVFS方面表现较好(图7G-7I)。脑室组织病理学显示与PBS处理模型组相比,只有NM + si-AAB + MSN组产生的截面积更小,表现出明显的心脏形态保护作用(图7J和7K)。与模型组相比,si-AAB和si-AAB +MSN组BNP和β-MHC蛋白水平变化不大,而NM + si-AAB +MSN组BNP和β-MHC蛋白水平显著降低,表明NM + si-AAB +MSN在体内能有效抑制心肌肥厚(图7L-7M)。以上表明,M+si-AAB+MSN能在体内修复心肌肥厚的心肌微血管内皮的损伤。
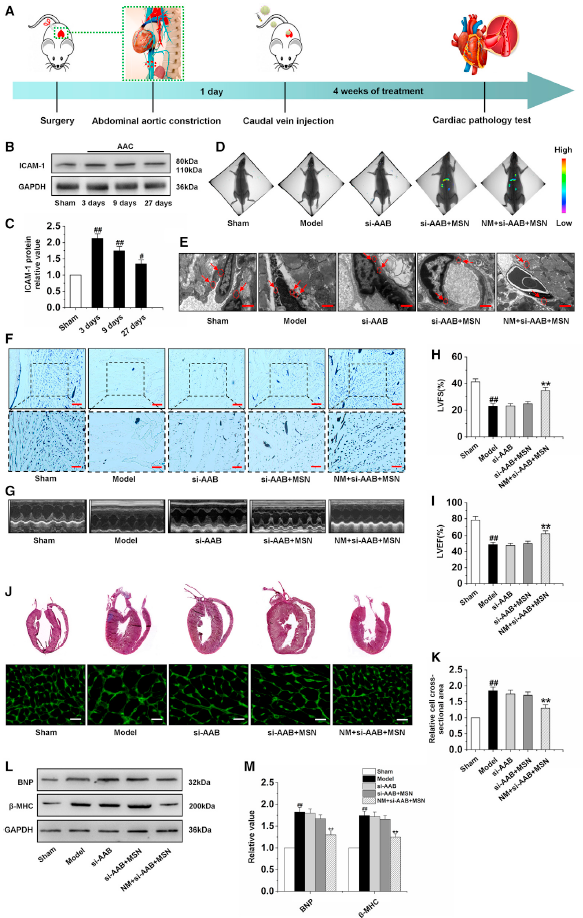
图7通过NM+si-AAB+MSN沉默lncRNA AAB抑制心肌肥厚
总之,如图8所示,本研究通过合理设计纳米复合物,实现了si-AAB高效加载和细胞膜覆盖,从而有效地履行其对心肌肥厚内皮损伤的精确修复功能。
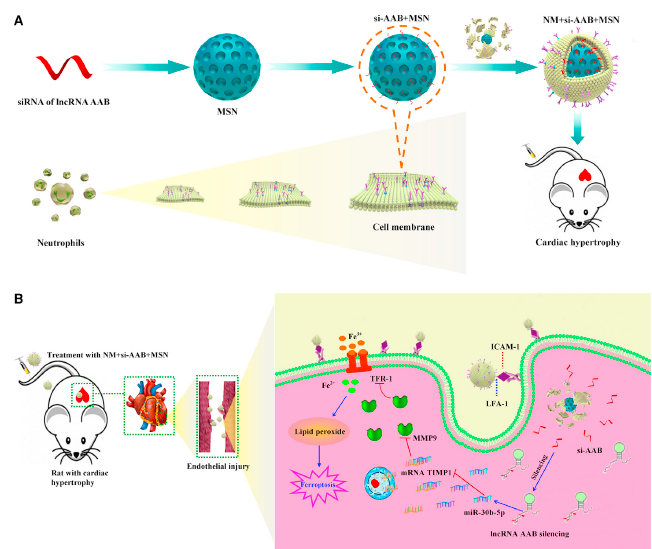
图8 NM+si-AAB+MSN通过抑制CMEC铁死亡调节心肌肥厚的机制模型图
参考文献:
Shi Pilong., Li Minghui., Song Chao., Qi Hanping., Ba Lina., Cao Yonggang., Zhang Meitian., Xie Yawen., Ren Jing., Wu Jiabi., Ren Ping., Sun Hongli.(2022). AABR07017145.1Neutrophil-like cell membrane-coated siRNA of lncRNA therapy for cardiac hypertrophy via inhibiting ferroptosis of CMECs. Mol Ther Nucleic Acids, 27(undefined), 16-36. doi:10.1016/j.omtn.2021.10.024






