m6A轻松发6分 还不快学起来!
大多数局限性人肾透明细胞癌(ccRCC)相关的死亡是由于癌症的复发和转移。然而,精确的分子机制在很大程度上仍是未知的。近年来,越来越多的lncRNA被证明是肿瘤发生的重要调控因子。本研究发现lncRNA DUXAP9具有预后价值,其m6A修饰通过激活PI3K/AKT信号通路促进肾癌细胞的增殖和运动。因此认为DUXAP9可能是一种有用的预后标志物和ccRCC的潜在治疗靶点。本研究于2021年6月发表在《Frontiers in Oncology》IF:6.244期刊上。
技术路线:

主要实验结果:
1、lncRNA DUXAP9在局限性ccRCC中上调并与不良预后呈正相关
首先检测了来自SYSUCC生物库的112对原发性局限性ccRCC和邻近非肿瘤组织中DUXAP9的表达。结果显示,与癌旁非肿瘤组织相比,DUXAP9在ccRCC组织中表达增加(Figure 1A)。利用X-tile软件(基于积分光密度),获得了将这些患者分为高表达组和低表达组的截断值(Figure 1B)。此外,Kaplan-Meier分析表明,DUXAP9上调与较差的OS和PFS显著相关(Figures 1C, D)。Umrc6和Caki-1细胞株中DUXAP9的表达明显高于其他细胞株。使用FISH和亚细胞分离实验证实DUXAP9不仅定位于Umrc6细胞的细胞核,而且也定位于细胞质(Figures 1F, G)。

为了验证上述结果,分析了TCGA数据在445个局限性ccRCC组织和72个正常肾组织中DUXAP9的表达情况。与正常肾组织相比,DUXAP9在局限性ccRCC中显著上调(Figure 2A)。此外,如Figures 2B-D的小提琴图所示,DUXAP9在局限性ccRCC中的表达随着T分级(P=0.011)、分期(P=0.010)和分级(P=0.027)的增加而增加。此外,DUXAP9上调与较差的OS和PFS相关(Figures 2E, F)。
综上所述,DUXAP9在局限性ccRCC中上调表达并与不良预后呈正相关。

2、DUXAP9促进RCC细胞增殖,抑制细胞凋亡
为了确定DUXAP9上调对局限性ccRCC的影响,在Umrc6和Caki-1细胞中使用靶向DUXAP9的shRNA敲除DUXAP9 (Figures 3A, B),并在786-O细胞中过表达DUXAP9 (Figures 3C)。CCK-8和菌落形成实验表明,DUXAP9敲低可显著抑制Umrc6和Caki-1细胞的增殖,过表达DUXAP9可显著增加786-O细胞的增殖(Figures 3D-I)。此外,DUXAP9敲除后,均可在Umrc6和Caki-1细胞中观察到细胞凋亡。因此,作者想知道DUXAP9是否可以调节细胞凋亡,导致细胞增殖。流式细胞术显示DUXAP9敲除后肾癌细胞的凋亡率明显升高(Figures 3J, K),且DUXAP9敲除后,抗凋亡蛋白Bcl-2显著降低,促凋亡蛋白Bax、cleaved caspase-8、cleaved caspase-3、cleaved PARP显著升高(Figure 3L)。这些结果证实了DUXAP9是一种重要的凋亡介质。
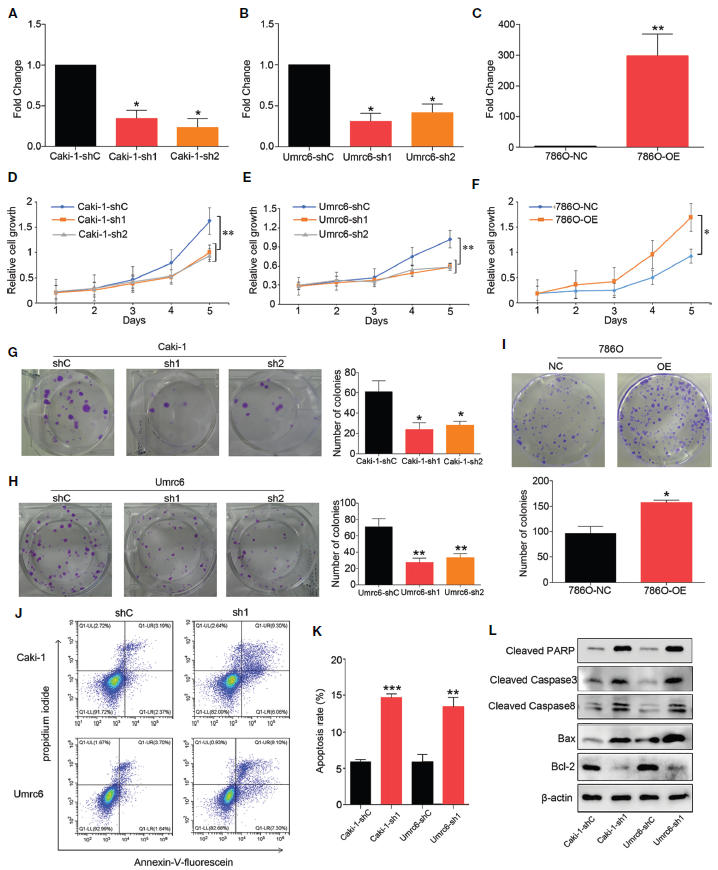
3、DUXAP9促进RCC细胞迁移和侵袭,参与EMT
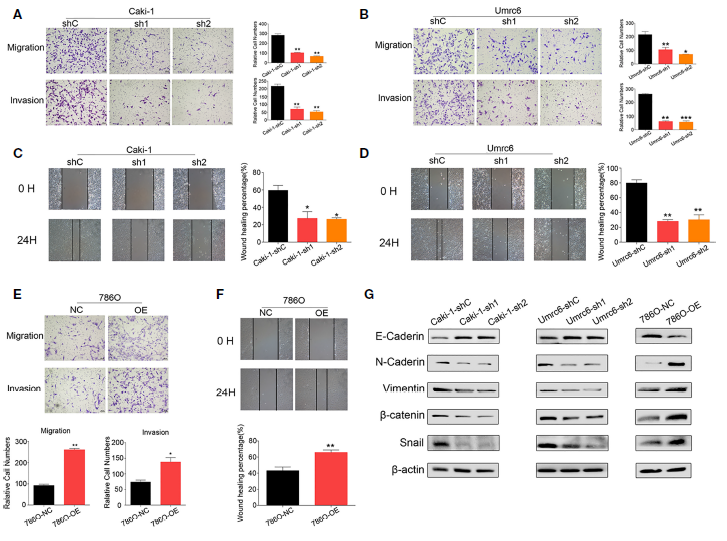
进一步探讨了DUXAP9对肾癌细胞迁移和侵袭的影响,结果显示, DUXAP9下调显著抑制Caki-1和Umrc6细胞的体外迁移和侵袭能力;与对照细胞相比,DUXAP9在786-O细胞中的过表达显著增加了细胞的迁移和侵袭能力(Figures 4A–F)。由于EMT在晚期肿瘤的运动能力中起着至关重要的作用,作者评估了RCC中的DUXAP9是否激活EMT通路。如预期的那样,DUXAP9敲除Caki-1和Umrc6细胞后,N-cadherin、vimentin、β-catenin和Snail水平下降,而E-cadherin水平升高。相反,在786-O细胞中过表达DUXAP9后,E-cadherin水平下调,而N-cadherin、vimentin、β-catenin和Snail水平上调(Figures 4G)。以上结果表明DUXAP9促进RCC细胞迁移和侵袭,参与EMT。
4、IGF2BP2通过依赖m6A的方式提升DUXAP9的稳定性
为了研究DUXAP9调控RCC的潜在分子机制,采用RNA pull-down和质谱分析来鉴定与DUXAP9结合的蛋白。在Caki-1细胞中,IGF2BP2直接与DUXAP9结合而不是反义对照 (Figure 5A)。此外,RIP-qPCR检测验证了在Caki-1细胞中IGF2BP2和DUXAP9之间的相互作用,使用IGF2BP2特异性抗体与对照IgG抗体比较,证实了DUXAP9的富集(Figure 5B)。IGF2BP2是一种RNA结合蛋白,被称为m6A阅读器,以依赖m6A的方式增强RNA的稳定性。
利用SRAMP(一种m6A修饰位点预测器)在DUXAP9序列中发现了一个经典的m6A基序(GAACT),因此作者想知道DUXAP9是否表现出m6A修饰,这可以维持其在肾癌细胞中的命运。MeRIP检测和qPCR分析显示,在Caki-1细胞中,DUXAP9与对照IgG抗体相比高度富集,证实了DUXAP9中m6A修饰(Figure 5C)。此外,通过pull-down检测,DUXAP9中m6A基序的突变降低了IGF2BP2的结合(Figure 5D)。这说明IGF2BP2与DUXAP9的结合依赖于m6A修饰。
为了探究IGF2BP2是否影响了DUXAP9在RCC中的稳定性,在Caki-1和Umrc6细胞中敲除IGF2BP2或METTL3,发现DUXAP9的水平一开始是下降的(Figures 5E, F)。然后,用转录抑制剂更生霉素处理IGF2BP2 敲除细胞,证实DUXAP9的半衰期显著降低(Figures 5G, H)。同时,当敲除METTL3时,一种重要的m6A甲基转移酶,被称为m6A writer,METTL3在Caki-1和Umrc6细胞中的抑制作用使DUXAP9的半衰期显著缩短(Figures 5I, J)。此外,在METTL3敲除后,与对照IgG抗体相比,使用IGF2BP2-或m6A特异性抗体时,DUXAP9在RIP-qPCR检测中的富集显著降低(Figures 5K, L)。这些结果表明,IGF2BP2在肾癌细胞中与DUXAP9结合,并以m6A依赖的方式促进DUXAP9的稳定性。

5、DUXAP9激活肾癌细胞中PI3K/Akt信号通路和Snail表达
为了确定DUXAP9在RCC中的潜在作用机制,对DUXAP9敲除的Caki-1细胞和对照Caki-1细胞进行RNA测序,然后进行KEGG富集分析(Figure 6A)。发现DUXAP9与Akt信号通路相关,与TCGA数据的GSEA结果一致(Figure 6B)。此前有报道称,通过激活Akt信号通路促进EMT在肿瘤进展中发挥重要作用。作者探讨了DUXAP9是否参与了Akt诱导的EMT、肿瘤生长和侵袭。Western blotting证实与对照细胞相比,DUXAP9敲除的Caki-1和Umrc6细胞PI3K、p-Akt和p-mTOR下调。与此相反,在786-O细胞中DUXAP9过表达上调了这些蛋白的表达(Figure 6C)。
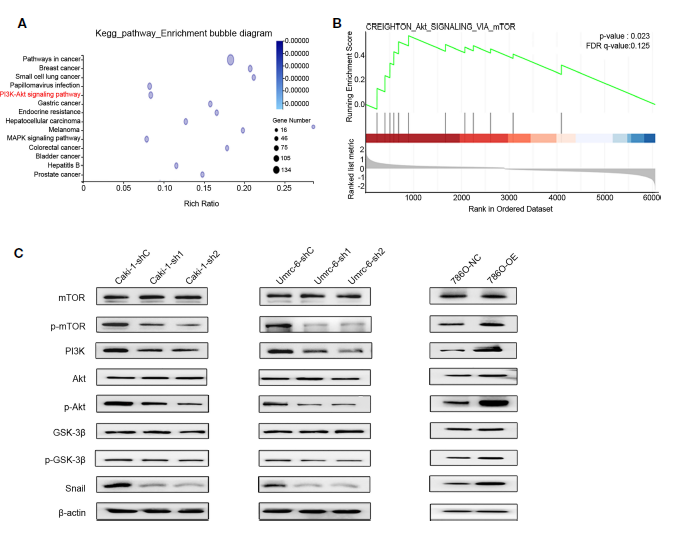
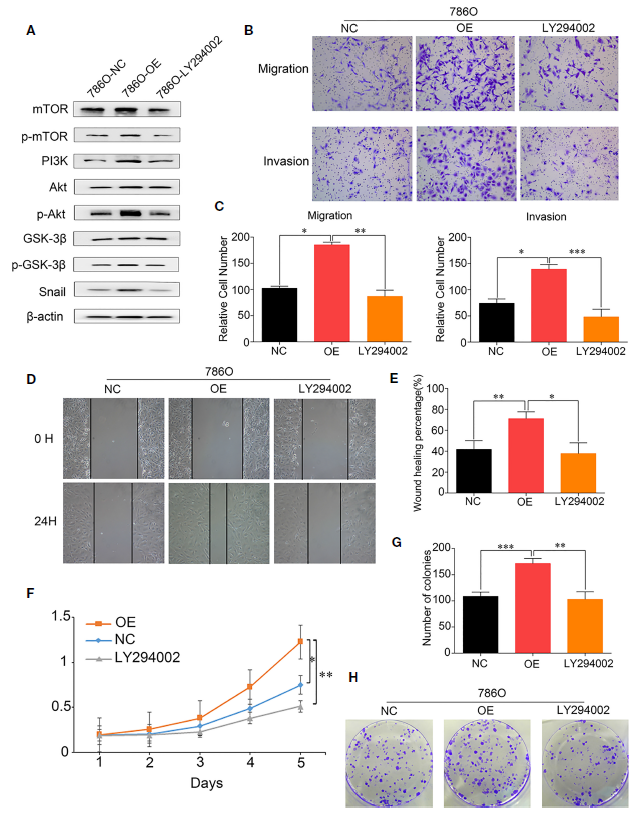
为了进一步研究DUXAP9对RCC中Akt信号通路影响的机制,使用PI3K抑制剂LY294002试图消除DUXAP9过表达对Akt信号通路的影响。用终浓度为20 μmol/L的LY294002培养24 h,随后Western blotting分析显示,LY294002可以抑制之前上调的p-mTOR、p-Akt、p-GSK3β和Snail的表达水平,并伴有DUXAP9过表达(Figure 7A)。Transwell细胞迁移/侵袭和伤口愈合实验证实LY294002的使用显著限制了DUXAP9过表达对体外迁移和侵袭能力的影响(Figures 7B–E)。通过CCK-8试验和集落形成试验证实了LY294002处理肾癌细胞也会削弱DUXAP9过表达细胞的肿瘤细胞生长进程(Figures 7F–H)。
参考文献:
Tan L, Tang Y, Li H, Li P, Ye Y, Cen J, Gui C, Luo J, Cao J, Wei J. N6-Methyladenosine Modification of LncRNA DUXAP9 Promotes Renal Cancer Cells Proliferation and Motility by Activating the PI3K/AKT Signaling Pathway. Front Oncol. 2021 Jun 8;11:641833. doi: 10.3389/fonc.2021.641833. PMID: 34168980; PMCID: PMC8217835.






