RNA N6甲基腺苷读取器IGF2BP2以m6A依赖的方式稳定slug mRNA促进头颈鳞癌细胞的淋巴转移和上皮间质转化
淋巴结转移是头颈部鳞癌(HNSCC)患者预后不良的主要原因。N6甲基腺苷(m6A)RNA修饰是一种新兴的基因表达表观遗传调控机制,IGF2BP2作为一种新的m6A读取器蛋白参与肿瘤的进展和转移。然而,目前对IGF2BP2在中的功能作用知之甚少,IGF2BP2是否通过m6A修饰在HNSCC中调节淋巴转移仍有待确定。目前,有相关研究于2022年1月发表在《JOURNAL OF EXPERIMENTAL & CLINICAL CANCER RESEARCH》,IF: 11.161。
技术路线:

主要研究结果:
1. m6A调控因子在HNSCC中的表达及临床意义
为了研究m6A修饰在HNSCC中的作用,从TCGA数据库中分析了502个HNSCC和44个正常组织中20个m6A相关调控因子的表达谱。如图1A和B所示,与正常组织相比,HNSCC组织中20个m6A调控基因中有18个显著上调,包括6个writers(VIRMA、ZC3H13、METTL14、METTL3、WTAP和RBM15)、2个erasers(FTO和ALKBH5)和10个readers(IGF2BP2、IGF2BP1、IGF2BP3、YTHDF3、YTHDF2、YTHDC1、YTHDF1、HNRNPC、RBMX和HNRNPA2B1)。HNSCC组织和正常组织中YTHDC2和RBM15B的表达水平无统计学差异。临床相关性中,只有IGF2BP2的高表达与HNSCC患者较低的生存概率相关(图1C)。Kaplan-Meier生存分析、多变量cox回归分析后和病理N分期均表示IGF2BP2被确定为HNSCC中潜在的预后生物标志物(图1C-1G)。
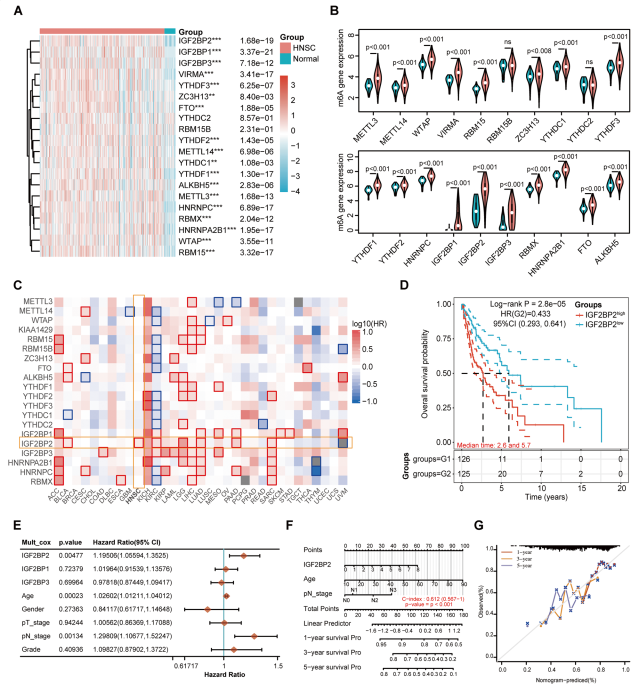
图1 m6A调控因子在HNSCC中的表达及临床意义
2. IGF2BP2在HNSCC组织中的高表达与淋巴转移有关
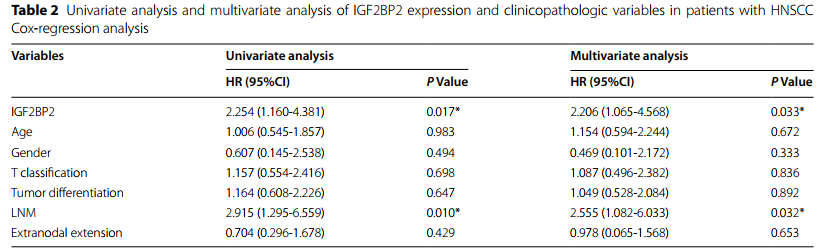
临床组织样本中q-PCR和western blot均表示IGF2BP2在HNSCC肿瘤样本中过表达(图2A,2B)。通过临床病理特征和随访数据,IGF2BP2在NATs中表达量较低,在未发生淋巴转移的HNSCC组织中表达量略有升高,但在有淋巴转移的HNSCC组织中表达量强烈上调(图2E,2F),且IGF2BP2高表达与较低的OS概率相关(图2G)。此外,临床病理特征分析显示,IGF2BP2表达与病理N分型和淋巴结转移显著相关(表1)。单因素和多因素Cox回归分析显示,IGF2BP2表达是HNSCC患者的独立预后因素(表2)。总之,这些结果表明,在HNSCC中IGF2BP2高表达,并在淋巴结转移中发挥重要作用。
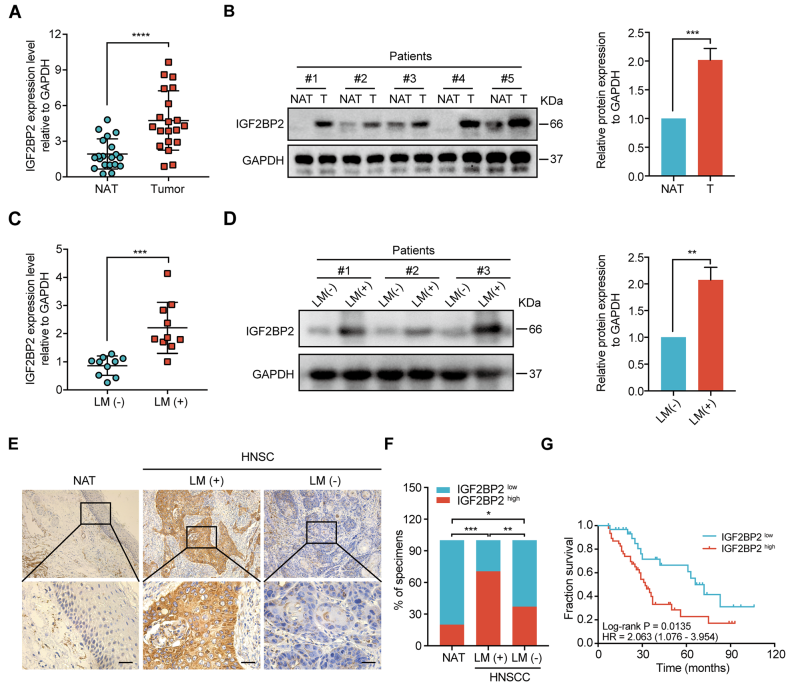
图2 IGF2BP2在HNSCC组织中高表达,与淋巴转移相关

为了明确IGF2BP2是否能诱导HNSCC细胞的迁移和侵袭能力,对IGF2BP3进行敲降和过表达。通过RT-qPCR和western blot验证了敲除和过表达的有效性(图3A,3B)。创伤愈合分析表明,IGF2BP2的敲除抑制了FaDu和SCC15细胞的迁移能力,而过表达IGF2BP2后则出现相反的结果(图3C,3D)。Transwell分析进一步证实了这一结果,显示沉默IGF2BP2可减弱FaDu和SCC15细胞的迁移性和侵袭性,而过表达IGF2BP2则增强了细胞的转移。总之,这些数据表明IGF2BP2促进HNSCC细胞的迁移和侵袭。
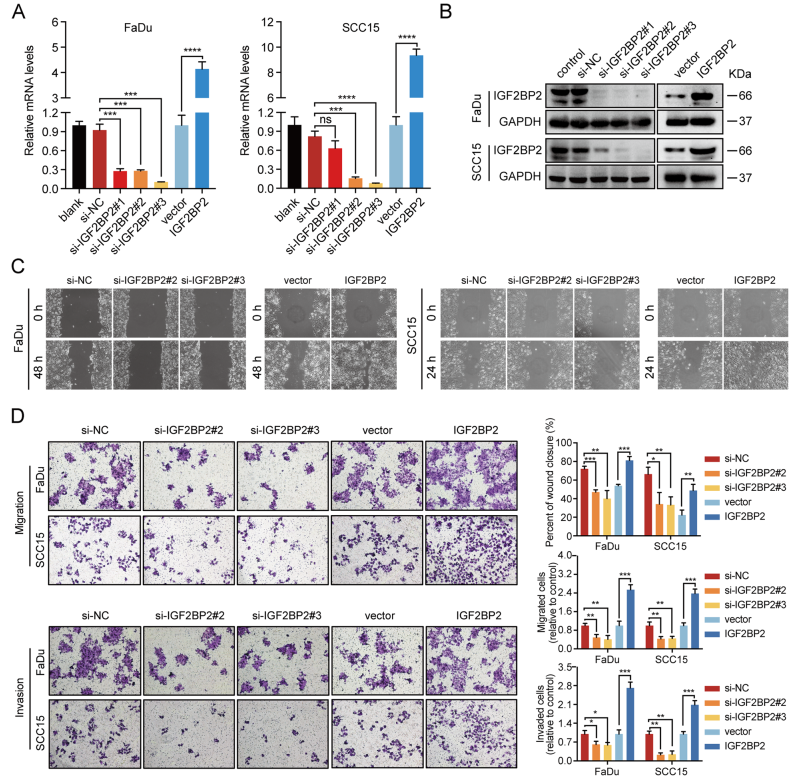
图3 IGF2BP2促进体外HNSCC细胞转移行为
4. 在体内,IGF2BP2基因敲除可抑制淋巴转移和淋巴管生成
为了进一步确定IGF2BP2在HNSCC淋巴转移中的作用,使用裸鼠建立腘窝淋巴结转移模型(图4A)。RT-qPCR和western blot验证IGF2BP2的沉默效率(图4B,4C),然后将这些细胞注射插入裸鼠中。4周后,通过体内生物发光成像检测IGF2BP2对淋巴转移的影响。IGF2BP2基因敲除显著抑制了HNSCC细胞的淋巴转移(图4D)。此外,sh-IGF2BP2组的脚掌肿瘤和腘窝淋巴结均比sh-NC组小、轻,提示IGF2BP2抑制了HNSCC的肿瘤发生和淋巴转移(图4E-J)。此外,sh-IGF2BP2组的LN转移率低于sh-NC组(图4K)。免疫组化分析显示,沉默IGF2BP2显著降低了小鼠组织瘤内和瘤周区域的微淋巴管密度水平,这由lyve1阳性微血管表明(图4L)。这些结果表明,在体内,IGF2BP2基因敲除显著抑制淋巴转移和淋巴管生成。
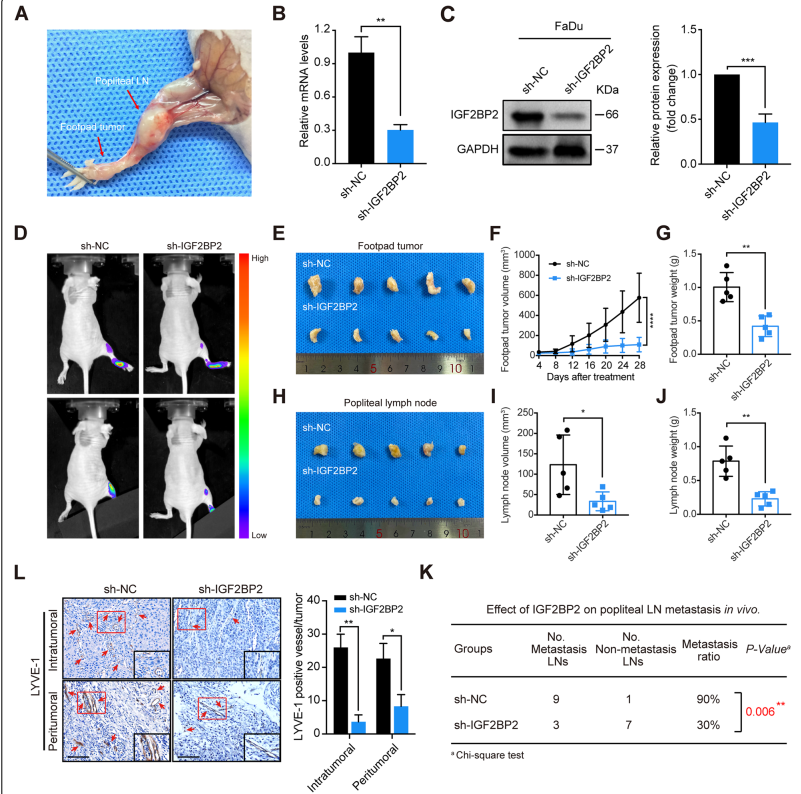
图4体内IGF2BP2基因敲除抑制淋巴转移和淋巴管生成
5. IGF2BP2调控HNSCC细胞的EMT程序
为了分析IGF2BP2在调节EMT中的作用,用TGF-β处理FaDu和SCC15细胞。72小时后,观察到细胞-细胞接触减少,梭形形态为间充质细胞(图5A)。此外,免疫荧光染色和共聚焦成像分析显示,经TGF-β处理的FaDu和SCC15细胞形成了广泛的丝状足和板状足,如白色箭头所示,使细胞获得了迁移和侵袭能力(图5B)。此外,western blot分析显示,TGF-β诱导两种HNSCC细胞E-Cadherin表达减少,这被认为是EMT转移的标志(图5C)。这些数据表明,经TGF-β处理的HNSCC细胞系处于EMT过程中。
RT-qPCR和western blot分析显示,在经TGF-β处理的FaDu和SCC15细胞中,IGF2BP2缺失可下调N-Cadherin和vimentin的表达水平,而E- cadherin在mRNA和蛋白水平上上调(图5D-E)。免疫荧光染色和共聚焦成像分析进一步证实,沉默IGF2BP2导致波形蛋白表达的丢失,同时在两种HNSCC细胞的细胞表面E-Cadherin的保留,这表明IGF2BP2可能调节EMT程序(图5F)。为了进一步证实IGF2BP2在EMT中的作用,在没有TGF-β处理的情况下,用IGF2BP2和相应的对照载体转导FaDu和SCC15细胞,检测了EMT相关标记物,发现E-Cadherin确实下调了,而N-Cadherin和vimentin在mRNA和蛋白水平均上调(图5G-H)。综上所述,这些发现表明IGF2BP2在调节HNSCC细胞的EMT程序中具有重要的功能。
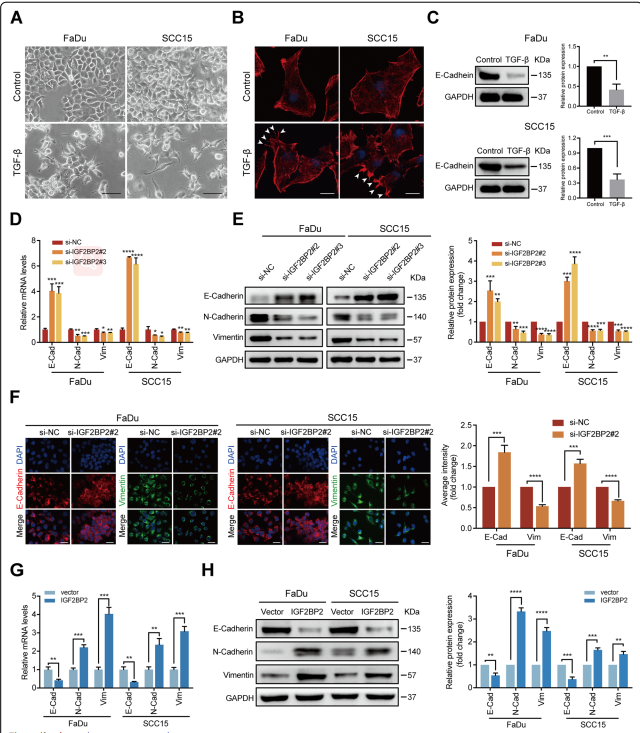
图5 IGF2BP2调控HNSCC细胞EMT程序
6. 在HNSCC细胞中,Slug参与IGF2BP2调控的EMT
在HNSCC的TCGA数据库中,spearman相关分析显示,与Snail、ZEB1和Twist相比,在502份HNSCC组织样本中,Slug和IGF2BP2之间的正相关性最强,表明在HNSCC中IGF2BP2和Slug之间可能存在正调控机制(图6A)。此外,根据TCGA数据库,从IGF2BP2high表达的HNSCC组织到IGF2BP2low表达的HNSCC组织,再到正常的邻近组织,均观察到Slug的表达水平显著降低(图6B)。RT-qPCR和western blot分析显示,抑制IGF2BP2显著降低了FaDu和SCC15细胞中mRNA和蛋白水平的Slug表达,而过表达IGF2BP2显著增强了Slug的表达(图6C-F)。同时,在FaDu和SCC15细胞中,Snail、ZEB1和Twist的mRNA水平无显著或一致的变化(图6C)。western blot分析结果显示,在FaDu细胞中,敲除Slug可拮抗过表达IGF2BP2诱导的波形蛋白上调和E-Cadherin下调(图6G)。相反,在FaDu细胞中,IGF2BP2过表达部分逆转了由Slug抑制引起的波形蛋白下调和E-Cadherin上调(图6G)。此外,创伤愈合实验表明,沉默Slug可减弱FaDu细胞中IGF2BP2过表达对细胞迁移的促进作用(图6H)。另外,IGF2BP2高表达标本表现为高Slug表达,而IGF2BP2低表达标本表现为低至中等Slug表达(图6I)。根据免疫组化定量评分,IGF2BP2与Slug表达呈稳健的正相关(r =0.752, p-value < 0.001)(图6 j)。这些发现表明,Slug在IGF2BP2调控的HNSCC EMT中具有关键作用。

图6 Slug参与了HNSCC细胞中IGF2BP2调节的EMT
7. IGF2BP2通过修饰m6A调控slug mRNA的稳定性
使用抗IGF2BP2抗体在FaDu和SCC15细胞中进行了RIP-qPCR检测,结果显示与IgG对照组相比,Slug mRNA显著富集,证实了IGF2BP2和Slug mRNA之间的相互作用(图7A)。为了验证Slug是否受m6A修饰的影响,从而导致IGF2BP2识别甲基化Slug,我们进行了MeRIP qPCR分析,并确定与相应的对照细胞相比,IGF2BP2的敲除显著降低了FaDu和SCC15细胞中Slug的m6A水平(图7B)。基于SRAMP软件分析,在Slug mRNA的CDS区域发现了一个非常可信的m6A位点(图7C)。为了验证假设的m6A位点,使用含有野生型(WT) Slug-CDS或突变型(MT) Slug-CDS序列的荧光素酶报告基因进行了检测(图7D)。如预期的那样,当IGF2BP2沉默时,SlugWT的荧光素酶活性显著减弱,而Slug-MT的荧光素酶活性似乎不受影响(图7E)。此外,mRNA稳定性分析显示,在FaDu和SCC15细胞中,IGF2BP2沉默后,Slug mRNA的表达量降低,且Slug mRNA的半衰期持续缩短(图7F)。总的来说,这些发现表明IGF2BP2以m6A修饰依赖的方式直接将CDS区与Slug mRNA结合并稳定其mRNA。
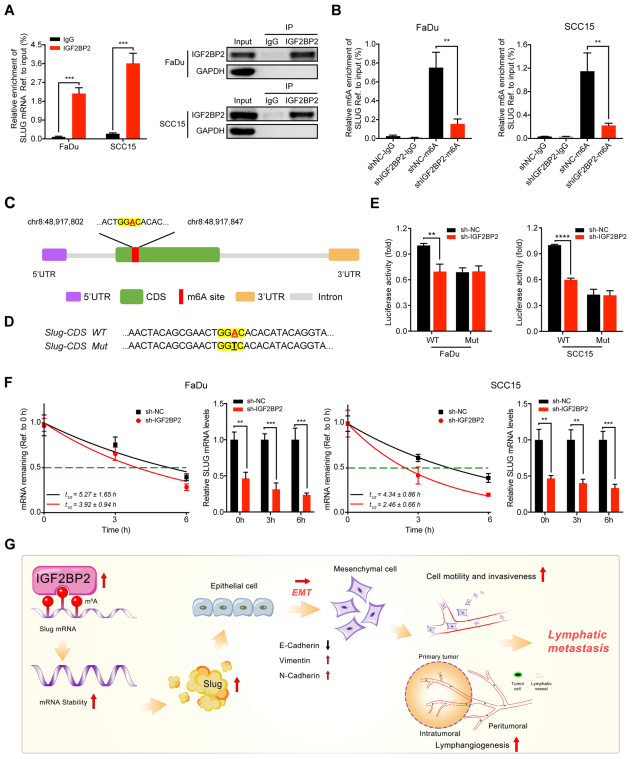
图7 IGF2BP2通过修饰m6A调控slug mRNA的稳定性
结论:
综上所述,该研究首次揭示了IGF2BP2在促进HNSCC淋巴转移中的临床和生物学功能,并证明IGF2BP2通过稳定Slug mRNA,以m6A依赖的方式促进EMT和细胞转移(图7G)。这些结果表明,IGF2BP2可以作为LN转移的预测生物标志物,也是HNSCC患者抗转移治疗的潜在靶点。
参考文献:
Yu D, Pan M, Li Y, Lu T, Wang Z, Liu C, Hu G. RNA N6-methyladenosine reader IGF2BP2 promotes lymphatic metastasis and epithelial-mesenchymal transition of head and neck squamous carcinoma cells via stabilizing slug mRNA in an m6A-dependent manner. J Exp Clin Cancer Res. 2022, 41(1):6.






